3.1. Общие принципы лечения больных ВИЧ-инфекцией
Лекарственная терапия ВИЧ-инфекции включает в себя базисную терапию, а также терапию вторичных и сопутствующих заболеваний. Под базисной терапией понимают терапию, назначение которой определяется стадией и фазой заболевания, а также значением лабораторных маркеров прогрессирования ВИЧ-инфекции (количество CD4+-лимфоцитов и уровень РНК ВИЧ). Базисная терапия включает АРТ и химиопрофилактику вторичных заболеваний.
3.2. Антиретровирусная терапия
В настоящее время основным компонентом лечения больных ВИЧ-инфекцией является АРТ, с помощью которой можно добиться контролируемого течения заболевания, то есть состояния, при котором, несмотря на невозможность полного излечения, удается остановить прогрессирование болезни, предотвратить развитие вторичных заболеваний или добиться их регресса (если вторичные заболевания уже успели развиться), предотвратить потерю трудоспособности (или восстановить ее), увеличить продолжительность жизни пациента, снизить его контагиозность (по имеющимся данным, лица, принимающие АРТ и имеющие неопределяемую ВН, не передают вирус половым путем).
АРТ основана на назначении пациенту препаратов, подавляющих размножение ВИЧ. Такие препараты называются противоретровирусными (антиретровирусными).
Основной целью АРТ является увеличение продолжительности и сохранение качества жизни пациентов.
Дополнительными целями являются:
- снижение контагиозности пациента, что приводит к снижению риска передачи ВИЧ-инфекции (при половых контактах; от инфицированной ВИЧ женщины ребенку во время беременности, родов и при грудном вскармливании; от ВИЧ-инфицированного пациента медицинским работникам при возникновении аварийной ситуации во время оказания пациенту медицинской помощи);
- уменьшение финансовых затрат, связанных с госпитализацией, лечением вторичных заболеваний, нетрудоспособностью пациента;
- снижение демографических потерь, связанных со снижением репродуктивной способности и сокращением репродуктивного периода жизни.
Основной задачей АРТ, позволяющей добиться этих целей, является максимальное подавление размножения ВИЧ, что выражается в снижении ВН до неопределяемого уровня. При этом если для достижения противоэпидемического эффекта (незаразности пациента), согласно рекомендациям ВОЗ, достаточно снижения уровня РНК ВИЧ в крови < 1000 копий/мл, то для предотвращения развития резистентности и прогрессирования заболевания уровень РНК ВИЧ должен быть снижен до максимально низкого, по крайней мере, до уровня ниже порога определения тест-систем с порогом аналитической чувствительности не более 50 копий/мл.
Подавление репликации ВИЧ останавливает гибель CD4+-лимфоцитов, что приводит к восстановлению их популяции (рост количества CD4+-лимфоцитов в среднем на 100 клеток/мкл в год) и функциональной активности. Восстановление иммунитета ведет к предотвращению развития вторичных заболеваний, а если они уже развились – к их исчезновению. Это, в свою очередь, улучшает качество жизни пациента, сохраняет или восстанавливает его трудоспособность, предотвращает преждевременную смерть. Снижение содержания вирусов в крови, сперме, влагалищных выделениях снижает контагиозность пациентов. Кроме того, эффективное подавление размножения ВИЧ снижает вероятность развития мутаций, приводящих к возникновению штаммов, резистентных к терапии.
К принципам АРТ можно отнести:
- добровольность – осознанное участие пациента в принятии решения о начале лечения и его проведении, основанное на понимании преимуществ АРТ и связанных с ней проблем, выраженное информированным согласием;
- своевременность – как можно более раннее начало АРТ, особенно при выявлении неотложных показаний к ней;
- адекватность – тщательный выбор лекарственных препаратов с подбором оптимального для данного конкретного пациента их сочетания на основании существующих рекомендаций;
- непрерывность – постоянный прием антиретровирусных препаратов.
3.2.1. Показания для начала АРТ у взрослых и подростков
Традиционно показания к назначению АРТ больным ВИЧ-инфекцией основывались на:
- наличии клинической симптоматики вторичных заболеваний, которая свидетельствует о наличии иммунодефицита и отражается в стадии и фазе ВИЧ-инфекции по Российской классификации ВИЧ-инфекции (клинические показания);
- снижении количества CD4+-лимфоцитов в крови (иммунологические показания);
- наличии и выраженности репликации ВИЧ, оцениваемой по уровню РНК ВИЧ в плазме крови (вирусологические показания).
В настоящее время показанием к назначению АРТ является само наличие ВИЧ-инфекции у пациента. То есть АРТ рекомендуется назначать всем больным ВИЧ-инфекцией, независимо от наличия клинических проявлений (строгая рекомендация, средний уровень доказательности).
В приоритетном и неотложном порядке АРТ надо назначать (строгая рекомендация, высокий уровень доказательности):
- пациентам со стадиями заболевания 2В, 4 и 5 (пацентам с вторичными заболеваниями), независимо от количества CD4+-лимфоцитов и РНК ВИЧ в крови;
- пациентам с количеством CD4+-лимфоцитов < 350 клеток/мкл вне зависимости от стадии и фазы болезни;
- беременным.
Также в приоритетном порядке АРТ рекомендуется назначать (строгая рекомендация, средний уровень доказательности):
- пациентам с ВН > 100 000 копий/мл;
- женщинам, планирующим беременность;
- пациентам старше 50 лет;
- больным ХГС;
- больным с хроническим заболеванием почек;
- больным ХГВ;
- больным, перенесшим туберкулез;
- больным с нарушениями познавательной деятельности (когнитивными расстройствами);
- пациентам с выраженной анемией или тромбоцитопенией, если они являются проявлениями ВИЧ-инфекции;
- пациентам с заболеваниями, требующими длительного применения терапии, угнетающей иммунитет (лучевая терапия, кортикостероидные гормоны, цитостатики);
- инфицированному ВИЧ партнеру, имеющему постоянного ВИЧ-негативного партнера, при условии предварительного консультирования обоих;
- при подготовке ВИЧ-инфицированного пациента к применению вспомогательных репродуктивных технологий.
3.2.2. Действия при выявлении неотложных показаний к АРТ, обследование перед началом АРТ
Период от выявления неотложных показаний к АРТ до ее начала должен быть максимально сокращен. Он не должен превышать 2 нед., особенно при количестве CD4+-лимфоцитов < 200 клеток/мкл. Поэтому консультационную работу по подготовке пациента к лечению необходимо начинать при первой же консультации лечащего врача и продолжать ее при каждой последующей.
Перед назначением АРТ при необходимости проводится дополнительное обследование больного, в результате которого необходимо решить следующие задачи:
1. Получить исходные данные о состоянии пациента, необходимые для последующей оценки эффективности проводимой терапии (критерии эффективности).
2. Выявить возможные противопоказания к тем или иным антиретровирусным препаратам или факторы риска их применения, а также исходные данные, которые позволят оценивать безопасность проводимой терапии (критерии безопасности).
3. Подобрать оптимальную для данного конкретного пациента схему АРТ.
Прием антиретровирусных препаратов можно начинать до того, как будут окончательно установлены стадия и фаза заболевания и получены результаты исследования, не связанные с определением безопасности АРТ.
Лечение проводится на добровольной основе и предполагает активное участие самого больного. Поэтому важнейшим компонентом успеха АРТ является психологическая подготовка пациента, неотъемлемая часть которой – консультирование по вопросам приверженности лечению и рисков нарушения ее эффективности, его предполагаемой эффективности, противопоказаний и осложнений планируемой терапии. Женщинам детородного возраста сообщают о возможном влиянии проводимого лечения на течение беременности и развитие плода. Вся информация должна быть представлена больному не только в устном, но и в письменном виде.
Перед назначением лечения необходимо получить письменное информированное согласие пациента.
Обследование, проводимое с целью выявления возможных противопоказаний к терапии и ее компонентам (так называемые тесты безопасности), на основании которых подбирается оптимальная для пациента схема АРТ и в дальнейшем оценивается безопасность лечения, включает:
- осмотр лечащим врачом (включая консультирование, сбор анамнеза, полное физикальное обследование, выявление сопутствующих заболеваний, регистрацию сопутствующей терапии);
- регистрацию вторичных заболеваний и определение динамики их течения;
- определение индекса качества жизни;
- рентгенографию органов грудной клетки при наличии признаков поражения органов дыхания или если ее не проводили в течение последних 6 мес.;
- консультацию невролога (при назначении d4T или ddI);
- для женщин – консультацию гинеколога (если ее не проводили в течение последних 6 мес.);
- общий анализ крови (гемоглобин, гематокрит, тромбоциты, эритроциты, лейкоциты и лейкоцитарная формула);
- биохимический анализ крови (общий белок, холестерин, креатинин, АЛТ, АСТ, ЩФ, ЛДГ, билирубин и его фракции, КФК, амилаза или липаза, глюкоза);
- общий анализ мочи;
- для женщин детородного возраста – экспресс-тест на беременность (не менее чем за 3 дня до начала лечения),
Другие исследования можно проводить при наличии дополнительных показаний, в частности, учитывая особенности отдельных препаратов (спектр побочных эффектов, лекарственные взаимодействия, определение рецепторов чувствительности и т. д.).
При назначении некоторых препаратов рекомендуется иметь результаты и других тестов, позволяющих оценить их потенциальную эффективность и безопасность.
К таким исследованиям можно отнести:
- при назначении АВС или содержаих его препаратов – исследование на генетическую предрасположенность к гиперчувствительности к АВС – определение HLA B*5701, если ее не проводили ранее (невозможность проведения теста не является абсолютным противопоказанием для назначения АВС), а также исследование уровня РНК ВИЧ в плазме крови;
- если предполагается назначить ингибиторы ССR5 (MVC) – тестирование тропизма ВИЧ к CCR5-рецепторам;
- при назначении TDF или TAF – общий анализ мочи и определение уровня креатинина в сыворотке крови (расчет скорости клубочковой фильтрации);
- при назначении RPV и содержащих его препаратов, – исследование уровня РНК ВИЧ и количества СD4+-лимфоцитовв в крови.
Отсутствие возможности проведения этих исследований не должно быть причиной задержки назначения АРТ, так как практически всегда возможен подбор альтернативного препарата
Поскольку весь комплекс исследований может занять длительное время, часть их можно провести уже после начала приема антиретровирусных препаратов. Также можно начать терапию, не дожидаясь получения результатов некоторых исследований, материалы для которых, тем не менее, должны быть взяты до начала лечения. Например, результаты исследования ВН не влияют на выбор терапии (за исключением случаев, когда предполагается назначить схему, содержащую АВС или RPV). Эти результаты нужны для оценки эффективности терапии и представляют ценность лишь в сравнении с исследованием, проведенным уже на фоне лечения (как минимум через 1 мес. после его начала).
Однако исследования, непосредственно влияющие на выбор эффективной и безопасной для пациента схемы АРТ, должны быть проведены до начала лечения. К ним относятся общий и биохимический (по крайней мере, определение уровней АЛТ, АСТ, креатинина или мочевины) анализы крови.
3.2.3. Антиретровирусные препараты
Антиретровирусные (противоретровирусные) препараты нацелены на уязвимые этапы жизненного цикла ВИЧ и тем самым препятствуют его размножению. В настоящее время уже создано и внедрено в клиническую практику достаточно много таких препаратов. Создаются и испытываются новые препараты. Однако все они лишь подавляют размножение ВИЧ и не способны уничтожить генетический материал вируса, интегрированный в ДНК клетки хозяина. Они не способны привести к элиминации вируса из организма, то есть к полному излечению от ВИЧ-инфекции.
В мировой клинической практике применяют следующие группы антиретровирусных препаратов.
1. Нуклеозидные ингибиторы обратной транскриптазы (НИОТ) ВИЧ блокируют процесс обратной транскрипции (синтез вирусной ДНК на матрице вирусной РНК). Представляют собой измененные молекулы нуклеозидов или нуклеотидов (отсюда и название – нуклеозидные аналоги), встраивающиеся в синтезируемую цепочку ДНК и прекращающие ее дальнейшую сборку.
2. Ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ) блокируют необходимый для осуществления обратной транскрипции вирусный фермент – обратную транскриптазу ВИЧ.
3. Ингибиторы протеазы (ИП) – препараты, блокирующие процесс формирования полноценных белков ВИЧ и, в конечном итоге, сборку новых вирусов.
4. Препараты, воздействующие на рецепторы, используемые вирусом для проникновения ВИЧ в клетку хозяина (ингибиторы фузии или слияния и ингибиторы хемокиновых рецепторов – CCR5).
5. Препараты, блокирующие процесс встраивания провирусной ДНК в ДНК человека с помощью фермента ВИЧ – интегразы – ингибиторы интегразы (ИИ) ВИЧ.
В России получили разрешение к применению 30 антиретровирусных препаратов (не считая дженериков и лекарственных форм, содержащих в себе несколько препаратов, называемых также препаратами с фиксированной комбинацией доз), в том числе 9 ингибиторов обратной транскриптазы ВИЧ из группы НИОТ (абакавир, диданозин, зальцитабин, зидовудин, ламивудин, ставудин, тенофовир, фосфазид, эмтрицитабин), 6 – из группы ННИОТ (доравирин, невирапин, рилпивирин, элсульфавирин, этравирин, эфавиренз), 9 – из группы ИП ВИЧ (атазанавир, дарунавир, индинавир, лопинавир, нелфинавир, ритонавир, саквинавир, типранавир, фосампренавир), 1 ингибитор слияния (энфувиртид), 1 ингибитор CCR5-рецепторов (маравирок) и 4 ИИ ВИЧ (биктегравир, долутегравир, ралтегравир, элвитегравир). Некоторые их этих препаратов уже вышли или выходят из употребления.
3.2.4. Схемы АРТ (характеристика и принципы составления)
В настоящее время АРТ проводится по схемам так называемой высокоактивной антиретровирусной терапии (ВААРТ), когда пациенту одновременно назначают не менее трех антиретровирусных препаратов. При этом лечение проводится пожизненно, за исключением превентивной терапии (химиопрофилактики), проводимой после эпидемически значимого контакта с больным ВИЧ-инфекцией или инфицированным ВИЧ материалом. Ранее, когда существовали антиретровирусные препараты только группы НИОТ, АРТ проводили по схемам монотерапии (одним препаратом) или битерапии (двумя препаратами). Поскольку монотерапия и битерапия кардинально уступают ВААРТ в эффективности, в настоящее время эти схемы не применяются. Исключение составляют назначаемые с целью упрощения АРТ схемы битерапии ИП/r + НИОТ, ИИ + ИП/r, ИИ + НИОТ или ИИ + ННИОТ, однако они принципиально отличаются от ранее применяемых схем битерапии, поскольку включают в себя препараты разных групп, из которых как минимум один обладает высоким барьером резистентности.
3.2.4.1. Последовательность назначения схем АРТ
Выделяют схемы АРТ первого, второго и т. д. ряда (линии) и схемы резерва (схемы спасения).
Под схемами первого ряда понимают схемы, назначаемые пациентам, которые ранее не получали АРТ или у которых АРТ возобновляется после перерыва (причем ранее получаемая схема осталась эффективной до момента ее прерывания). Также к схемам первого ряда относятся схемы, измененные вследствие развития побочных эффектов или в целях оптимизации.
Под схемами второго ряда подразумевают режимы АРТ, применяемые в случае неэффективности схем первого ряда. Этим они отличаются от схем, которые назначают особым категориям больных или при непереносимости ранее получаемой схемы. Соответственно схемы третьего ряда назначают при неэффективности схем второго ряда.
Схемы резерва (схемы спасения) – нестандартные схемы, которые применяются при неэффективности схем второго и последующих рядов. Обычно они включают в себя препараты разных групп, подбор которых осуществляется индивидуально, исходя из анализа результатов исследования резистентности возбудителя и ранее проводимой терапии. В ряде случаев нестандартные схемы АРТ с индивидуальным подбором препаратов могут применяться и в качестве схем первого, второго ряда для лечения пациентов, которым вследствие имеющихся сопутствующих заболеваний или непереносимости не могут быть назначены стандартные схемы.
3.2.4.2. Приоритетность выбора схем АРТ
Различают предпочтительные, альтернативные и приемлемые схемы АРТ. В качестве предпочтительных и альтернативных используют схемы с доказанной вирусологической эффективностью, безопасностью и хорошей переносимостью.
Предпочтительные – схемы, оптимальные по совокупности параметров: эффективность, безопасность (наименьшая вероятность развития угрожающих жизни побочных эффектов), переносимость (наименьшая частота развития побочных эффектов), удобство приема, экономичность, в том числе для отдельных групп пациентов.
Альтернативные – схемы, уступающие предпочтительным по какому-либо параметру, или менее изученные.
Приемлемые – схемы, эффективность которых менее изучена, или нежелательные явления выражены в большей степени по сравнению с предпочтительными или альтернативными схемами. Эти схемы могут быть назначены при невозможности применения предпочтительных или альтернативных схем (в том числе на временной основе), так как их назначение все же лучше, чем полное отсутствие АРТ.
При выборе схемы лечения для конкретного пациента с позиции «общественного здравоохранения» рекомендуется сначала рассматривать возможность назначения пациенту наиболее экономичной из предпочтительных для него схем. Если имеются данные, свидетельствующие о том, что альтернативная схема будет для данного пациента более эффективной, безопасной или переносимой (то есть пациент относится к одной из особых групп), назначают альтернативную схему. Альтернативные схемы назначают также пациентам, у которых развилась непереносимость приоритетной схемы. Приемлемые схемы могут применяться только при невозможности (например, из-за непереносимости) назначения предпочтительных и альтернативных схем.
3.2.4.3. Антиретровирусные препараты и их сочетания, не рекомендуемые для проведения АРТ
1. Любая монотерапия, за исключением бустированных ИП (см. приемлемые схемы), из-за низкой эффективности и высокой вероятности развития резистентности.
2. Любая битерапия из-за низкой эффективности и высокой вероятности развития резистентности, за исключением схем АРТ, приведенных в альтернативных и предпочтительных схемах.
3. Тритерапия препаратами из группы НИОТ из-за низкой эффективности и высокой вероятности развития резистентности, за исключением комбинации ZDV + 3TC + ABC, применяемой в качестве приемлемой схемы у больных ВИЧ-инфекцией и туберкулезом при исходном уровне РНК ВИЧ < 100 000 копий/мл, или комбинации ZDV + 3TC + TDF (С3).
4. Любое сочетание аналогов одного нуклеозида, которые конкурируют при фосфорилировании и в результате снижают эффективность друг друга. Например, ZDV, d4T и Ф-АЗТ (все препараты являются аналогами тимидина) или 3ТС и FTC (препараты являются аналогами цитидина).
5. d4T + ddI (повышение токсичности и риск развития угрожающих жизни осложнений, в особенности во время беременности).
6. TDF + ddI (в дозе 400 мг) – значительное повышение токсичности ddI, снижение иммунологической эффективности терапии.
7. EFV + NVP или ETR (повышение токсичности).
8. NVP – женщинам при количестве CD4+-лимфоцитов > 250 клеток/мкл, мужчинам – > 400 клеток/мкл (повышенная вероятность развития гепатотоксичности как проявления реакции гиперчувствительности).
9. ETR + «не усиленные» RTV ИП (ETR снижает концентрации ИП).
10. ETR + некоторые «усиленные» RTV ИП (ATV/r, FPV/r – ETR снижает их концентрации).
11. IDV + ATV (повышение токсичности).
12. DRV, SQV, TPV без «усиления» RTV (из-за низкой эффективности и высокой вероятности развития резистентности).
13. Небустированный ATV с TDF (возможно снижение эффективности).
14. АВС и содержащие его препараты при ВН > 100 000 копий/мл.
15. RVP и содержащие его препараты при ВН > 100 000 копий/мл или количестве CD4+-лимфоцитов < 200 клеток/мкл.
3.2.5. Оценка эффективности АРТ
3.2.5.1. Критерии, используемые для оценки эффективности АРТ
Для оценки эффективности АРТ используют клинические и лабораторные критерии.
Клинические критерии – оценка прогрессирования ВИЧ-инфекции и течения вторичных заболеваний – являются наиболее доступными показателями клинической эффективности лечения для практического врача и, в долгосрочном плане, наиболее объективными. Однако при краткосрочном наблюдении они недостаточно достоверны из-за характерной для ВИЧ-инфекции медленной динамики заболевания, невозможности быстрого восстановления угнетенного иммунитета. Кроме того, обострение течения имеющихся у больного вторичных заболеваний или появление новых после начала АРТ может быть проявлением синдрома восстановления иммунной системы. Особенно это характерно для пациентов с количеством CD4+-лимфоцитов < 50 клеток/мкл. Поэтому признаки клинического прогрессирования ВИЧ-инфекции на фоне АРТ в течение первых 12 нед. ее проведения обычно не рассматриваются как признак ее неадекватности.
Из лабораторных критериев оценки эффективности лечения наиболее информативным в настоящее время считается определение в крови уровня CD4+-лимфоцитов и ВН.
В России для определения ВН используется в основном метод ПЦР.
ВН считается наиболее, а клиническая динамика – наименее достоверным показателем эффективности АРТ. Если эти критерии не соответствуют друг другу, надо ориентироваться на результаты исследования ВН, а при отсутствии возможности такого исследования – на изменение количества CD4+-лимфоцитов.
3.2.5.2. Ожидаемый эффект АРТ
При хорошем эффекте АРТ уже к 4–8-й нед. после начала лечения ожидается снижение уровня РНК ВИЧ приблизительно в 10 раз (то есть на 1 log10), к 12–16-й нед. – ниже 400 копий/мл, а через 24 нед. – ниже 50 копий/мл (ниже уровня определения) (А1). К этому же сроку (12–24-я нед.) можно ожидать и повышения количества CD4+-лимфоцитов. В дальнейшем уровень РНК ВИЧ должен быть ниже уровня определения, но возможны разовые подъемы, не превышающие 1000 копий/мл; ожидается повышение уровня CD4+-лимфоцитов в среднем на 5–10 клеток/мкл в 4 нед. (В1). По мере повышения уровня CD4+-лимфоцитов происходит регресс вторичных заболеваний (если они были).
Однако у части пациентов АРТ не столь удачна. У 10–30% из них в течение полугода не удается снизить ВН ниже 50 копий/мл.
3.2.5.3. Факторы, способствующие неудаче АРТ
Факторы, способствующие неудаче АРТ, многообразны:
- высокий уровень ВН, низкий уровень СD4+-лимфоцитов, наличие тяжелых вторичных заболеваний при начале лечения;
- изначальная резистентность вируса к применяемым препаратам;
- неадекватная предшествующая терапия;
- нарушение режима приема лекарств (из-за недостаточной приверженности лечению, развития побочных реакций на прием препаратов, несоблюдения пищевого режима);
- неправильное назначение терапии (неподходящая для пациента схема лечения, плохое консультирование по режиму приема препаратов и т. д.);
- сопутствующий прием лекарств, снижающих эффективность какого-либо из компонентов АРТ.
3.2.5.4. Критерии неэффективности АРТ
АРТ считается недостаточно эффективной (или потерявшей эффективность) в следующих случаях:
- появление новых или рецидив ранее отмечавшихся вторичных заболеваний (не ранее чем через 12 нед. после начала лечения) (С2);
- отсутствие повышения количества CD4+-лимфоцитов более чем на 50 клеток/мкл в течение 1 года лечения (В2);
- снижение количества CD4+-лимфоцитов ниже уровня, отмеченного до начала АРТ (В1);
- снижение количества CD4+-лимфоцитов более чем на 50% ниже пикового уровня, достигнутого в ходе лечения (В2);
- отсутствие снижения уровня РНК ВИЧ в сыворотке крови ниже 400 копий/мл (2,6 log10) через 12–16 нед. или 50 копий/мл (1,7 log10) через 24 нед. после начала лечения (А1);
- повышение ВН до уровня > 1000 копий/мл (3,0 log10) в двух повторных исследованиях, если до этого был достигнут неопределяемый уровень (А1).
Количество CD4+-лимфоцитов и уровень РНК ВИЧ не учитывают как достоверные, если эти исследования проведены менее чем через 4 нед. после перенесенных инфекционных заболеваний или вакцинации.
При получении лабораторных результатов, свидетельствующих о неэффективности терапии, для их подтверждения исследование следует повторить с интервалом не менее 4 нед.
3.2.5.5. Действия при выявлении неэффективности АРТ
Если неэффективность терапии подтверждается, проводят анализ возможных причин неудачи. Чаще всего она связана с нарушением режима приема препаратов. Поэтому сначала следует исключить причины, не связанные с устойчивостью вируса к принимаемым препаратам.
Необходимо обратить внимание на следующие моменты:
- соблюдение пациентом режима приема препаратов (отсутствие пропусков, соблюдение дозировок, регулярность приема);
- соблюдение предписанного для данной схемы лечения пищевого режима;
- не принимает ли пациент лекарственных препаратов (или психоактивных веществ), влияющих на метаболизм какого-либо из компонентов АРТ или усиливающих ее побочные эффекты.
Если выясняется, что нарушения режима приема или несоблюдение пищевого режима связаны с недисциплинированностью пациента, с ним проводят работу с целью повышения приверженности терапии. При необходимости привлекают специалиста, имеющего соответствующую подготовку. Возможно назначение более удобного для пациента режима приема препаратов (например, 1, а не 2 раза в день; назначение препаратов, прием которых не зависит от приема пищи) или препаратов с фиксированной комбинацией доз.
Если нарушение режима приема препаратов связано с побочными эффектами, для их коррекции следует назначить патогенетическую или симптоматическую терапию. Возможно проведение дополнительного обследования с целью выявления сопутствующих заболеваний (гепатиты, панкреатит и т. д.) или вредных привычек (прием алкоголя, курение), способствующих появлению побочных эффектов. Проводится лечение сопутствующих заболеваний. При незначительных побочных эффектах, вероятно ухудшающих качество жизни пациента, но не угрожающих его здоровью, или при наличии вредных привычек проводят дополнительное консультирование пациента с целью повышения приверженности терапии. Возможна замена плохо переносимого препарата.
Если причиной неудачи является сопутствующая терапия, проводят коррекцию либо ее, либо схемы АРТ.
Причиной нарушения режима приема препаратов может быть наличие повышенного уровня тревожности или депрессии, а также нейрокогнитивных расстройств (НКР). При подозрении на эти проявления следует провести консультацию психиатра (психотерапевта) и решить вопрос о назначении медикаментозной коррекции, а также проанализировать схему АРТ (побочные действия препаратов со стороны ЦНС). При выявлении НКР необходимо направить пациента на обследование к неврологу и клиническому психологу, решить вопрос о необходимости проведения нейровизуализации и курса(ов) психокоррекции.
Если выясняется, что неудача терапии не связана с вышеперечисленными причинами, рекомендуется смена схемы АРТ.
3.2.6. АРТ первого ряда
Схема АРТ первого ряда – схема, которая не менялась по причине неэффективности. Пациент, возобновляющий ранее прерванную эффективную терапию или сменивший схему лечения из-за ее непереносимости, все равно будет считаться получающим терапию первого ряда.
В приведенных ниже схемах лечения препараты перечисляются в алфавитном порядке (если специально не оговорено их перечисление в порядке приоритетности).
3.2.6.1. Предпочтительные и альтернативные схемы АРТ первого ряда
Стандартная схема АРТ включает 2 НИОТ и третий препарат, которым может быть ННИОТ, ИП или ИП/r, ИИ (табл. 2).
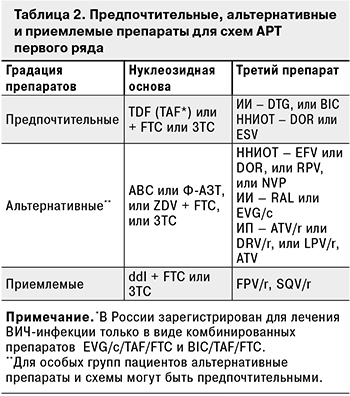
В качестве альтернативной, в том числе при начале терапии, может использоваться редуцированная (двухкомпанентная) схема АРТ: DTG + 3TC (FTC). Ее можно назначать при следующих условиях: стадии ВИЧ-инфекции 3, уровне РНК ВИЧ в плазме крови < 500 000 копий/мл, количестве CD4+-лимфоцитов > 200 клеток/мкл, отрицательном результате обследования на HBsAg и беременность. Выбор такой тактики лечения особенно целесообразен при наличии у пациента факторов, позволяющих предположить плохую переносимость таких препаратов, как Ф-АЗТ, АВС, TDF, ZDV.
Для удобства пациентов, повышения приверженности и, как следствие, эффективности АРТ, облегчения логистики и хранения препаратов рекомендуется назначать их комбинированные формы. Нуклеозидная основа – ABC/ЗТС (600 мг + 300 мг) 1 раз в сутки, TDF/FTC (300 мг + 200 мг) 1 раз в сутки, ZDV/ЗТС (300 мг + 150 мг) 2 раза в сутки, Ф-АЗТ/3ТС (400 мг +150 мг) 2 раза в сутки. Препараты «вся схема в одной таблетке» – DOR/TDF/3TC (100 мг + 300 мг + 300 мг), BIC/TAF/FTC (50 мг + 25 мг + 200 мг), RPV/TDF/FTC (25 мг + 300 мг + 200 мг), EVG/c/TAF/FTC (150мг + 150 мг + 10 мг + 200 мг), ESV/TDF/FTC (20 мг + 300 мг + 200 мг).
3.2.7. Схемы АРТ, рекомендуемые особым группам пациентов
Для некоторых категорий пациентов подбор антиретровирусных препаратов затруднен, и оптимальными (наиболее эффективными, безопасными или переносимыми) могут быть препараты, отнесенные к альтернативным. К таким особым категориям относятся:
1. Пациенты с анемией, эритропенией или гранулоцитопенией.
2. Женщины детородного возраста, не исключающие рождение ребенка на фоне АРТ.
3. Беременные.
4. Пациенты с низким (< 50 клеток/мкл) уровнем CD4+-лимфоцитов.
5. Пациенты старше 50 лет или имеющие нарушения липидного или углеводного обмена.
6. Пациенты с нейрокогнитивными расстройствами.
7. Пациенты, имеющие повышенный уровень аминотрансфераз.
8. Пациенты, получающие лечение ХГС.
9. Пациенты с ХГВ.
10. Пациенты с туберкулезом.
11. Пациенты, страдающие хроническими заболеваниями почек.
12. Пациенты, инфицированные ВИЧ-2.
3.2.7.1. Пациенты с анемией, эритропенией или гранулоцитопенией
Наличие анемии и/или гранулоцитопении является ограничением для назначения ZDV и содержащих его препаратов. Этим пациентам вместо ZDV при умеренной анемии или гранулоцитопении (уровень гемоглобина > 95 г/л или количество эритроцитов меньше нормы, или количество нейтрофилов > 1000 клеток/мкл) рекомендуется назначать Ф-АЗТ или ABC, или TDF, а при более выраженной анемии или гранулоцитопении – АВС или TDF (перечислено в алфавитном порядке). Возможно назначение Ф-АЗТ в уменьшенной дозе (по 200 мг 2 раза в сутки). При невозможности использования вышеперечисленных препаратов могут быть назначены d4T или ddI или применение редуцированных схем АРТ (препарат с высоким барьером резистентости из группы ИП, бустированных RTV или ИИ в сочетании с 3ТС).
Вторым препаратом в нуклеозидной основе схемы АРТ остаются 3TC или FTC.
Выбор третьего препарата проводится на общих основаниях.
Действия в случае развития анемии и эритропении описаны в приложении 4.
3.2.7.2. Женщины, у которых на фоне АРТ не исключены беременность и рождение ребенка
Рекомендуемые предпочтительные схемы АРТ: ATV/r или DTG (при обязательном условии информирования женщины о риске тератогенного эффекта) в сочетании с АВС (при наличии отрицательного результата исследования на HLA B*5701), или TDF + 3ТС, или FTC.
В качестве альтернативного третьего препарата рекомендуются DRV/r, RAL. В качестве приемлемых препаратов – RPV, SQV/r, NVP (при количестве CD4+- лимфоцитов от 50 до 250 клеток/мкл и нормальном уровне АЛТ и АСТ), EFV (при обязательном условии информирования женщины о риске тератогенного эффекта при приеме EFV в I триместре беременности). Как альтернативные НИОТ могут использоваться Ф-АЗТ или ZDV. При невозможности назначения предпочтительных и альтернативных препаратов возможно использование других антиретровирусных препаратов, в инструкции по применению которых беременность не указана в качестве противопоказания.
3.2.7.3. Беременные
В I триместре беременности предпочтительные препараты – ATV/r или DRV/r в сочетании с Ф-АЗТ или АВС (при наличии отрицательного результата обследования на HLA B*5701), или TDF + 3ТС, или FTC.
В качестве альтернативного третьего препарата используются RAL, DTG (при обязательном условии информирования женщины о риске тератогенного эффекта при приеме DTG в I триместре беременности). В качестве приемлемых препаратов – LPV/r, SQV/r, NVP (при количестве CD4+-лимфоцитов от 50 до 250 клеток/мкл и нормальном уровне АЛТ и АСТ), EFV (при обязательном условии информирования женщины о риске тератогенного эффекта). Как альтернативный НИОТ может использоваться ZDV. При плохой переносимости препаратов группы ИП они могут быть, по истечении II триместра беременности, заменены на схему, содержащую DTG.
При начале АРТ после I триместра беременности предпочтительные препараты – DTG в сочетании с Ф-АЗТ или АВС (при наличии отрицательного результата обследования на HLA B*5701) или TDF + 3ТС или FTC.
В качестве альтернативного третьего препарата рекомендуются ATV/r, DRV/r, RAL. В качестве приемлемых препаратов – LPV/, SQV/r, NVP (при количестве CD4+-лимфоцитов от 50 до 250 клеток/мкл и нормальном уровне АЛТ и АСТ), EFV. Как альтернативный НИОТ может использоваться ZDV.
Как приемлемое возможно также назначение других антиретровирусных препаратов, в инструкции по применению которых беременность не указана в качестве противопоказания.
При назначении АРТ в III триместре беременности, особенно после 30 нед., приоритетность назначения DTG как препарата, способного быстро подавлять ВН и к тому же обладающего высоким барьером резистентности, усиливается. В качестве альтернативы при невозможности назначения DTG рекомендуется назначать RAL. Напротив, назначение в III триместре EFV или NVP (препаратов с относитьельно высокой частотой развития побочных эффектов и имеющих низкий барьер резистентности) повышает риск недостаточно быстрого снижения ВН и сохранения ее на определяемом уровне к моменту родов.
Общие принципы назначения и проведения АРТ при беременности
Беременным и женщинам, у которых на фоне АРТ не исключены беременность и рождение ребенка, при подборе оптимальной схемы АРТ рекомендуется назначать препараты, наиболее безопасные для беременной и плода.
Основная проблема состоит в том, что имеются данные о возможном (хоть и очень маловероятном) повышении риска тератогенного эффекта (дефекта формирования нервной трубки) при применении в I триместве беременности DTG, рекомендованного ныне в качестве приоритетного препарата для общей популяции пациентов.
Другие препараты из групп ИИ и ННИОТ, являющиеся предпочтительными для общей популяции пациентов (BIC, DOR, ESV), недостаточно изучены в плане эффективности и безопасности при применении у беременных.
Потенциальные ограничения при применении у беременных имеют и некоторые другие препараты. В основном они связаны с наличием данных о возможном отрицательном влиянии на течение беременности и развитие плода; повышением риска развития побочных эффектов; изменением фармакокинетики препаратов у беременных, приводящим к снижению их эффективности; ухудшению переносимости или необходимости коррекции дозы; недостаточной изученностью этих вопросов. Как недостатки при применении у беременных некоторые эксперты рассматривают низкий барьер резистентности и необходимость приема препаратов более 1 раза в сутки (риск недостаточной комплаентности и в итоге недостаточной эффективности).
В группе ИИ:
- BIC – фармакокинетика у беременной, безопасность для плода и эффективность профилактики вертикальной передачи ВИЧ недостаточно изучены;
- DTG – имеются данные о возможном (хоть и очень маловероятном) повышении риска тератогенного эффекта при применении в I триместве беременности. Хорошо проникает через плацентарный барьер. Исследования на животных риска тератогенности не показали. При назначении женщинам, у которых не исключена беременность на фоне АРТ, или беременным необходимо информирование о возможности тератогенного эффекта;
- EVG/c – не рекомендован беременным из-за существенного нарушения фармакокинетики (снижения концентрации препарата в крови) и риска недостаточной эффективности;
- RAL – показал себя как препарат, эффективный и безопасный для беременной и плода, но не рассматривается как предпочтительный из-за низкого барьера резистентности.
В группе ННИОТ:
- DOR – фармакокинетика у беременной, безопасность для плода и эффективность профилактики вертикальной передачи ВИЧ изучены недостаточно. В исследованиях на животных (крысы, кролики) показана хорошая проницаемость через плацентарный барьер и отсутствие тератогенности;
- EFV – хотя данные о тератогенном эффекте препарата впоследствии не были доказаны, представление о полной безопасности применения EFV во время беременности не бесспорно (в том числе учитывая тот факт, что одним из наиболее значимых и частых побочных эффектов препарата является его влияние на ЦНС, а серьезных исследований влияния приема EFV на психическое развитие детей, матери которых получали его во время беременности, не проводилось). Поэтому его применение женщинами, не исключающими беременность и рождение ребенка, и беременными в I триместре не рекомендуется. На более поздних сроках возможно использование в альтернативных режимах. Во время беременности отмечается незначительное снижение концентрации препарата, не требующее коррекции дозы. Женщинам, у которых беременность наступила на фоне применения EFV, рекомендуется не менять схему терапии, если она эффективна и хорошо переносится. К недостаткам препарата относится и низкий барьер резистентности;
- ETV – безопасность для плода и эффективность профилактики вертикальной передачи ВИЧ недостаточно изучены. Во время беременности отмечается незначительное увеличение концентрации препарата, не требующее коррекции дозы;
- NVP – показал эффективность для профилактики вертикальной передачи ВИЧ и безопасность для плода, однако не рекомендуется для назначения женщинам с количеством CD4+-лимфоцитов > 250 клеток/мкл и повышенным уровнем АЛТ или АСТ), Хорошо проникает через плацентарный барьер. Имеет низкий барьер резистентности;
- RPV – не выявлено отрицательного влияния препарата на развитие плода, но его фармакокинетика при беременности вариабельна, и концентрация в плазме крови имеет тенденцию к снижению, но возможность применения более высоких доз препарата не изучена. При прменении у беременных показан более тщательный контроль ВН. RPV не показан при ВН > 100 000 копий/ мл или количестве CD4+-лимфоцитов < 200 клеток/мкл, Имеет низкий барьер резистентности.
В группе ИП:
- ATV и ATV/r – в бустированном виде ATV/r показал эффективность и безопасность в качестве препарата для профилактики вертикальной передачи ВИЧ. Плохо проникает через плацентарный барьер, не обладает тератогенностью. Прием ATV может сопровождаться повышением уровня билирубина. Не рекомендован беременным в небустированном виде или бустированным Cobi (ATV/с). Не рекомендован в сочетании с TDF и ингибиторами протонной помпы;
- DRV/r – применяется у беременных только по схеме 600 мг + 100 мг 2 раза в сутки с едой. Плохо проникает через плацентарный барьер, не обладает тератогенностью. Прием препарата 1 раз в сутки или в виде DRV/c не рекомендуется;
- LPV/r – долгое время был предпочтительным препаратом, применяемым у беременных (в настоящее время выведен и рассматривается как приемлемый из-за относительно плохой переносимости и риска преждевременных родов). Плохо проникает через плацентарный барьер, не обладает тератогенностью. Прием препарата 1 раз в сутки не рекомендуется. В III триместре беременности рекомендуется применение препарата в повыщенной дозе – 600 мг + 150 мг 2 раза в сутки.
В группе НИОТ все препараты хорошо проникают через плацентарный барьер, и их фармакокинетика при беременности существенно не меняется. Ограничения в применении отдельных препаратов этой группы у беременных связаны преимущественно со спектром их побочных эффектов. АВС может назначаться при условии получения отрицательного результата обследования на HLA B*5701. При применении ZDV и (в меньшей степени) Ф-АЗТ следует уделять особое внимание возможности развития анемии; при применении TDF – почечной недостаточности. Кроме того, хотя TDF и рекомендован к применению у беременных, следует помнить о его потенциальной возможности отрицательно влиять на формирование костной системы плода. Не рекомендуется назначение d4T и ddI, особенно совместное (высокий риск угрожающих жизни побочных эффектов). Сочетание этих препаратов не рекомендуется к применению вообще, но у беременных оно особенно опасно.
Во время беременности не рекомендуется применение небустированных ИП (эффективность может быть недостаточна). Если беременность наступила на фоне приема небустированного ИП, его следует заменить препаратом, рекомендуемым для применения у беременных.
В остальных случаях, если беременность наступила на фоне уже проводимой АРТ, которая хорошо переносится, и достигнута вирусологическая эффективность, лечение следует продолжать по прежней схеме, если обратное не указано в инструкциях по применению препаратов.
При назначении и проведении АРТ у беременных следует опираться на руководства и протоколы по профилактике передачи ВИЧ от матери ребенку.
3.2.7.4. Пациенты с исходно низким (< 50 клеток/мкл) количеством CD4+-лимфоцитов
Предпочтительная схема – DTG + TDF + 3TC (FTC).
Альтернативные схемы:
- третий препарат – другие ИИ (BIC или EVG, или RAL) или ИП (ATV/r или DRV/r, или LPV/r) или ННИОТ (DOR). BIC и EVG в России доступны только в виде комбинированных препаратов BIC/TAF/FTC и EVG/c/TAF/FTC;
- предпочтительная нуклеозидная основа – TDF + 3TC (FTC), альтернативная – АВС + 3ТС (если ВН < 100 000 копий/мл). При невозможноти применения TDF или АВС – Ф-АЗТ + 3TC.
При использовании в схемах АРТ ИИ или DOR, или усиленных RTV ИП отмечено более быстрое и выраженное (по сравнению со схемой, включающей ННИОТ) увеличение количества CD4+-лимфоцитов. Также более быстрое восстановление уровня CD4+-лимфоцитов происходит при применении ABC в сравнении c ZDV (В2). Поэтому для лечения пациентов с низким уровнем CD4+-лимфоцитов рекомендуется применять схемы, включающие ИИ или бустированный ИП, а из ННИОТ – DOR. В качестве нуклеозидной основы рекомендуется применять комбинацию ABC с 3TC (предпочтительно комбинированный препарат ABC/3TC) или TDF с 3TC предпочтительно комбинированный препарат TDF/FTC). Однако у пациентов с ВН > 100 000 копий/мл препараты, содержащие ABC, применять не рекомендуется (была показана меньшая эффективность АВС в сравнении с TDF при ВН > 100 000 копий/мл в схемах, содержащих EFV и ATV/r).
3.2.7.5. Пациенты старше 50 лет или имеющие нарушения липидного и углеводного обмена, больные с риском сердечно-сосудистой патологии
Предпочтительная схема – DTG + TDF + 3TC (FTC).
Альтернативные схемы:
- третий препарат – другие ИИ (BIC или RAL) или ННИОТ (DOR или ESV, или RPV). BIC в России доступен только в виде комбинированного препарата BIC/TAF/FTC. Примененение RPV возможно при уровне CD4+-лимфоцитов > 200 клеток/мкл и ВН < 100 000 копий/мл. Возможность применения ESV при количестве CD4+-лимфоцитов < 200 клеток/мкл и ВН > 100 000 копий/мл недостаточно изучена;
- предпочтительная нуклеозидная основа – TDF (TAF) + 3TC (FTC) (при отсутствии признаков нарушения минерализации костей и/или патологии почек), альтернативная – Ф-АЗТ + 3TC (ZDV + 3TC). При отсутствии у пациентов старше 50 лет других факторов риска сердечно-сосудистых заболеваний возможно назначение АВС + 3ТС (если ВН < 100 000 копий/мл). При невозможности применения TAF, TDF, ABC, Ф-АЗТ возможно назначение ZDV + 3TC.
В качестве альтернативной возможно применение двухкомпонентной схемы DTG + 3TC (при количестве CD4+-лимфоцитов > 350 клеток/мкл и ВН < 100 000 копий/мл).
В качестве приемлемых препаратов (при невозможности применения предпочтительных и альтернативных) могут использоваться EFV или ETR, или NVP [при количестве CD4+-лимфоцитов от 50 до 250 клеток/мкл (для женщин) или от 50 до 400 клеток/мкл (для мужчин) и нормальном уровне активности АЛТ и/или АСТ], или ATV (при количестве CD4+-лимфоцитов > 50 клеток/мкл), или ATV/r, или DRV/r.
При проведении АРТ у пациентов старше 50 лет или пациентов, имеющих другие повышенные риски сердечно-сосудистых заболеваний, предпочтение отдается препаратам, в наименьшей степени влияющим на липидный и углеводный обмен. Это препараты из группы ИИ (не бустированные Cobi) или ННИОТ (за исключением EFV), а также антагонист CCR5-рецепторов MVC. Из ИП наименьшее влияние на углеводный и липидный обмен оказывает небустированный ATV.
Соответственно наиболее неблагоприятны бустированные RTV или Cobi ИП и EVG/с/TAF/FTC (за счет Cobi).
При формировании нуклеозидной основы схемы АРТ у лиц старшего возраста необходимо учитывать, что 2 наиболее современных и малотоксичных препарата группы НИОТ – АВС и TDF – у этих пациентов должны применяться с осторожностью. Это связано с имеющимися данными о нефротоксичности TDF и его неблагоприятном влиянии на минерализацию костей, а также возможном повышении риска ИБС при применении АВС. Могут быть рассмотрены варианты применения препаратов, содержащих TAF, или альтернативных НИОТ.
Действия в случае развития дислипидемии описаны в приложении 4.
При необходимости совместно с кардиологом назначают липидоснижаюшие препараты. Однако при их назначении необходимо учитывать совместимость с антиретровирусными препаратами (приложение 7).
При нарушении углеводного обмена ведение пациента осуществляется совместно с эндокринологом.
3.2.7.6. Пациенты с нарушениями познавательной деятельности (когнитивными расстройствами)
Основным критерием выбора препаратов для данной категории пациентов является способность препаратов хорошо проникать через гематоэнцефалический барьер.
Рекомендуемая схема АРТ:
ИИ (RAL или DTG), а в качестве альтернативы — LPV/r или DRV/r (1200/200 мг в сутки) в сочетании с Ф-АЗТ или ZDV + 3TC. У пациентов с количеством СD4+-лимфоцитов от 50 до 250 клеток/мкл (для женщин) или 400 клеток/мкл (для мужчин) и нормальным уровнем трансаминаз в качестве альтернативы может использоваться NVP.
Следует учитывать, что из препаратов группы НИОТ после ZDV наилучшим проникновением через гематоэнцефалический барьер обладают ABC и d4T. Также хорошим коэффициентом проникновения через гематоэнцефалический барьер обладают ИИ DTG (высокий уровень проникновения) и RAL (уровень проникновения выше среднего).
3.2.7.7. Пациенты с ВИЧ-2
Рекомендуемые схемы АРТ:
DRV/r, или LPV/r в сочетании с Ф-АЗТ или АВС, или TDF, или ZDV + 3TC или FTC.
В качестве альтернативного ИП может использоваться SQV/r. Действие других ИП либо недостаточно изучено, либо показана их недостаточная эффективность (ATV, NFV, IDV).
ИИ (по крайней мере, BIC, DTG и RAL) активны в отношении ВИЧ-2 и предпочтительны в сравнении с ИП, но их применение при этом варианте ВИЧ-инфекции в утвержденных в России инструкциях по применению не указано.
Эти препараты рекомендуется назначать по решению врачебной комиссии.
3.2.7.8. Пациенты с сочетанной инфекцией ВИЧ + ХГВ (B + D)
Рекомендуемые схемы АРТ:
- при нормальном уровне активности АЛТ и/или АСТ или при повышении его не более чем в 2,5 раза выше верхней границы нормы (ВГН) – EFV или RPV, или DOR, или ESV, или ИИ, или ИП/r в сочетании с TDF (или TAF) + 3TC (или FTC);
- при наличии противопоказаний к назначению EFV или при уровне активности АЛТ и/или АСТ более чем в 2,5 раза выше ВГН – ИИ или ИП/r в сочетании с TDF (или TAF) + 3TC (или FTC).
При подборе АРТ пациентам с ХГВ необходимо назначать препараты, обладающие наименьшей гепатотоксичностью.
Решающим фактором для выбора TDF (TAF), 3TC и FTC в схемах АРТ является их способность эффективно подавлять репликацию не только ВИЧ, но и ВГВ. Поэтому сочетание этих препаратов в стандартной дозировке используют в качестве нуклеозидной основы при лечении больных ВИЧ-инфекцией, сочетающейся с гепатитом В или В + D.
При развитии резистентности ВГВ к 3TC (FTC) у пациентов, ранее получавших схему АРТ, не включавшую TDF (TAF), его необходимо назначить вместо другого НИОТ. В качестве альтернативы при невозможности назначения TDF (TAF) дополнительно к АРТ рекомендуется назначение ETV в дозе 1 мг в сутки (3TC при этом не отменяется).
Кроме того, у больных с сочетанием ВИЧ-инфекции и ХГВ при развитии почечной патологии возможна замена TDF на TAF (при СКФ > 30 мл/мин) или на другой препарат из группы НИОТ (АВС или Ф-АЗТ) и добавление ETV в дозе 1 мг в сутки для лечения ХГВ (В2).
При развитии резистентности ВИЧ к 3TC (FTC), но сохранении к нему чувствительности ВГВ, необходимо учитывать высокую вероятность обострения XГВ при замене 3ТС (FTC) другим НИОТ, не активным в отношении ВГВ. При наличии мутации резистентности ВИЧ к 3ТС (M184V) следует сохранить препарат в составе схемы АРТ и добавить TDF (TAF).
Возможно использовать один из следующих альтернативных вариантов:
- подобрать препараты в схему АРТ на основе исследования резистентности ВИЧ, при этом в качестве четвертого препарата оставить 3ТС (FTC), к которому сохранена чувствительность ВГВ;
- к трем дйствующим препаратам вместо 3ТС (FTC) назначить ETV (В3).
Обострение гепатита В может наступить и при отмене TDF (TAF). Поэтому при развитии резистентности к этому препарату или его непереносимости следует заменить TDF (TAF) на другой НИОТ (ABC или Ф-АЗТ) и назначить другой препарат, подавляющий репликацию ВГВ (ETV).
Если имеет место только резистентность ВИЧ к TDF (TAF), но его непереносимости нет, возможно сохранение TDF (TAF) в схеме лечения с добавлением другого НИОТ, к которому ВИЧ сохранил чувствительность.
Проникновение ВГD в клетку осуществляется путем присоединения белка оболочки, представляющего собой так называемый крупный поверхностный антиген ВГB (L-HBsAg), к рецептору на базолатеральной мембране гепатоцитов – натрий-таурохолат котранспортному полипептиду (NTCP), белку-транспортеру солей желчных кислот, являющемуся рецептором входа ВГD в клетку. Препарат булевиртид1 является ингибитором рецептора NTCP, нарушая таким образом проникновение ВГD/ ВГB в клетку.
В качестве этиотропной терапии ХГD больным ВИЧ-инфекцией рекомендуется лечение булевиртидом в комбинации с интерферонами (ИФН) для достижения целей лечения гепатита D (вирусологического, биохимического, комбинированного вирусологического и биохимического и серологического ответа).
Вирусологический ответ – снижение концентрации РНК ВГD на 2 log10 МЕ/мл и более или до неопределяемого уровня по сравнению с исходным во время лечения, через 6 мес. после его завершения и при дальнейшем наблюдении.
Биохимический ответ – нормализация или снижение активности АЛТ и АСТ по сравнению с исходным уровнем во время лечения и после его завершения.
Комбинированный вирусологический и биохимический ответ – снижение концентрации РНК ВГD на 2 log10 МЕ/мл и более по сравнению с исходным уровнем или до неопределяемого уровня (если исходный уровень < 100 МЕ/мл) и нормализация активности АЛТ в конце лечения, через 6 мес. после его завершения и при дальнейшем наблюдении.
Серологический ответ – снижение уровня и исчезновение HBsAg ВГВ в крови, в том числе с образованием антител к нему (HBsAg-сероконверсия) во время лечения и после его завершения.
Показания к началу этиотропного (противовирусного) лечения:
- наличие репликации ВГD (РНК ВГD в крови);
- согласие пациента на проведение противовирусной терапии;
- отрицательный тест на беременность;
- отсутствие противопоказаний к приему препаратов.
Комбинация булевиртида с ИФН рекомендуется пациентам с ХГD, в том числе с компенсированным циррозом печени (класс А по классификации Чайлда–Пью), не имеющим противопоказаний к приему ИФН или их непереносимости (В2): булевиртид 2 мг 1 раз в сутки п/к в течение 48 нед. + ПэгИФН-α-2a (40 кДа) 180 мкг 1 раз в неделю п/к в течение 48 нед. (в данном случае применение ПэгИФН-α-2a будет вне указанных в инструкции показаний и должно сопровождаться соответствующим решением врачебной комиссии). Далее при необходимости следует продолжить лечение под контролем показателей вирусологического, биохимического и серологического ответа до достижения целей лечения гепатита D.
При наличии противопоказаний к приему ИФН или их непереносимости рекомендуется использовать монотерапию булевиртидом 2 мг 1 раз в сутки п/к в течение 48 нед. Далее при необходимости следует продолжить лечение под контролем показателей вирусологического и биохимического ответа на лечение до достижения целей лечения гепатита D (В2).
Лекарственные взаимодействия булевиртида и антиретровирусных препаратов не исследовали. ИП ВИЧ, усиленные (или неусиленные) RTV или Cobi, ИИ EVG/с, отдельные препараты из группы ННИОТ (EFV, ETR, ESV) могут изменять элиминацию булевиртида, в связи с чем их совместный прием не рекомендуется. Не предполагается каких-либо взаимодействий булевиртида и препаратов из группы НИОТ, ингибиторов присоединения и слияния, не усиленных ИИ, ННИОТ (NVP). Слабые лекарственные взаимодействия, не требующие коррекции дозировок, возможны с препаратами RPV и DOR (подробнее см. на сайте www.hiv-druginteraction.com).
3.2.7.9. Пациенты с сочетанной инфекцией ВИЧ + ХГС
В настоящее время основа лечения ХГС – препараты прямого противовирусного действия (ПППД). Комбинации ПегИФН + RBV или ПППД + ПегИФН + RBV менее эффективны и безопасны, чем сочетанная терапия ПППД, поэтому схемы, включающие ПегИФН, в настоящее время практически не используют.
На рисунке представлен алгоритм лабораторной диагностики и лечения ХГС.
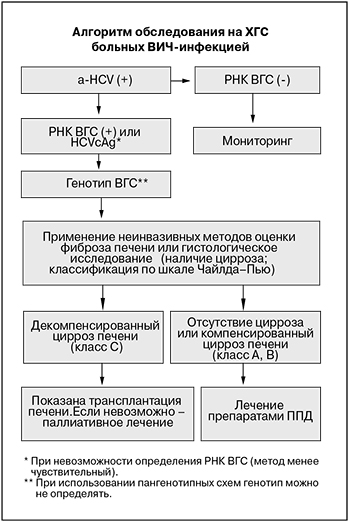
При лечении пациентов с сочетанной инфекцией ВИЧ и ВГС необходимо учитывать несколько дополнительных факторов:
- гепатотоксичность ряда антиретровирусных препаратов;
- возможные лекарственные взаимодействия антиретровирусных препаратов с препаратами, применяемыми для лечения ХГС.
При количестве CD4+-лимфоцитов > 500 клеток/мкл можно начать с лечения ХГС, а АРТ присоединить после окончания курса лечения.
При количестве CD4+-лимфоцитов < 500 клеток/мкл рекомендуется начать АРТ, к которой через несколько недель (после подавления репликации РНК ВИЧ) присоединить лечение ХГС. При высокой степени активности гепатита С для уменьшения риска развития гепатотоксичности антиретровирусных препаратов возможно начать лечение с терапии ХГС с последующим назначением АРТ.
При количестве CD4+-лимфоцитов < 100 клеток/мкл (даже при неопределяемом уровне РНК ВИЧ на фоне АРТ) начало терапии ХГС целесообразно отложить до повышения количества CD4+-клеток. При очень низком количестве CD4+-лимфоцитов существует высокая вероятность развития вторичных заболеваний; кроме того, этим пациентам необходимо проводить химиопрофилактику ряда заболеваний (туберкулеза, токсоплазмоза, пневмоцистоза, ЦМВ-инфекции и др.). Данная рекомендация основана на мнении экспертов (исследований эффективности и безопасности терапии ХГС у больных ВИЧ-инфекцией с очень низким количеством CD4+-лимфоцитов проведено не было). При наличии выраженного фиброза печени (> F3), высокой степени активности гепатита С следует рассмотреть возможность проведения терапии ХГС, но решение о начале противовирусной терапии ХГС принимается индивидуально.
По состоянию на сентябрь 2022 г. на территории Российской Федерации зарегистрированы следующие ПППД для лечения ХГС:
1. ИП протеазы NS3/4A: паритапревир, бустированный ритонавиром (PTV/r); глекапревир (GLE); гразопревир (GZR); нарлапревир, бустированный ритонавиром (NPV/r).
2. Ингибиоры полимеразы NS5B: софосбувир (SOF, нуклеотидный), дасабувир (DSV, ненуклеотидный).
3. Ингибиторы комплекса NS5A: даклатасвир (DCV), омбитасвир (OMV), который применяется только в комбинации с PTV/r; пибрентасвир (PIB); элбасвир (EBR); велпатасвир (VEL), ледипасвир (LDV).
В список ЖНВЛП включены DCV, SOF, GLE/PIB, GZR/EBR и комбинация «3D» (OBV/PTV/r + DSV). Поскольку комбинация OBV/PTV/r + DSV включает RTV, терапию ХГС больным ВИЧ-инфекцией следует проводить только на фоне АРТ.
Выбор комбинаций ПППД и длительность терапии зависит от генотипа ВГС, стадии фиброза печени, анамнеза терапии, возраста пациента, мутаций резистентности (при возможности проведения анализа). Выделяют пангенотипные схемы терапии ХГС (GLE/PIB, DCV + SOF, SOF/VEL), при применении которых генотип ВГС можно не определять, и схемы, эффективные только при ВГС генотипа 1 (OBV/PTV/r + DSV + RTV; GZR/EBR; SOF/LDV; NPV/r + SOF; NPV/r + DCV).
Рекомендации по выбору схем противовирусной терапии ХГС, вызванного ВГС генотипа 1, представлены в табл. 3.
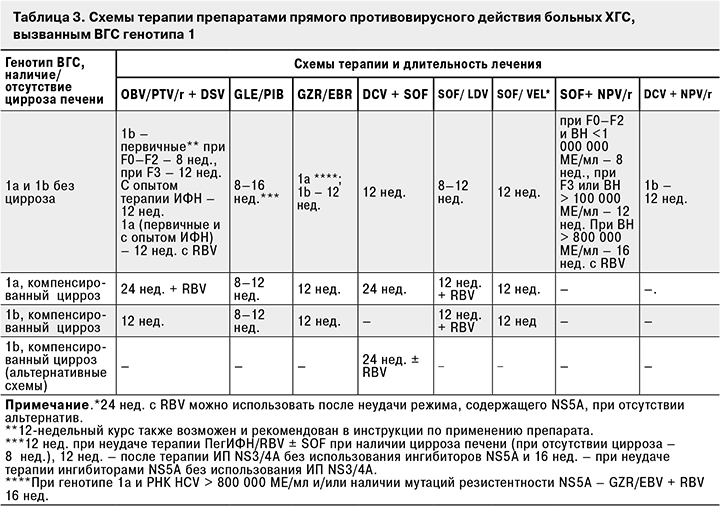
Данные комбинации препаратов рекомендуются как для пациентов с ХГС, ранее не получавших лечения ХГС, так и при предшествующей неудаче терапии ПегИФН и RBV.
В табл. 4 представлены комбинации препаратов, рекомендованных для пациентов с ХГС, вызванным ВГС генотипов 2 и 3, ранее не получавших лечения ХГС, и для лиц с предшествующей неудачей терапии ПегИФН и RBV.

При ВГС генотипа 4 показано применение всех пангенотипных схем ПППД, а также комбинаций GZR/EBR (12–16 нед. в зависимости от уровня РНК ВГС – более или менее 800 000 Ед/мл) и SOF/LED – 12 нед. (при отсутствии цирроза), 12 нед. + RBV или 24 нед. без RBV (при компенсированном циррозе).
Пациентам с декомпенсированным циррозом печени (вне зависимости от планирования трансплантации печени), включая больных с гепатоцеллюлярной карциномой, при ХГС, вызванном ВГС генотипов 1–4, рекомендуют схемы DCV + SOF + RBV (600 мг) или SOF/VEL + RBV в течение 12 нед. При хорошей переносимости RBV суточная доза препарата может быть увеличена. У больных с ВГС генотипа 1 возможно применение комбинации SOF/LDV + RBV в течение 12 нед., а при непереносимости RBV можно использовать комбинацию SOF + DCV в течение 24 нед. Режимы, содержащие ИП NS3/4A (PTV/r, GZR, GLE и др.), противопоказаны больным с декомпенсированным циррозом печени (классы В и С).
Устойчивый вирусологический ответ оценивают для ПППД через 3 мес. после окончания лечения.
После эффективного курса терапии ХГC и достижения устойчивого вирусологического ответа рекомендуется:
- при наличии фиброза печени > F3 для исключения гепатоцеллюлярной карциномы каждые 6 мес. проводить УЗИ печени и определять уровень α-фетопротеина;
- при наличии высокого риска повторного заражения ВГC (ПИН, МСМ) ежегодно определять наличие РНК ВГC или HCVcAg.
Стандартная схема АРТ для больных ВИЧ-инфекцией, сочетанной с ХГС, не получающих лечения ХГС ПППД:
- при нормальном или незначительно повышенном (не более чем в 2,5 раза выше ВГН) уровне активности АЛТ и/или АСТ может быть назначена любая схема АРТ (с учетом межлекарственных взаимодействий);
- при более высоком уровне активности АЛТ и/или АСТ – ИИ или ИП/r в сочетании с TDF (или TAF, или АВС, или Ф-АЗТ, или ZDV) + 3TC (или FTC).
Больным ХГС, по аналогии с больными ХГВ, необходимо подбирать препараты, обладающие наименьшей гепатотоксичностью.
Необходимо учитывать лекарственные взаимодействия некоторых НИОТ с RBV. Не рекомендуется сочетание RBV с ZDV (увеличивается частота развития анемии) (В4) и с ddI (повышается вероятность декомпенсации заболевания печени) (С4). Следует также учитывать, что ABC и RBV являются производными одного нуклеозида и конкурируют в процессе фосфорилирования. Это не имеет клинического значения при назначении RBV в дозе не менее 13,6 мг/кг или при стандартной терапевтической дозе 15 мг/кг, но при необходимости уменьшения дозы RBV < 13,6 мг/кг потребуется изменение схемы АРТ (так как в меньшей дозе RBV будет уже недостаточно эффективен). При недостаточной приверженности к АРТ сочетание АВС с RBV теоретически может привести к ее неэффективности. Оптимальным сочетанием НИОТ является TDF (или TAF) + 3TC в стандартных дозировках. При невозможности применять TDF назначают Ф-АЗТ или АВС (при уровне гемоглобина < 95 г/л – АВС) (В2).
Межлекарственные взаимодействия можно проверить на электронном ресурсе https://hiv-druginteractions.org/. При возможных межлекарственных взаимодействиях схему лечения ВИЧ-инфекции (без ущерба для эффективности АРТ) можно изменить на время применения ИП ВГС (12 нед. для GZR/EBR; 8–24 нед. для OВV/PTV/r; 8–16 нед. для GLE/PIB) в соответствии с табл. 5. При использовании в схеме АРТ препаратов группы ННИОТ (NVP, EFV, RPV или ESV) терапевтический режим следует изменить не менее чем за 1 нед. до начала терапии ХГС. После окончания лечения ИП ВГС можно вновь вернуться к исходной схеме АРТ.
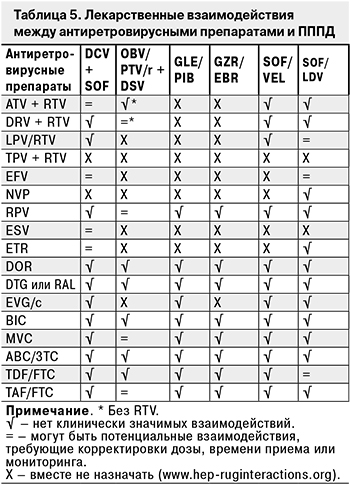
При совместном применении ESV и комбинации SOF + DCV коррекции дозы препаратов ESV и SOF не требуется, а доза DCV должна быть увеличена до 90 мг 1 раз в сутки.
Подходы к терапии острого гепатита С у больных ВИЧ-инфекцией точно такие же, как у больных моноинфекцией ВГС. После установления диагноза острого гепатита С через 4 нед. следует повторить определение РНК ВГС в плазме крови. Если уровень РНК ВГС не снизился или снизился менее чем на 2 lg10, следует начинать лечение. При снижении количества РНК ВГС более чем на 2 lg10 определение уровня РНК ВГС следует повторить через 12 нед. Наличие РНК ВГС в плазме крови при повторном исследовании (через 12 нед.) является основанием для начала терапии. Пациентам с острым гепатитом С следует назначать схемы, включающие ПППД. Длительность курса терапии острого гепатита С препаратами ПППД должна составлять не менее 8–12 нед.
3.2.7.10. Пациенты с ВИЧ-инфекцией и циррозом печени
При декомпенсированном циррозе метаболизм антиретровирусных препаратов (ИП, ННИОТ), как и большинства других препаратов, метаболизм которых осуществляется в печени, ухудшается, поэтому во избежание риска их накопления необходимо снижать дозы ИП, ННИОТ, ZDV и ABC.
Информация о фармакокинетике антиретровирусных препаратов у больных с декомпенсированным циррозом печени и рекомендации по коррекции их доз у этой категории пациентов представлены в табл. 6.

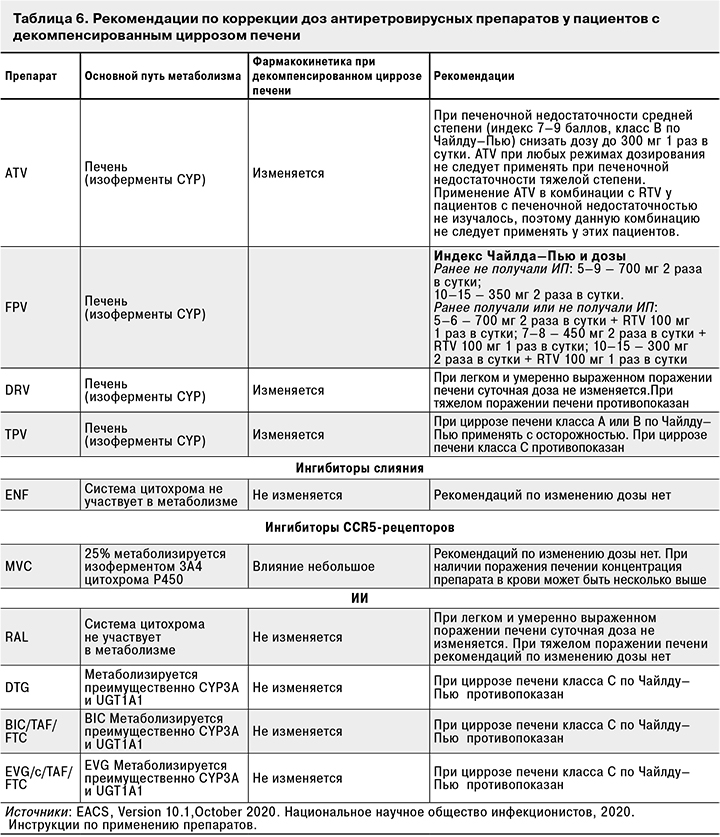
3.2.7.11. Пациенты с ВИЧ-инфекцией и заболеваниями почек
У пациентов с патологией почек можно использовать предпочтительные схемы АРТ. Для оценки функции почек рекомендуется провести УЗИ почек, определить уровни креатинина и мочевины в крови, клиренс креатинина, белка в моче, глюкозы и фосфата в крови и моче. Клиренс креатинина рассчитывают по формуле Кокрофта–Голта для мужчин:
Для женщин полученный по этой формуле результат следует умножить на 0,85.
ТDF не рекомендуется больным с почечной недостаточностью. Его не следует назначать вместе с другими нефротоксичными препаратами. Следует рассмотреть варианты применения альтернативных НИОТ или препаратов, содержащих TAF. При применении IDV, ATV и, возможно, DRV существует повышенная вероятность развития почечнокаменной болезни. Препараты из групп ИП (кроме IDV) и ННИОТ практически полностью выводятся печенью, поэтому при почечной недостаточности у пациента необходимо корректировать суточную дозу только препаратов группы НИОТ (табл. 7).
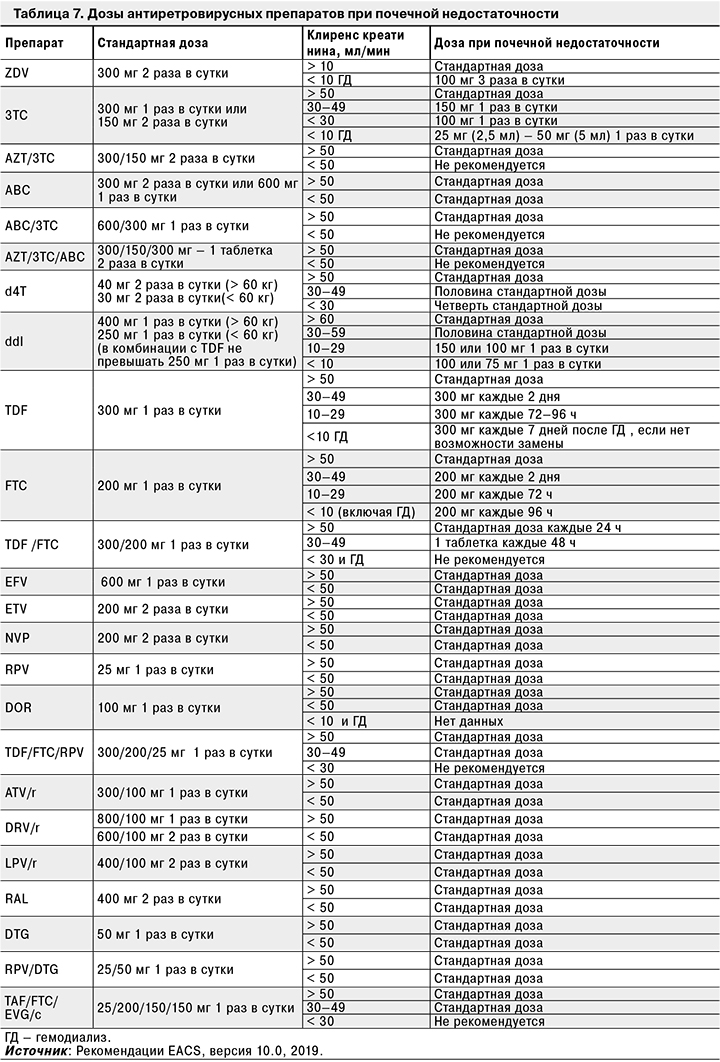
В случае обнаружения белка в моче и/или снижении скорости клубочковой фильтрации < 60 мл/мин при повторном исследовании в течение 3 мес. показана консультация терапевта (нефролога), дополнительное обследование (приложение 5) и ведение пациента совместно с терапевтом или нефрологом.
3.2.7.12. Пациенты с ВИЧ-инфекцией и туберкулезом
Больные ВИЧ-инфекцией в сочетании с туберкулезом нуждаются как в АРТ, так и в противотуберкулезной терапии (ПТТ).
АРТ пациенту с туберкулезом необходимо начинать как можно раньше, в течение первых 2 нед. лечения туберкулеза, независимо от исходного количества CD4-лимфоцитов, за исключением случаев развития туберкулезного менингоэнцефалита. При наличии нежелательных явлений, связанных с ПТТ, существенных лекарственных взаимодействий между АРТ и ПТТ, низкой приверженности пациента лечению у лиц с количеством CD4+-лимфоцитов > 50 клеток/мкл АРТ можно присоединить позже, через 2–3 мес. ПТТ.
При туберкулезном менингоэнцефалите АРТ целесообразно отложить минимум на 4 нед. (и начать в течение 8 нед. после начала лечения туберкулезного менингита). Системную ГКС-терапию целесообразно рассматривать как компанент патогенетической терапии туберкулезного менингита.
С целью профилактики ТБ-ассоциированного синдрома восстановления иммунной системы (ТБ-СВИС) у больных туберкулезом с количеством CD4+-лимфоцитов < 100 клеток/мкл, которые начали ПТТ до АРТ, одновременное начало АРТ и профилактического введения преднизолона может снизить риск ТБ-СВИС на 30%. Рекомендовано одновременно с началом АРТ назначение преднизолона в дозе 40 мг 1 раз в сутки в течение 2 нед., затем по 20 мг в сутки в течение еще 2 нед. При назначении ГКС важно быть уверенным в эффективном лечении туберкулеза согласно лекарственной чувствительности возбудителя или риска МЛУ-ТБ.
При назначении лечения таким пациентам необходимо также учитывать взаимодействие антиретровирусных и противотуберкулезных препаратов. Основной проблемой является широкий спектр взаимодействия противотуберкулезного препарата рифампицина с антиретровирусными препаратами. Поэтому при лечении пациентов с сочетанием ВИЧ и туберкулеза предпочтительнее использовать схемы ПТТ, включающие рифабутин, который можно использовать совместно со всеми ИП и всеми ННИОТ (кроме RPV и ESV), а также с ИИ ВИЧ (кроме EVG/с) и препаратами, блокирующими присоединение ВИЧ к клетке. В некоторых случаях требуется коррекция дозы рифабутина или антиретровирусных препаратов (табл. 8).

При использовании в схемах ПТТ рифампицина схема АРТ первого ряда для лечения ВИЧ-инфекции у больных туберкулезом включает:
EFV в сочетании с TDF или ABC, или Ф-АЗТ, или ZDV + 3TC, или FTC.
При развитии нежелательных явлений, связанных с приемом EFV, его доза может быть снижена до 400 мг в сутки или проведен переход на альтернативные схемы лечения. Не рекомендуется одновременный прием рифампицина и ИП, RPV, ETR, DOR, BIC, EVG/с.
Альтернативные схемы
1. DTG 50 мг (1 таблетка) 2 раза в сутки + 2 НИОТ.
2. RAL 800 мг (2 таблетки) 2 раза в сутки + 2 НИОТ.
3. ESV 20 мг 1 раз в сутки + 2 НИОТ.
4. Только при исходном уровне РНК ВИЧ < 100 000 копий/мл возможно применение схемы АРТ, включающей 3 НИОТ: ABC + ZDV + 3TC в стандартных дозировках (предпочтительно использовать комбинированный препарат ZDV/3TC/ABC – 1 таблетка 2 раза в сутки). Эта схема менее эффективна, чем схема 2 НИОТ + ННИОТ (ZDV/3TC + EFV).
5. MVC 600 мг 2 раза в сутки + 2 НИОТ.
При необходимости применения рифампицина в схеме ПТТ и отсутствии возможности использования других вариантов схемы АРТ (включающих 3 НИОТ, ННИОТ, ИИ или антагонист рецепторов CCR5) в качестве приемлемого режима пациенту может быть назначена схема АРТ, включающая 2 НИОТ + LPV/r в двойной суточной дозе (800/200 мг 2 раза в сутки) (С3).
При наличии туберкулезного менингита схему АРТ составляют с учетом индекса проникновения препаратов через гематоэнцефалический барьер (см. раздел 3.2.7.6.).
В клинических рекомендациях Минздрава России «Туберкулез у взрослых» (2020) в схемы ПТТ включен ряд новых противотуберкулезных (бедаквилин, деламанид) и антимикробных препаратов (линезолид, моксифлоксацин), которые могут иметь лекарственные взаимодействия с антиретровирусными препаратами ( http://cr.rosminzdrav.ru/#!/recomend/943).
Лекарственные взаимодействия антиретровирусных препаратов подробно представлены на электронном ресурсе http://www.hiv-druginteraction.org
Все указанные выше препараты не имеют лекарственных взаимодействий с препаратами класса НИОТ.
Бедаквилин – не имеет лекарственных взаимодействий с ИИ (BIC, DTG и RAL). Его сочетание с EVG/с не изучалось, возможно увеличение концентрации бедаквилина и усиление нежелательных явлений (совместный прием противопоказан). Одновременный прием бедаквилина и ННИОТ: с NVP и DOR лекарственных взаимодействий нет, с RPV – слабое взаимодействие; прием вместе с EFV или ETR противопоказан. При сочетании с LPV/r AUC бедаквилина увеличивалась на 22%, что приводило к усилению нежелательных явлений. Одновременный прием бедаквилина и ИП не рекомендуется, поскольку приводит к усилению нежелательных явлений и удлинению интервала QT на ЭКГ.
Деламанид – не имеет лекарственных взаимодействий с ИИ (BIC, DTG и RAL). Его сочетание с EVG/с не изучалось, возможно увеличение концентрации препарата и усиление нежелательных явлений (совместный прием противопоказан). При сочетании с LPV/r концентрация деламанида увеличивалась на 25–30%, что приводило к усилению нежелательных явлений. Одновременный прием деламанида и ИП не рекомендуется, поскольку приводит к усилению нежелательных явлений. Отсутствуют лекарственные взаимодействия деламанида и ряда ННИОТ (DOR, ETR, NVP). Предполагается слабое лекарственное взаимодействие с RPV. При сочетании с EFV возможно усиление нежелательных явлений.
Линезолид – лекарственные взаимодействия с антиретровирусными препаратами не отмечены.
Моксифлаксацин – отсутствуют лекарственные взаимодействия с ИИ. Не рекомендуется одновременный прием препарата и ИП, поскольку метаболизм моксифлоксацина осуществляется ферментом UGT1A1, а ИП активируют этот фермент, что приводит к снижению концентрации моксифлоксацина. Сочетание ИП и моксифлоксацина приводит к удлинению интервала QT на ЭКГ. Взаимодействия с препаратами класса ННИОТ не изучались. EFV и ETR являются активаторами фермента UGT1A1, в результате чего возможно снижение концентрации моксифлоксацина. При сочетании с RPV возможно удлинение интервала QT на ЭКГ. С DOR и NVP лекарственных взаимодействий не ожидается.
3.2.7.13. Пациенты с нарушением функции глотания
В случаях, когда у взрослых, в том числе у беременных, применение таблетированных форм антиретровирусных препаратов затруднено и/или невозможно из-за:
- дисфагии функциональной, связанной с расстройством нервной системы;
- дисфагии органической, вызванной заболеваниями и поражениями ротоглотки или пищевода, в том числе кандидоза, язвы пищевода;
- нахождения пациента в отделении реанимации и палате интенсивной терапии;
- наличия у пациента гастростомы, в качестве терапии следует использовать растворы и/или суспензии per os, либо вводить препараты через назогастральный зонд.
Антиретровирусные препараты, доступные к применению в форме раствора или суспензии – ABC, ZDV, 3TC, NVP. LPV/r – могут применяться в дозе 400/100 мг (5 мл раствора) 2 раза в день или 800/200 мг (10 мл раствора) 1 раз в день у пациентов с менее чем тремя мутациями, связанными с развитием резистентности к LPV. Таблетки Ф-АЗТ могут быть в раcтолченом виде смешаны с водой и применяться в виде суспензии.
Таблетки ETR могут быть помещены в воду (именно воду, не менее 5 мл, вода должна полностью покрывать таблетку) и размешены до образования однородной суспензии. При необходимости суспензия может быть разбавлена большим количеством воды, молока или апельсинового сока. Для принятия полной дозы препарата рекомендуется стакан несколько раз сполоснуть водой, соком или молоком и полностью выпить содержимое.
3.2.8. Приемлемые (допустимые) схемы АРТ и режимы приема антиретровирусных препаратов
Приемлемыми считаются схемы АРТ или режимы приема отдельных антиретровирусных препаратов, которые по параметрам эффективности, переносимости, безопасности или изученности уступают альтернативным и, там более, приоритетным.
Приемлемые схемы могут применяться только при невозможности (например, из-за непереносимости) назначения предпочтительных и альтернативных схем.
К таким схемам относятся:
1. ddI 400 мг в сутки (250 мг в сутки при массе тела < 60 кг) + ЗТС + EFV или ИП/r, или ИИ в стандартных дозировках (С2). Причина – выраженная цитотоксичность ddI при длительном приеме.
2. d4T 30 мг 2 раза в сутки (вне зависимости от массы тела) + ЗТС + EFV или ИП/r, или ИИ в стандартных дозировках (С1). Причина – выраженная цитотоксичность d4Т при длительном приеме.
3. TDF (в стандартной дозировке) + ddI (250 мг в сутки вне зависимости от массы тела) + EFV или ИП/r, или ИИ в стандартных дозировках (С3). Причина – при сочетании TDF и ddI возможен недостаточный иммунологический ответ при наличии полного подавления репликации ВИЧ.
4. У больных туберкулезом с исходно низким (< 100 клеток/мкл) количеством CD4+-лимфоцитов в качестве четвертого препарата к схеме АРТ (2 НИОТ + ННИОТ или ИП) может быть добавлен ENF (90 мкг 2 раза в день подкожно в течение 6 мес.) (С3).
5. ННИОТ + ИП – EFV + LPV/r; ETR + DRV/r (В2).
6. ИП/r +ИИ – LPV/r + RAL или DRV/r + RAL (В2).
7. Битерапия ИП/r + НИОТ: LPV/r (2 раза в сутки) + 3TC, ATV/r + 3TC (В2). Проведение терапии по такой схеме возможно только для продолжения АРТ при высокой эффективности схемы первой линии (полное подавление репликации РНК ВИЧ в течение не менее 6 мес. и повышение количества СD4+-лимфоцитов > 200 клеток/мкл), отрицательном результате обследования на HBsAg и беременность при невозможности продолжать лечение по схеме ВААРТ или с целью упрощения схемы лечения. Схемы ИП/r + 3ТС более предпочтительны, чем схемы ИП/r. Некоторые схемы битерапии, такие как DRV/r (2 раза в сутки) + 3TC, DTG + 3TC, DTG + RPV могут применяться уже не как преемлемые, а как альтернативные.
8. Применение сниженной дозы EFV (400 мг в сутки) возможно у пациентов с плохой переносимостью стандартной дозы препарата при условии хорошей приверженности лечению и снижении ВН ниже уровня определения.
3.2.9. Изменение схемы АРТ
3.2.9.1. Изменение схемы АРТ при развитии непереносимости антиретровирусных препаратов
Для оценки безопасности проводимой терапии с целью ее своевременной коррекции в ходе лечения проводится плановое обследование согласно схеме, приведенной в разделе «Особенности диспансерного наблюдения при проведении АРТ». В случае возникновения нежелательных явлений (любые отклонения от нормы в состоянии больного, в том числе лабораторные, независимо от связи с проводимой терапией) проводятся внеплановые обследования с целью уточнения их связи с течением ВИЧ-инфекции и проводимой терапией.
При развитии непереносимости какого-либо из антиретровирусных препаратов схему АРТ изменяют в соответствии со спектром побочных явлений. При развитии непереносимости одного из компонентов АРТ сначала целесообразно попытаться провести корригирующие мероприятия, не изменяя дозы и схемы приема препаратов.
Целесообразно заменить не все препараты, а только то лекарственное средство, прием которого вызвал побочный эффект, с учетом механизма действия и спектра наиболее часто встречающихся токсических проявлений.
Если необходимость в отмене препарата, вызвавшего нежелательное явление, все же возникает, то для минимизации риска развития резистентности может быть рекомендована следующая тактика:
- при применении схем, содержащих 2 НИОТ + ИП или ИИ, возможно временное прерывание приема всех препаратов;
- при применении схем, содержащих 2 НИОТ + ННИОТ (если предполагается, что нежелательное явление связано именно с ННИОТ), целесообразно временно отменить только его, продолжив прием нуклеозидной основы не менее 1 нед.;
- если предполагается, что непереносимость связана с НИОТ, возможна временная отмена одного из препаратов нуклеозидной основы, только если в схеме АРТ присутствует ИП или DTG.
Если возникает непереносимость препарата группы НИОТ, в ряде случаев целесообразно не заменять его, а перейти на схему терапии с 1 НИОТ или без НИОТ.
Необходимо учитывать и возможное взаимодействие с другими (не только антиретровирусными) препаратами, входящими в схему лечения. При этом нельзя забывать и о препаратах, которые больной в настоящее время не получает, но которые, возможно, будут ему вскоре назначены. В табл. 9 представлены варианты замены антиретровирусных препаратов при развитии нежелательных явлений.
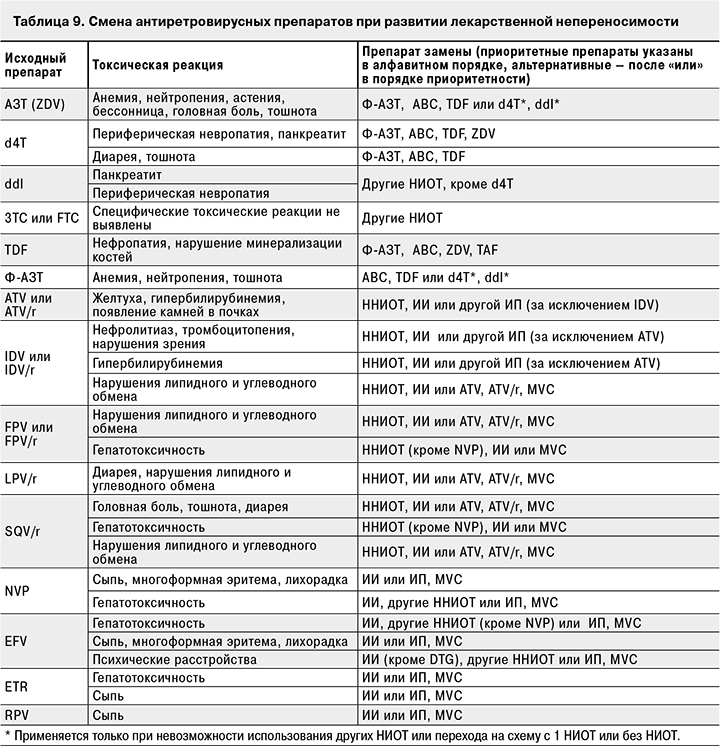
Обследования, необходимые для предупреждения развития нежелательных явлений и их своевременного обнаружения, представлены в приложении 5.
3.2.9.2. Смена АРТ при недостаточной эффективности или потере эффективности ранее проводимого лечения
При вирусологической неэффективности АРТ или ее потере (подробно описано в разделе 3.2.5.4. «Критерии неэффективности АРТ») рекомендуется проведение теста на определение резистентности ВИЧ к антиретровирусным препаратам.
Это исследование рекомендуется, если нет других явных причин для кратковременного повышения уровня ВН, таких как перерыв в приеме АРТ, недавно перенесенные инфекционные заболевания, недавняя вакцинация. Кратковременное повышение уровня до < 500 копий/мл с возвращением к неопределяемому уровню в следующем исследовании не говорит о развитии резистентности вируса.
Если в результате исследования резистентности ВИЧ установлено, что устойчивость вируса развилась к конкретному препарату, рекомендуется замена именно этого лекарственного средства (А1).
Если проведение исследования на резистентность невозможно, рекомендуется смена всех трех препаратов.
При наличии в гене обратной транскриптазы ВИЧ мутации резистентности М184V (мутация устойчивости к ЗТС и FTC) снижаются способность вируса к размножению и риск развития резистентности к ZDV и TDF. При выявлении мутации М184V рекомендуется оставлять 3ТС в схеме лечения (В2). При развитии этой мутации, но сохранении чувствительности к ZDV и/или TDF целесообразно включить в схему АРТ еще один препарат из группы НИОТ без отмены ЗТС.
Если в составе схемы АРТ первого ряда пациент получал 2 НИОТ (ABC + 3TC или TDF + FTC или 3TC), то при вирусологической неэффективности лечения наиболее часто отмечают развитие мутации резистентности M184V (устойчивость вируса к FTC и 3TC). В таком случае сохраняется чувствительность вируса к ABC, ddI, d4T, а к ZDV, Ф-АЗТ и TDF (TAF) даже повышается. В качестве 2 НИОТ второго ряда можно использовать сочетания ABC + ZDV или Ф-АЗТ, TDF + ZDV или Ф-АЗТ.
В качестве альтернативных 2 НИОТ второго ряда можно использовать сочетания ABC + ZDV или Ф-АЗТ, TDF + ZDV или Ф-АЗТ, ABC или TDF + ddI, ZDV или Ф-АЗТ + ddI. При сочетании TDF и ddI (суточная доза ddI – 0,25 г вне зависимости от массы тела) возможен недостаточный иммунологический ответ при полном подавлении репликации ВИЧ. При использовании в составе схемы АРТ второго ряда препаратов TDF, ZDV или Ф-АЗТ желательно не отменять 3ТС, поскольку при сохранении мутации M184V чувствительность вируса к этим препаратам возрастает.
Если пациент в составе стартового режима АРТ получал АВС + 3ТС, и при неэффективности лечения возникли мутации резистентности M184V + L74V (устойчивость вируса к АВС, ddI, 3TC, FTC), то в схемах второго ряда терапии можно применять комбинации TDF + ZDV, TDF + Ф-АЗТ.
При использовании в составе схем второго ряда сочетания TDF + FTC или 3TC и развитии неэффективности терапии вследствие возникновения мутаций K65R + M184V (резистентность вируса к TDF, d4T, ddI, 3TC, FTC), чувствительность вируса сохраняется только к ZDV и Ф-АЗТ. В таком случае схема АРТ второго ряда может включать 2 НИОТ (ZDV или Ф-АЗТ + 3ТС) + 1 ИП/r ± 1 ННИОТ, или ИИ с высоким барьером резистентности + ZDV или Ф-АЗТ.
При использовании в составе схем второго ряда сочетания TDF + FTC или 3TC и развитии неэффективности терапии вследствие возникновения мутаций K65R + M184V (резистентность вируса к TDF, d4T, ddI, 3TC, FTC), чувствительность вируса сохраняется только к ZDV и Ф-АЗТ. В таком случае схема АРТ второго ряда может включать 2 НИОТ (ZDV или Ф-АЗТ + 3ТС) + 1 ИП/r ± 1 ННИОТ.
Если пациент в составе стартового режима АРТ получал ZDV или Ф-АЗТ + 3ТС, и при неэффективности лечения возникли мутации резистентности M184V + ТАМ (мутации резистентности к тимидиновым аналогам), то выбор НИОТ второго ряда зависит от сочетания ТАМ-мутаций. При возникновении мутаций ТАМ-2 (D67N/G, K70K/R, K219H/Q) чувствительность вируса сохранена к TDF, ABC, которые можно сочетать с ddI, к которому чувствительность тоже сохраняется. При развитии мутаций ТАМ-1 (M41M/L, L210L/W, T215T/N/S/Y) имеет место резистентность вируса ко всем препаратам класса НИОТ, поэтому схема АРТ второго ряда может содержать 1 ННИОТ + 1 ИП/r или 1 ИИ.
Если проведение исследования на резистентность ВИЧ к антиретровирусным препаратам невозможно, подбор схемы АРТ проводят эмпирически, пользуясь следующими принципами.
Новая схема АРТ может включать 2 полностью активных препарата, если хотя бы один из них обладает высоким барьером резистентности, например, ИИ второго поколения DTG или усиленной ИП DRV/r. ИИ BIC, который в России доступен только в комбинированной таблетке BIC/TAF/ FTC, также обладает высоким барьером резистентности. Если один из этих препаратов полностью активен, их можно комбинировать с 2 НИОТ, если хотя бы один из них также полностью активен. В качестве альтернативы, если и ИИ второго поколения и усиленный ИП полностью активны, их можно использовать в комбинации без НИОТ, они будут высокоэффективны и у пациентов с вирусологической неудачей. Если отсутствует возможность включить в схему АРТ полностью активного препарата с высоким барьером резистентности, следует включить в схему лечения 3 полностью активных препарата.
Препараты группы ИП используются в схемах второго и последующих рядов только в бустированном виде. Все они, кроме ATV/r, применяются не менее 2 раз в сутки. Существуют данные, что DRV/r в режиме 800/100 мг также может применяться однократно у пациентов, ранее получавших терапию и не имеющих мутаций, вызывающих резистентность к DRV.
Не следует добавлять один эффективный антиретровирусный препарат к схеме с вирусологической неудачей, поскольку это редко приводит к полному подавлению репликации ВИЧ, вследствие чего вероятно развитие резистентности ко всем препаратам текущей схемы лечения.
При замене третьего препарата используют препарат другого класса, то есть если в первоначальной схеме использовался ННИОТ, его меняют на ИП или ИИ или наоборот (А1).
Рекомендации по выбору третьего препарата в схеме АРТ второго ряда представлены в табл. 10.
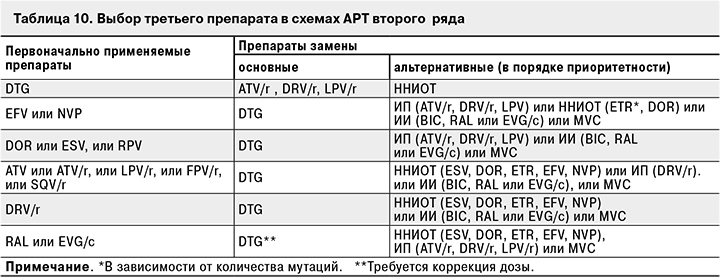
Тактика ведения пациентов в зависимости от уровня виремии
При уровнях РНК ВИЧ > 20–50 и < 200 копий/мл схемы АРТ обычно не требуют изменения, поскольку риск возникновения резистентности низкий. При этом необходимо контролировать уровень РНК ВИЧ не реже 1 раза в 3 мес., чтобы при необходимости своевременно изменить схему АРТ.
При уровнях РНК ВИЧ ≥ 200 и < 1000 копий/ мл лекарственная устойчивость развивается часто, особенно при уровне РНК ВИЧ > 500 копий/мл. Следует попытаться провести тестирование на резистентность, особенно у пациентов с уровнем РНК ВИЧ > 500 копий/мл. Подходы к ведению должны быть такими же, как и для пациентов с РНК ВИЧ > 1000 копий/мл (как описано ниже). Если тестирование на резистентность невозможно провести из-за низкого уровня РНК ВИЧ, решение о замене антиретровирусных препаратов следует принимать эмпирически или рассмотреть возможность проведения генотипического тестирования провирусной ДНК. Необходимо учитывать, что эти анализы могут пропустить некоторые или все ранее существовавшие мутации лекарственной устойчивости, поэтому результаты теста следует интерпретировать с осторожностью.
При уровне РНК ВИЧ ≥ 1000 копий/мл и отсутствии мутаций лекарственной устойчивости, идентифицированных с использованием текущих или предыдущих результатов теста на генотипическую устойчивость, ситуация, как правило, обусловлена субоптимальным уровнем приверженности терапии. Необходимо оценить уровень приверженности, выявить и устранить основную причину (причины) неполной приверженности и, если возможно, упростить режим (например, уменьшить количество таблеток, упростить требования к пище или частоту приема препаратов), выявить нежелательные явления и возможные лекарственные взаимодействия.
Если текущая схема хорошо переносится, нет значительных лекарственных взаимодействий или лекарственных взаимодействий с пищей, целесообразно продолжить лечение по прежней схеме. При плохой переносимости или при наличии существенных лекарственных взаимодействия или взаимодействий с пищей следует изменить схему лечения на не менее эффективную, но с лучшей переносимостью.
Через 2–4 нед. после возобновления АРТ по прежней схеме или начала лечения с использованием нового режима АРТ, следует повторить тестирование на уровень РНК ВИЧ. Если он сохраняется > 500 копий/мл, следует провести генотипическое тестирование для выявления штамма вируса, резистентного к лекарственным препаратам.
При уровне РНК ВИЧ > 1000 копий/мл и наличии лекарственной устойчивости режим АРТ следует изменить как можно скорее, чтобы избежать прогрессирующего накопления мутаций резистентности. Вирусологический ответ на новые и полностью активные схемы выше у лиц с более низкими уровнями РНК ВИЧ и/или более высоким количеством CD4+-лимфоцитов. Основная цель изменения режима терапии – снижение уровня РНК ВИЧ < 20–50 копий/мл. У пациентов с вирусологической неудачей крайне важно обеспечить постоянную поддержку приверженности до и после изменения режима АРТ.
При смене схемы АРТ у пациента с сочетанной инфекцией ВГВ/ВИЧ при выборе нового режима терапии следует продолжать прием антиретровирусных препаратов, активных в отношении ВГВ. Прекращение их приема может привести к реактивации ВГВ и серьезному поражению печени.
Для отдельных пациентов, длительно получавших различные схемы АРТ и имеющих широкую лекарственную устойчивость, полное подавление репликации ВИЧ может быть недостижимо. В таких случаях целесообразно продолжить АРТ с выбором режима с минимальной токсичностью для сохранения количества CD4+-лимфоцитов и замедления клинического прогрессирования ВИЧ-инфекции. Также следует рассмотреть вопрос о включении пациента в клиническое испытание исследуемых препаратов с иным механизмом действия или спектром мутаций резистентности.
Прекращение или краткосрочное прерывание АРТ может привести к быстрому повышению уровня РНК ВИЧ, снижению количества CD4+-лимфоцитов и повышению риска клинического прогрессирования ВИЧ-инфекции, поэтому при вирусологической неудаче подобная стратегия неприемлема.
Появление симптомов нарушений со стороны ЦНС на фоне вирусологически эффективной АРТ (неопределяемый уровень РНК ВИЧ в плазме) может свидетельствовать о поражении ЦНС непосредственно ВИЧ. У пациентов, как правило, выявляют подострую неврологическую симптоматику, нейрокогнитивные нарушения, изменения на МРТ и аномальные результаты анализа спинномозговой жидкости с характерным лимфоцитарным плеоцитозом. Определение содержания РНК ВИЧ в спинномозговой жидкости показывает более высокие (или определяемые) концентрации в ликворе, чем в плазме. В большинстве случаев обнаруживают наличие мутаций резистентности вируса в спинномозговой жидкости. Тестирование лекарственной устойчивости ВИЧ в спинномозговой жидкости может быть использовано для изменения схемы лечения в соответствии с принципами, изложенными выше, с учетом степени проникновения антиретровирусных препаратов через гематоэнцефалический барьер.
При появлении симптоматики со стороны ЦНС (особенно при количестве CD4+-лимфоцитов < 200 клеток/мкл) необходимо исключить вторичные заболевания, при которых также может кратковременно возрастать содержание РНК ВИЧ в ликворе. Возможно случайное обнаружение бессимптомного временного повышения уровня РНК ВИЧ в спинномозговой жидкости, похожее на вирусологическую вспышку. При таких ситуациях изменения схемы АРТ обычно не требуется.
Наибольшие сложности возникают при составлении схем АРТ третьего и последующих рядов, когда выбор эффективных препаратов существенно ограничен. В таких случаях, помимо оптимизации терапии, осуществляемой на основании результатов исследования резистентности, в схему АРТ целесообразно включать антиретровирусные препараты новых классов (ингибиторы слияния, ингибиторы рецепторов CCR5 и ИИ) или препараты известных классов, имеющих другой спектр резистентности, или их сочетание – то есть использовать схемы резерва (В1).
Задачей терапии больных, имеющих множественную резистентность ВИЧ к антиретровирусным препаратам, является снижение уровня РНК ВИЧ до неопределяемых значений с последующим увеличением количества CD4+-лимфоцитов. При адекватно подобранной схеме АРТ даже у больных с множественной резистентностью ВИЧ к лекарственным препаратам уровень РНК ВИЧ должен быть < 400 копий/мл через 12–16 нед. и < 50 копий/мл через 24 нед. после изменения схемы терапии.
Оптимальный режим терапии выбирается с учетом индивидуальных особенностей, предшествующего опыта применения АРТ и теста на резистентность. У больных с множественной резистентностью ВИЧ к антиретровирусным препаратам оптимальным выбором терапии является включение в схему АРТ препаратов нового класса (ENF, MVC, ИИ) в сочетании с препаратами ранее применявшихся классов, обладающими другим спектром резистентности (DRV, TDF, ETR) (В1). Так, после неудачи АРТ, включавшей такие ИП, как ATV, ATV/r, FPV, FPV/r, IDV, IDV/r, LPV/r, SQV/r, применение DRV/r или TPV/r, с высокой долей вероятности, будет эффективным. Эффективность схемы АРТ, включающей ETR (после развития устойчивости ВИЧ к EFV или NVP), зависит от количества и спектра мутаций резистентности вируса. При возникновении более 2 мутаций резистентности ВИЧ эффективность терапии ETR снижается. Назначение ИИ DTG после неудачи схемы АРТ, содержавшей RAL, вследствие развития мутации Q148 в сочетании с 2 или более мутациями резистентности в значительной степени снижало эффективность новой схемы АРТ. После неудачи терапии RAL необходимо увеличивать дозу DTG (50 мг 2 раза в сутки) при его включении в схему АРТ.
3.2.9.3. Изменение схемы АРТ с целью ее оптимизации
Под оптимизацией понимается изменение эффективной и хорошо переносимой АРТ, чтобы сделать ее более подходящей для конкретного пациента. Одним из вариантов оптимизации является упрощение проводимой терапии.
Показаниями к оптимизации АРТ являются:
- большая лекарственная нагрузка (большое количество лекарственных форм, большая частота приема);
- прием устаревших препаратов;
- прием препаратов с высокой долговременной токсичностью;
- изменения (в том числе вероятные) состояния пациента, требующие коррекции терапии (беременность, пожилой возраст);
- появление заболеваний, на течение или лечение которых может неблагоприятно влиять проводимая АРТ;
- возможность назначения более экономичного режима АРТ;
- желание пациента получать более простой режим АРТ.
Для оптимизации АРТ может производиться замена как препаратов внутри одной группы, так и на препараты другой группы.
Внутригрупповая замена позволяет обойтись без применения препаратов из ранее не использовавшихся фармакологических групп, что сохраняет возможность их применения в будущем. Замена может производиться на более современные, более экономичные, менее токсичные препараты, лекарственные формы с меньшим числом принимаемых таблеток в сутки, меньшей кратностью приема, комбинированные препараты.
Внутри группы НИОТ возможна замена препаратов, переведенных из разряда приоритетных или альтернативных в приемлемые (d4T, ddI), на менее токсичные или замена ZDV у пациентов, получающих его более 2 лет, на ABC или TDF с целью снижения риска развития проявлений митохондриальной токсичности.
Внутри группы ННИОТ возможна замена NVP на EFV с целью перехода на прием препаратов 1 раз в сутки; замена EFV на NVP при планировании беременности или переходе пациента на режим работы, требующий активности в ночное время. Вариантом оптимизации терапии является замена EFV на DOR или ESV, или RPV как с целью предотвращения развития нежелательных явлений, связанных с приемом EFV, так и с возможностью перехода на комбинированный препарат с суточной дозой в одной таблетке (RPV/TDF/FTC, DOR/TDF/FTC).
Внутри группы ИП возможна замена одного ИП другим, а также снижение кратности приема ИП, входящего в текущую схему терапии (например, переход с режима приема 2 раза в сутки на 1 раз в сутки, что возможно для LPV/r, DRV/r и FPV/r), или переход на небустированную форму (ATV/r на ATV).
Примерами оптимизации АРТ с переходом на препараты другой группы может быть упрощение терапии путем перехода с ИП/r на ННИОТ. Это можно делать и с целью удешевления терапии. Вариантом оптимизации может явиться и замена ИП/r, назначенного женщине на ранних сроках беременности, на лучше переносимые препараты, в том числе DTG, после родоразрешения.
Возможным вариантом оптимизации АРТ является ее упрощение путем уменьшения количества активных препаратов в схеме терапии. Это могут быть схемы с 1 НИОТ или без НИОТ. При формировании схемы с 1 НИОТ обычно используются 3ТС или FTC (как наименее токсичные и хорошо переносимые препараты этой группы) и препарат с высоким барьером резистентности из группы ИИ или ИП.
Основным показанием для применения таких режимов является непереносимость или потенциальная непереносимость препаратов группы НИОТ. Условием назначения редуцированных схем пациентам, уже получающим АРТ, является неопределяемый уровень ВН в течение не менее 6 мес. в сочетании с количеством CD4+-лимфоцитов > 200 клеток/мкл и отсутствие клинических проявлений вторичных заболеваний в течение последних 6 мес., беременности, отрицательного результата обследования на HBsAg.
Возможно применение следующих схем битерапии:
- DRV/r + 3TC;
- DTG + 3TC;
- LPV/r + RAL;
- DRV/r + RAL;
- DTG + RPV.
Перед переходом на редуцированную схему АРТ необходимо проведение дополнительного консультирования пациента о необходимости соблюдения режима лечения. Через 1 и 3 мес. после перехода на редуцированную схему рекомендуется проведение исследования ВН. При сохранении ее на неопределяемом уровне в дальнейшем наблюдение можно проводить по обычному графику. При повышении ВН рассматривается вопрос о возвращении к полноценной схеме АРТ.
3.2.9.4. Прерывание АРТ
АРТ больным ВИЧ-инфекцией назначается пожизненно, и ее прерывание не рекомендуется, за исключением пациентов, получающих превентивную терапию (химиопрофилактику) после эпидемически значимого контакта с больным ВИЧ-инфекцией. Особенно неблагоприятны последствия прерывания терапии у беременных, детей до 5 лет, пациентов, находящихся в фазе прогрессирования стадий 4Б, 4В или с количеством СD4+-лимфоцитов ≤ 200 клеток/мкл, а также пациентов, у которых эффект АРТ (вирусологический, иммунологический и клинический) так и не был достигнут.
Тем не менее, на практике прерывание АРТ у больных ВИЧ-инфекцией иногда происходит, например, по решению пациента, при невозможности явиться для получении препаратов и т. д. Очень редко необходимость отмены антиретровирусных препаратов может быть связана с побочными проявлениями, особенно если они носят угрожающий жизни характер. Однако и в этом случае АРТ следует как можно быстрее возобновить, подобрав подходящую для данного пациента схему.
Временное прерывание всей схемы АРТ является для пациента более предпочтительным, чем ее продолжение в виде моно- или битерапии или нерегулярный прием препаратов. Исключение составляют схемы битерапии, описанные в разделе «Изменение схемы АРТ с целью ее оптимизации».
При прерывании терапии необходимо учитывать, что препараты из группы ННИОТ имеют период полувыведения, гораздо более длительный, чем применяемые вместе с ними препараты группы НИОТ, и низкий барьер резистентности. В результате после отмены АРТ ННИОТ в течение недели циркулируют в крови в режиме «монотерапии», что создает идеальные условия для селекции резистентных штаммов ВИЧ. При прерывании схем терапии, включающих ИП или ИИ, которые имеют период полувыведения, сопоставимый с НИОТ, такого не происходит. Поэтому тактика прерывания терапии у пациентов, получавших АРТ на базе ННИОТ, отличается от таковой при применении ИИ или ИП.
При отмене терапии, проводимой на основе ННИОТ, возможно несколько вариантов действия:
1. За месяц до отмены терапии заменить препарат из группы ННИОТ на ИП ВИЧ (в крайнем случае, можно использовать схему на основе ИП в течение 7–14 дней). Затем вся схема АРТ отменяется.
2. Если применение такой тактики невозможно, то после отмены ННИОТ следует продолжить прием 2 препаратов из группы НИОТ в течение 7–14 дней, после чего прервать терапию.
При прерывании АРТ, проводимой на основе ИП, следует одновременно отменить все антиретровирусные препараты.
С пациентами, прерывающими терапию, должно быть проведено консультирование, в ходе которого следует обсудить отрицательные (угроза прогрессирования ВИЧ-инфекции, повыщение риска передачи инфекции) и кажущиеся благоприятными («отдых» от лекарств) последствия этого шага. Должна быть разъяснена необходимость продолжения диспансерного наблюдения и его доступность для пациента, а также необходимость возобновления терапии.
За пациентами, прервавшими АРТ, необходимо продолжать диспансерное наблюдение в том же объеме, что и за получающими ее. При консультировании в процессе диспансерного наблюдения необходимо акцентировать внимание на необходимости возобновления АРТ, особенно в случаях снижения количества CD4+-лимфоцитов < 350 клеток/мкл или клинического прогрессирования болезни.
3.2.10. Отражение наблюдения за пациентом в амбулаторной карте (истории болезни)
Всеобщая доступность АРТ перевела ВИЧ-инфекцию из разряда заболеваний с неизбежным смертельным исходом в разряд заболеваний с контролируемым течением, при этом диспансерное наблюдение и лечение больных ВИЧ-инфекцией должно быть пожизненным. Вместе с тем нарушение режима наблюдения за пациентом и режима лечения, а также неверная интерпретация результатов лабораторных исследований и неадекватный выбор терапии могут иметь самые неблагоприятные последствия не только для здоровья пациента, но и для увеличения его значимости как источника инфекции.
Поэтому основные клинические и лабораторные маркеры прогрессирования ВИЧ-инфекции и эффективности АРТ должны быть четко отражены в амбулаторной карте.
Рекомендуется:
- в записях, производимых при первичном обследовании пациента и при плановых и внеочередных обследованиях, отражать уровень ВН и количество CD4+-лимфоцитов;
- у пациентов, получающих АРТ, отражать отклонения в результатах других лабораторных исследований, приуроченных к данному визиту, и давать их интерпретацию с точки зрения эффективности и безопасности АРТ;
- при назначении не приоритетной схемы АРТ формулировать обоснование выбора конкретной схемы.
Для облегчения и ускорения оценки динамики заболевания, эффективности и безопасности проводимой терапии и настоящего состояния пациента рекомендуется использовать лист-вкладыш «Развитие заболевания» (приложение 1).



