До начала глобального распространения ВИЧ-инфекции считалось, что на каждый случай туберкулеза (ТБ) с положительным результатом микроскопии мазка мокроты (ММ) приходится 1,22 случая ТБ с отрицательным результатом (или внелегочного ТБ). Больные с отрицательным результатом ММ считались менее заразными, показатели смертности среди них были ниже. Но с 90-х годов XX века в странах с высоким бременем коинфекции (сочетания ВИЧ-инфекции и ТБ – ВИЧ/ТБ) было отмечено изменение этого соотношения: увеличилось количество больных ТБ без бактериовыделеия и выросла доля смертельных исходов среди этой категории больных [1, 2].
Обнаружение возбудителя в мокроте является одним из важнейших критериев диагностики ТБ органов дыхания, однако известно, что отсутствие бактериовыделения не позволяет отвергнуть диагноз ТБ, что может затруднять его диагностику и дифференциальную диагностику с другими заболеваниями легких при ВИЧ-инфекции.
Несмотря на длительность изучения проблемы коинфекции сведения о частоте обнаружения микобактерий ТБ (МБТ) в мокроте у больных ВИЧ-инфекцией носят довольно противоречивый характер: частота выявления возбудителя, по данным разных авторов, составляет от 24 до 65% [3–5]. До настоящего времени существует устойчивое мнение о низкой частоте выявления возбудителя ТБ в мокроте пациентов с коинфекцией, это влечет за собой определенные сложности диагностики [6–8], тогда как известно, что быстрая и достоверная диагностика ТБ у пациентов с ВИЧ-инфекцией особенно важна, потому что длительные сроки установления диагноза значительно ухудшают прогноз заболевания [9].
Цель исследования – анализ частоты бактериовыделения среди впервые выявленных больных ВИЧ /ТБ в Новокузнецке. Население города составляет 552 000 человек, около 2% инфицированы ВИЧ, а доля случаев ВИЧ/ТБ в структуре впервые выявленного ТБ к концу 2017 г. достигла 48%.
Материалы и методы
Исследование мокроты было проведено у всех впервые выявленных больных с коинфекцией, зарегистрированных в Новокузнецке в 2013–2014 гг. (n = 372). Лаборатория Новокузнецкого клинического противотуберкулезного диспансера регулярно участвует в системе внешней оценки качества исследований, результаты референтного контроля проведения бактериологических исследований соответствуют нормативам. Для изучения результатов ММ, посевов мокроты на МБТ и тестов лекарственной чувствительности к противотуберкулезным препаратам (ПТП) I и II ряда использовали информацию централизованной электронной базы данных АСУ «Баклаборатория».
Вид исследования – одноцентровое, ретроспективное, обсервационное. Статистическую обработку полученных результатов проводили с использованием программ Microsoft® Excel®, версия 14.4.6 (141106) и Statistica 6.0.
 Результаты
Результаты
Среди больных с коинфекцией было 234 (77,0%) мужчины и 138 (23,0%) женщин. Средний возраст пациентов составил 34,8 ± 8,1 года. Сведения о количестве CD4-лимфоцитов имелись у 294 (79,0%) больных; оно колебалось в диапазоне от 1 до 2064 клеток/ мкл, медиана составила 185 клеток/мкл. При этом у 152 (51,7%) больных уровень CD4-лимфицитов был < 200 клеток/мкл.
Исследуемую группу составили 362 больных ТБ органов дыхания (97,3% от общего числа впервые выявленных больных с коинфекицей); пациенты с изолированным внелегочным ТБ (n = 10; 2,7%) не были включены в исследование.
Изолированный внелегочный ТБ был лишь у 10 (2,7%) пациентов, ТБ органов дыхания – у 362 из 372 человек (97,3%), которые и составили исследуемую группу.
Из клинических форм ТБ органов дыхания чаще встречались диссеминированный (n = 160; 44,2%) и инфильтративный ТБ (n = 138; 38,1%). Другие формы встречались существенно реже: туберкуломы – у 23 (6,4%) больных, казеозная пневмония – у 12 (3,3%), очаговый ТБ – у 12 (3,3%), туберкулезный плеврит – у 9 (2,5%), ТБ внутригрудных лимфатических узлов – у 4 (1,1%) и фиброзно-кавернозный ТБ – у 4 (1,1%).
Хотя бы одним из методов (люминесцентная ММ и/или посев мокроты на плотные питательные среды) бактериовыделение было выявлено у 261 (72,1%) больного. С помощью рентгенологических методов исследования ТБ органов дыхания в фазе распада определили у 162 (44,8%) больных, у остальных 200 (55,2%) больных были формы ТБ без распада. Таким образом, соотношение частоты бактериовыделения и фазы распада при коинфекции было 1,6:1, а ТБ с бактериовыделением регистрировали в 2,6 раз чаще, чем без него – в 261 и 102 случаях соответственно.
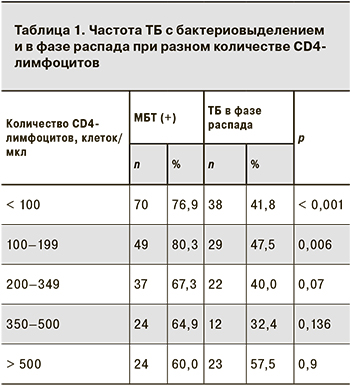
 Результаты выявления частоты бактериовыделения при разной степени иммуносупрессии представлены в табл. 1.
Результаты выявления частоты бактериовыделения при разной степени иммуносупрессии представлены в табл. 1.
Обнаружить возбудителя в мокроте у пациентов с выраженной иммуносупрессией (количество CD4-лимфоцитов < 200 клеток/мкл) удавалось достоверно чаще (у 78,3% больных), чем при количестве CD4-лимфоцитов 200–500 клеток/мкл (у 67,0%) и > 500 клеток/мкл (у 60,5%) (р < 0,05), тогда как достоверных различий по частоте регистрации деструктивных форм при разном количестве CD4-лимфоцитов выявлено не было (p > 0,05).
Люминесцентная ММ дала положительной результат у 212 (58,6%) из 362 больных ТБ органов дыхания, отрицательной – у 133 (36,7%), у 17 (4,7%) больных сведения о результатах микроскопии в базе АСУ «Баклаборатория» отсутствовали.
Сведений о результатах посевов мокроты на плотные питательные среды не было у 19 (5,2%) человек: у 17 сведения отсутствовали в базе и 2 пациентам посевы не выполнялись. Положительные результаты посевов получены у 232 (64,1%) больных ТБ органов дыхания, отрицательные – у 107 (29,5%), контаминация посева – у 4 (1,1%).
Из 17 пациентов, у которых сведения о результатах микроскопии и посевов отсутствовали в больничной базе данных, 13 умерли от ТБ в стационарах общей лечебной сети до перевода в противотуберкулезное учреждение и еще четверо выбыли в другие регионы.
 Для анализа массивности бактериовыделения использовали общепринятую во фтизиатрии градацию результатов посевов и ММ, а положительные результаты микроскопии, отмеченные точным числом обнаруженных кислотоустойчивых МБТ, объединили с группой, где результат микроскопии был расценен как 1+.
Для анализа массивности бактериовыделения использовали общепринятую во фтизиатрии градацию результатов посевов и ММ, а положительные результаты микроскопии, отмеченные точным числом обнаруженных кислотоустойчивых МБТ, объединили с группой, где результат микроскопии был расценен как 1+.
При изучении массивности бактериовыделения по мазкам мокроты (n = 212) оказалось, что в 83,0% случаев имело место скудное бактериовыделение (ММ 1+), доля лиц с ММ 2+ составила 10,4%, с ММ 3+ – 6,6%.
Результаты исследования массивности бактериовыделения по посевам были несколько иными: образцы с обильным ростом МБТ (> 100 КОЕ, 3+) составили 46,7%, с умеренным (21–100 КОЕ, 2+) – 14,9%, со скудным (1–20 КОЕ, 1+) – 38,4%).
Учитывая имеющиеся в современной научной литературе данные о значительном распространении ТБ без бактериовыделения среди больных ВИЧ-инфекцией, мы проанализировали все случаи коинфекции без обнаружения возбудителя в мокроте и провели сравнительный анализ с группой бактериовыделителей.
При бактериовыделении (n = 261) преобладали диссеминированный (n =122; 46,7%) и инфильтративный ТБ (n = 108; 41,4%), казеозная пневмония была у 12 (4,6%) больных, туберкуломы – у 6 (2,3%), очаговый ТБ – у 7 (2,7%), ТБ внутригрудных лимфатических узлов – у 2 (0,8%) и фиброзно-кавернозный ТБ – у 4 (1,5%).
При туберкулезе без бактериовыделения (n =101) самыми частыми формами также были диссеминированный (n = 38; 37,6%) и инфильтративный ТБ (n = 30; 29,7%); очаговый ТБ был у 5 (5,0%) больных, ТБ внутригрудных лимфатических узлов – у 2 (2,0%). Туберкуломы (n = 17; 16,8%) и туберкулезный плеврит (n = 9; 8,9%) чаще встречались в группе больных без бактериовыделения (p < 0,001). Медиана количества СD4-лимфоцитов при ТБ без бактериовыделения была достоверно выше (252 клеток/мкл), чем при его наличии (167 клеток/мкл; р = 0,005).
Тест на лекарственную чувствительность к ПТП был выполнен 206 (88,8%) больным из 232 с положительными результатами посевов мокроты. Лекарственная чувствительность ко всем ПТП 1 ряда была сохранена у 66 (32,0%) больных с коинфекцией, множественная лекарственная чувствительность (МЛУ) была установлена у 107 (51,9%) больных, лекарственная устойчивость к изониазиду в сочетании с другими ПТП (но не МЛУ) – у 24 (11,7%), устойчивость к этамбутолу и/или стрептомицину без устойчивости к другим ПТП – у 9 (4,4%).
Сведения о количестве CD4-лимфоцитов имелись у 167 больных с МЛУ ТБ. Изучение частоты распределения первичной МЛУ при разном уровне иммуносупрессии достоверных различий не выявило (χ2 = 1,499, число степеней свободы – 4; р = 0,827).
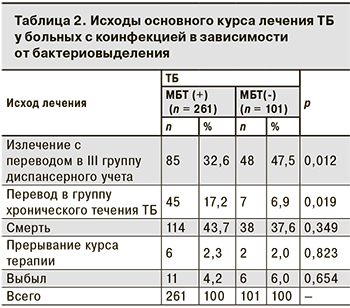
Исходы лечения больных были следующими: 133 (36,7%) человека излечены и переведены в III группу диспансерного фтизиатрического учета, 52 (14,4%) больных переведены в подгруппы хронического течения ТБ, 17 (4,7%) выбыли, 8 (2,2%) прервали курс лечения, умерли 152 (41,9%).
Было установлено, что излечение ТБ (с переводом в III группу диспансерного учета) достоверно чаще регистрировали у лиц с коинфекцией без бактериовыделения, а пациентов с бактериовыделением чаще переводили в подгруппы наблюдения лиц с активным ТБ хронического течения (табл. 2).
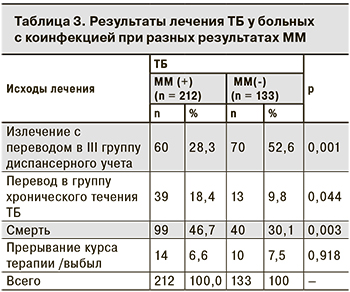
У пациентов с отрицательными (n = 133) и положительными результатами ММ (n = 212) исходы лечения заметно различались (табл. 3), как и медианы количества CD4-лимфоцитов – 231 и 156 клеток/мкл соответственно (р < 0,05).
Отдельно проанализировали частоту выявления возбудителя в мокроте у 152 умерших больных. Необходимость выделения этой группы была продиктована и тем, что в 37 (24,3%) случаев смерть наступила вне противотуберкулезного учреждения (в том числе во время пребывания в стационарах общей лечебной сети, куда были госпитализированы пациенты с ВИЧ-инфекцией и неясной легочной патологией до верификации ТБ). Доля умерших с бактериовыделеним составила 75,0% (n = 114), при этом ТБ в фазе распада был только у 39,5% из них (n = 60). У умерших без бактериовыделения (n = 38) среди клинических форм ТБ органов дыхания предсказуемо преобладал диссеминированный ТБ (n = 26; 68,4%), а в остальных случаях (n = 12; 31,6%) имело место сочетание ТБ с другими вторичными заболеваниям, сыгравшими роль в танатогенезе.
Обсуждение
Известно, что ММ является одним из основных методов первичного обследования пациентов с коинфекцией для своевременной диагностики ТБ. В то же время ряд исследователей [10, 11] указывают на то, что при выраженной иммуносупрессии ТБ не сопровождается бактериовыделением по результатам ММ, затрудняя диагностику, но именно в таких случаях наблюдается высокая частота летальных исходов. В отличие от некоторых ранее опубликованных данных, в том числе и наших [12–14], результаты этого исследования показали, что большинство (72,1%) случаев впервые выявленного ТБ у больных ВИЧ-инфекцией сопровождается обнаружением МБТ из мокроты не только посевом на плотные среды, но и методом микроскопии. При ММ возбудитель ТБ был обнаружен практически у 6 из 10 больных с коинфекцией, а при глубокой иммуносупрессии (количество CD4-лимфоцитов < 200 клеток/мкл) – в 8 из 10 случаев. Эти сведения, позволяют, во-первых, говорить о фактическом отсутствии диагностических затруднений в большинстве новых случаев ТБ (в том числе на поздних стадиях ВИЧ-инфекции), а во-вторых – полагать, что больные с коинфекцией представляют, по крайней мере, не меньшую эпидемиологическую опасность, чем больные ТБ в целом. Рассматривая случаи коинфекции с эпидемиологических позиций, нельзя не учитывать и высокую частоту первичной МЛУ (51,2%), которая регистрировалась вне зависимости от уровня иммунодефицита. Кроме того, результаты лечения в нашем исследовании были значительно хуже при ТБ с положительным результатом ММ, когда число летальных исходов в 1,6 раз превышало показатели клинического излечения.
Выводы
- Возбудителя ТБ удалось обнаружить в мокроте как минимум одним из фенотипических методов у 72,1% впервые выявленных больных с коинфекцией ВИЧ/ТБ с поражением органов дыхания. Люминесцентная микроскопия мазка мокроты дала положительный результат в 58,6% случаев, посевы на плотных питательных средах – в 64,1% случаев ТБ органов дыхания.
- Бактериовыделение чаще регистрировали при выраженной иммуносупрессии с количеством CD4-лимфоцитов < 200 клеток/мкл (р < 0,05).
- При люминесцентной микроскопии мазка мокроты чаще (48,7%) определялось скудное бактериовыделение, а при культуральном исследовании на плотных питательных средах в 29,6% случаев регистрировали обильный рост.
- У каждого второго больного ВИЧ/ТБ с бактериовыделением имелась первичная МЛУ МБТ (51,9%), наличие которой не зависело от степени иммуносупрессии.
- Частота летальных исходов среди больных с коинфекцией была очень высока, однако различалась при наличии (46,7%) или отсутствии (30,1%) бактериовыделения, выявленного по мазку мокроты (р < 0,005).
- По окончании основного курса лечения среди бактериовыделителей по сравнению с больными без бактериовыделения реже регистрировали клиническое излечение ТБ и чаще – перевод в группы активного ТБ с хроническим течением (p < 0,05).



