Прогнозирование эффективности какого-либо вида лечения – одно из перспективнейших направлений развития медицины, независимо от области и вида деятельности. Для оценки эффективности противовирусной терапии (ПВТ) хронических вирусных гепатитов (ХВГ) изучаются новые факторы, которые, по мнению исследователей, прямо или косвенно влияют на исход лечения. Тем не менее количество перспективных в отношении противовирусного лечения ХВГ предикторов становится больше, их число увеличивается с каждым днем, но прогнозировать эффективность терапии хотя бы на уровне 95% у конкретного пациента до сих пор не удается [1–3].
Не изученной остается роль нарушений морфофункциональной структуры соединительной ткани в развитии и прогрессировании патологического процесса в печени, несмотря на то что соединительная ткань, являясь повсеместно распространенной в организме, участвует во всех процессах [4, 5]. Врожденные дефекты биосинтеза коллагена и других компонентов соединительной ткани ведут к формированию разнообразных клинико-функциональных нарушений, способствуют активации фиброгенеза, в том числе и в печени, ускоряют формирование цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК).
Синдром недифференцированной дисплазии соединительной ткани (НДСТ) является генетически детерминированным состоянием и характеризуется дефектами волокнистых структур и основного вещества соединительной ткани, приводящем к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфо-функциональных нарушений висцеральных и локомоторных органов с прогредиентным течением [6].
В настоящее время под термином НДСТ понимают нозологически самостоятельный синдром мультифакториальной природы, проявляющийся внешними фенотипическими признаками и клинически значимой дисфункцией одного или нескольких внутренних органов [5].
Следует признать, что в настоящее время не существует препаратов и схем для лечения больных ХВГ, которые могли бы быть признаны абсолютно эффективными, приводящими к достижению стопроцентного гарантированного стойкого вирусологического ответа. Поэтому, оптимизация отбора больных с учетом предикторов эффективности ПВТ является важным условием индивидуализации лечения ХВГ и, в конечном счете, повышения эффективности терапии.
Цель исследования – определение влияния синдрома НДСТ на эффективность ПВТ у больных с ХГС.
Материалы и методы
В исследовании принял участие 71 пациент с ХГС в возрасте от 23 до 65 лет (средний возраст – 43,16 ± 6,24 года), находившийся на лечении в ГБУ «Республиканский центр инфекционных болезней» (Грозный, Чеченская Республика), получивший за период с 2014 по 2016 г. ПВТ в рамках республиканской программы по лечению ХВГ. Среди пациентов было 37 (52,11%) мужчин и 34 (47,89%) женщины. 68 (95,77%) участников исследования работали. HCV генотипа 1 определен у 38 (53,52%) пациентов, генотипов 2 или 3 – у 33 (46,48%) человек.
Пациентов разделили на 2 группы: в 1-ю вошли 48 больных с ХГС и признаками НДСТ, во 2-ю – 23 больных с ХГС без клинических признаков НДСТ.
Исследование проводили в соответствии с требованиями Конвенции о правах человека и биомедицине (1997) и Хельсинской декларации Всемирной медицинской ассоциации (2000) с разрешения этического комитета. У всех пациентов было получено письменное добровольное информированное согласие на участие в исследовании.
В исследование были включены пациенты:
- старше 18 лет;
- с верифицированным диагнозом ХГС;
- ранее не получавшие ПВТ по поводу ХГС;
- не употреблявшие психоактивные вещества парентерально в последние 6 мес.
Критериями исключения пациентов из исследования были:
- возраст моложе 18 лет;
- наличие беременности у женщин;
- сопутствующие онкологические и аутоиммунные заболевания;
- ВИЧ-инфекция.
Общеклиническое, лабораторное и инструментальное обследование проводили в соответствии со стандартами по ведению пациентов с ХВГ1. Диагноз ХГС устанавливали на основании обнаружения РНК HCV и наличия маркеров гепатита С.
Проводили генотипирование HСV с помощью термоциклера для амплификации нуклеиновых кислот iCycler iQ5 (Bio-Rad, США). Использовали тест-системы и программу «РеалБест Диагностика» (ЗАО «Вектор-Бест», Россия). Подсчет вирусной нагрузки выполняли на автоматическом анализаторе Abbot m2000rt с линейным диапазоном от 25 до 10 000 000 копий/мл.
 Оценку степени выраженности фиброза печени проводили на аппарате FibroScan (Echosens, Франция) по шкале METAVIR. Полученный результат выражали в килопаскалях (кПа), что позволяло распределять больных по степени фиброза от F0 до F4 [7].
Оценку степени выраженности фиброза печени проводили на аппарате FibroScan (Echosens, Франция) по шкале METAVIR. Полученный результат выражали в килопаскалях (кПа), что позволяло распределять больных по степени фиброза от F0 до F4 [7].
Эффективность ПВТ определяли на основании вирусологического ответа, который оценивали на следующих этапах лечения: 4-я неделя ПВТ – быстрый вирусологический ответ (БВО) при отсутствии РНК HCV в крови на указанном сроке мониторинга; 12-я неделя – ранний вирусологический ответ, который подразделяли на полный (пРВО – отсутствие РНК HCV в крови) и частичный (чРВО – снижение репликативной активности HCV в 100 раз и более от исходного, качественный анализ на РНК HCV в крови был положительным); 24/48-я неделя – первичный вирусологический ответ (ПВО); 24-я неделя после окончания терапии – устойчивый вирусологический ответ (УВО). О достижении ПВО и УВО свидетельствовало отсутствие РНК HCV в крови на указанных сроках лечения и наблюдения.
Диагностику синдрома НДСТ проводили на основе анализа системного вовлечения соединительной ткани согласно пересмотренным Гентским критериям (табл. 1) [8]. Диспластикозависимые изменения выявляли в среднем по 4,46 ± 0,33 системам. На 1 пациента приходилось по 7,92 ± 0,78 диспластикозависимых синдромов. Системная вовлеченность, согласно Гентским критериям (2010), составила 8,45 ± 0,22 баллов.
Все пациенты с ХГС получали двойную ПВТ, включавшую ПегИФН-α (Schering-Plough Brinny Company, Ирландия) или пегасис (Roche Diagnostics GmbH, Германия) в комбинации с рибавирином [9–11]. Продолжительность терапии определялась генотипом HCV и составляла от 24 до 48 нед, Все пациенты закончили полный курс назначенной терапии, случаев досрочного завершения лечения из-за побочных эффектов или желания пациента не зарегистрировано. Все пациенты, включенные в исследование, были наивными, то есть ранее не получали ПВТ по поводу ХГС.
Для статистической обработки данных использовали программу StatSoft Statistica v.6.0. В случае нормального распределения признака в выборке, результаты представляли в виде среднего арифметического (М) и его стандартной ошибки (m). Для всех видов анализа статистически достоверным считали значения при р ≤0,05.
Результаты
Эффективная ПВТ регистрировалась у 57 (80,28%) пролеченных больных ХГС, что соответствует данным других исследований при использовании указанной схемы лечения. Мы изучили эффективность ПВТ в зависимости от наличия или отсутствия у больных синдрома НДСТ (табл. 2).
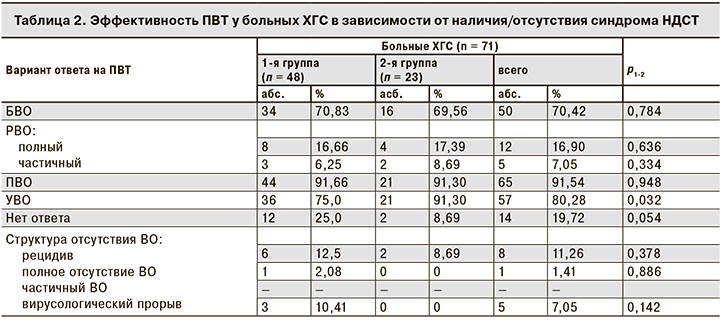
Полученные результаты свидетельствуют об одинаковой частоте наступления БВО в обеих группах (70,83% в 1-й группе и 69,56% – во 2-й), РВО и ПВО, которые достигали более 90%, отражая высокую эффективность проведенного лечения. А вот показатели УВО у пациентов в 1-й группе были достоверно ниже (p < 0,05), чем во 2-й: 75,0 и 91,3% соответственно.
Рецидивы инфекции, полное отсутствие вирусологического ответа, вирусологический прорыв чаще регистрировали у больных 1-й группы, имевших признаки НДСТ (n = 12; 25,0%), и только у 2 (8,69%) больных 2-й группы был зафиксирован рецидив HCV.
Известно, что на частоту развития БВО, ПВО, УВО влияет генотип HCV. Мы сравнили эффективность ПВТ у пациентов с ХГС, вызванным разными генотипами HCV, в зависимости от наличия/отсутствия синдрома НДСТ (табл. 3).
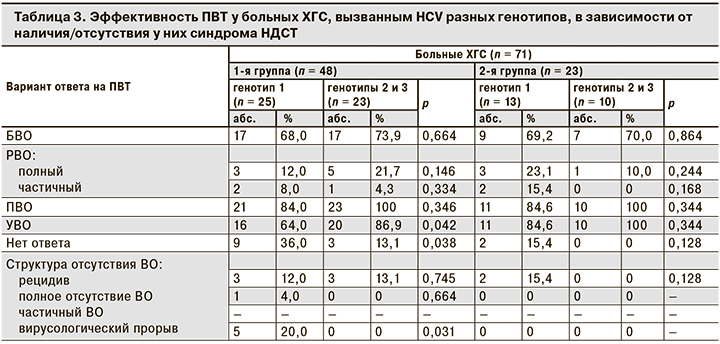
Проведенный анализ показал, что диспластические процессы у пациентов с HCV генотипов 1 и не 1 не являются значимыми для достижения БВО, РВО. Достоверные результаты получены только при достижении УВО: у пациентов с HCV генотипа 1 в 1-й группе УВО регистрировали в 64% случаев, во 2-й – в 84,6%. У пациентов с генотипами 2 и 3 показатели были еще выше, особенно во 2-й группе, где УВО регистрировали у 100% пролеченных.
У пациентов 1-й группы с HCV генотипа 1 отсутствие ВО отмечалось в каждом 3-м случае и чаще было связано с вирусологическим прорывом, а во 2-й группе у пациентов с этим генотипом вируса неэффективность лечения была связана исключительно с рецидивом заболевания.
Результаты влияния ПВТ на основные клинико-лабораторные и морфологические показатели больных ХГС в зависимости от наличия или отсутствия синдрома НДСТ представлены в табл. 4.
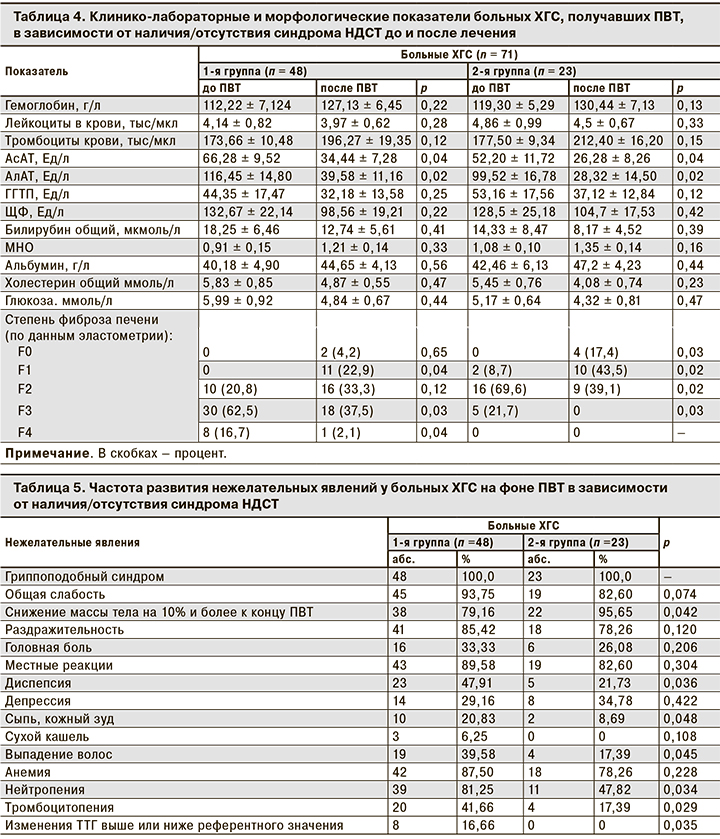
Основные гематологические показатели изменялись в соответствии с действием препаратов: уровень лейкоцитов в крови снизился, показатели гемоглобина и тромбоцитов повышались. Мы отметили, что во 2-й группе параметры были несколько выше, чем в 1-й. Нормализация показателей трансаминаз наблюдалась в обеих группах по окончании лечения, но у пациентов 1-й группы они были на верхней границе нормы (АсАТ – 34,44 ± 7,28 Ед/л; АлАТ – 39,58 ± 11,16 Ед/л).
Значительные различия в группах пациентов с НДСТ и без признаков дисплазии получены при оценке морфофункционального состояния печени методом эластометрии. У пациентов 1-й группы изначально в печени диагностировали фибротические изменения, соответствующие F2, F3 и F4 по шкале METAVIR, отсутствовали или были выражены незначительно фибротические изменения только у 27,1% больных. В то же время у пациентов 2-й группы регистрировали в основном фибротические изменения, соответствующие F2 (69,6%).
По окончании ПВТ мы наблюдали значительное улучшение структуры печени, более выраженное у пациентов 2-й группы: после ПВТ у них определялись незначительные изменения структуры печени или полное ее восстановление (F1 – у 43,5%, F0 – у 17,4%).
У 70% пациентов 1-й группы были диагностированы выраженные морфофункциональные изменения, соответствующие F2 и F3. Но одновременно значительно уменьшилось число пациентов, у которых до лечения определяли ЦП. Почти наполовину уменьшилось число больных с фибротическими изменениями, соответствующими F3.
Нежелательные явления, возникающие в результате лечения, регистрировались на протяжении всего курса ПВТ и спустя 24 нед. после его окончания достаточно часто (табл. 5).
Гриппоподобный синдром, общая слабость, раздражительность наблюдалась у большинства пациентов, получавших ПВТ, и не зависели от наличия или отсутствия НДСТ, а определялись применением ПегИФН в комплексной терапии. С их применением связано и проявление местных реакций при введении препаратов, которые достаточно часто регистрировали в обеих группах. Достоверно чаще пациенты 1-й группы жаловались на диспептические проявления (47,91%), кожную сыпь и зуд (20,83%), выпадение волос (39,58%). Мы связываем это с тем, что в структуре тканей желудочно-кишечного тракта, кожи и ее придатков имеется большое количество коллагена, который в ходе ПВТ подвергается дестабилизации и определяет появление вышеописанных жалоб.
Снижение массы тела на 10% и более к концу ПВТ отмечали у 95,65% пациентов 2-й группы, несколько чаще в этой группе проявлялась депрессия – у 34,78% пациентов.
Обсуждение
Прoгностические факторы ответа на лечение ХГС (predictors of response) в настоящее время активно изучаются и рассматриваются разными авторами в различной по значимости последовательности.
К базовым факторам, позволяющим прогнозировать вероятность УВО, относят генотип вируса и концентрацию РНК HCV в плазме крови. На эффективность лечения также влияет наличие сопутствующих заболеваний, требующих приема определенных медикаментов, и другие факторы. Достижение УВО у пациентов с ХГС варьирует в широких пределах – от 30 до 100% случаев. Для каждого больного важно, попадет он в 30% эффективности, или у него есть 100%-й шанс полного излечения от инфекции.
Персонализация лечения, базирующаяся на результатах полного клинического и инструментально-лабораторного исследования, позволяет прогнозировать эффективность терапии еще до её начала. Именно индивидуальный подход к назначению ПВТ ХГС позволяет минимизировать риск возможных серьезных побочных эффектов, включая тяжелые лекарственные аллергии, максимально рано выявить лиц с отсутствием ответа и не начинать ПВТ у больных с низкой вероятностью ее успеха. Также значительно уменьшаются материальные затраты на дорогостоящее лечение.
Среди индивидуальных особенностей организма пациента, способствующих элиминации вируса и достижению УВО, выделяют: принадлежность к европеоидной расе, более молодой возраст, низкие значения индекса массы тела, отсутствие алкогольной и/или наркотической зависимости, отсутствие психических заболеваний, отсутствие или минимальная выраженность инсулинорезистентности, стеатоза и фиброза печени. Немаловажное значение имеет мотивация больного и его приверженность к лечению [12].
Проведенные нами исследования эффективности ПВТ у больных ХГС показали заинтересованность соединительнотканных структур в достижения УВО. У пациентов с НДСТ УВО регистрировали в 75% случаев, у пациентов без клинических признаков дисплазии соединительной ткани – в 91,3%.
Существенные различия эффективности ПВТ мы объясняем развивающейся при НДСТ иммунологической недостаточностью, которая препятствует полной элиминации HCV. Данные проведенных ранее исследований свидетельствуют о значительном снижении количества СD3+- и СD4+-лимфоцитов, повышении количества СD8+-лимфоцитов у пациентов с диспластическими проявлениями, отражающими выраженное иммунодефицитное состояние [13].
100%-ая эффективность проведенного лечения, позволяющая добиться элиминации HCV из крови больных через 6 мес. после его окончания, наблюдалась исключительно у пациентов с генотипами 2 и 3 без НДСТ.
При ХГС диспластические процессы существенно влияют на частоту и выраженность побочных явлений, возникающих в ходе ПВТ, определяя тяжесть развивающейся лейкопении, тромбоцитопении, диспепсии, обусловливая появление кожных высыпаний и выпадение волос, снижая уровень тиреотропного гормона. Также у пациентов, не имеющих диспластических проявлений, восстановление морфофункциональной активности печени происходит значительно быстрее и более выражено по сравнению с пациентами, у которых диагностирован синдром НДСТ.
Наибольшее влияние диспластические проявления оказывают на возникновение в ходе ПВТ гематологических нежелательных явлений (частое развитие нейтропении, тромбоцитопении, изменение уровня ТТГ), что мы связываем с «заинтересованностью» этих структур в развитии неполноценности соединительной ткани и ее соответствующей реакцией на лечение.
Таким образом, персонализированная терапия ХГС должна включать выявление у больного клинических признаков синдрома НДСТ, наличие или отсутствие которых (в совокупности с генотипом HCV) позволяет с высокой долей вероятности предполагать эффективность лечения и выраженность нежелательных явлений.
Выводы
- Эффективность ПВТ ХГС зависит от наличия или отсутствия у больного НДСТ.
- Назначение комбинации ПегИФН и рибавирина в качестве первого курса ПВТ у пациентов с ХГС, вызванным HCV генотипов 2 и 3, и синдромом НДСТ приводило к формированию УВО в 87% случаев, у пациентов с HCV генотипа 1 – в 64%.
- При назначении комбинированной терапии больным без синдрома НДСТ УВО достигли 100% пациентов с HCV генотипов 2 и 3 и 85% пациентов с генотипом 1.
- У больных ХГС диспластические процессы существенно влияют на частоту и выраженность побочных явлений, возникающих в ходе ПВТ.



