Инфекции, связанные с оказанием медицинской помощи (ИСМП), продолжают оставаться важной и сложной проблемой современного здравоохранения, одной из задач которого является создание безопасной среды пребывания для пациентов и персонала в организациях, осуществляющих медицинскую деятельность.
Особую опасность ИСМП представляют в акушерстве, где сконцентрированы высоковосприимчивые к инфекции новорожденные и родильницы. Отмечен значительный размах заболеваемости ИСМП на разных территориях. В родовспомогательных учреждениях Москвы частота ИСМП новорожденных составляет 10–12% (100–120 случаев на 1000 родившихся). На этапе выхаживания новорожденных ИСМП определяется у 65–70% детей, большая их часть поступает в стационар с уже сформировавшимся очагом поражения [1].
Эпидемический процесс ИСМП в акушерских стационарах протекает чаще в форме гнойно-септических инфекций (ГСИ) и имеет свои особенности и закономерности для родильниц с физиологическими родами и с оперативным родоразрешением, а также для доношенных и недоношенных новорожденных. По наблюдениям О.Ф. Ковтуновой и соавт. [1], ГСИ у недоношенных детей возникают в 3,8 раза чаще, чем у детей, родившихся в срок. При этом в структуре ГСИ у недоношенных доминировали пневмонии (31,7%), омфалиты (22,6%) и некротизирующие энтероколиты (12,6%). У доношенных детей преобладали конъюнктивиты (46,8%) и заболевания кожи и подкожно-жировой клетчатки (21,7%). Генерализация ГСИ у преждевременно родившихся детей происходила в 5,6 раз чаще по сравнению с детьми, родившимися в срок. Проведенные авторами исследования показали, что совместное с матерью пребывание новорожденных существенно снижает риск возникновения ГСИ и является предпочтительной формой содержания детей в акушерских стационарах [1–3].
Заболеваемость внутрибольничными ГСИ в акушерских стационарах связана с циркуляцией госпитальных штаммов возбудителей, обладающих целым рядом биологических свойств, способствующих адаптации микроорганизмов к экологическим условиям больничной среды. Адаптация микроорганизмов к условиям стационара происходит, как минимум, по двум направлениям: приобретения резистентности к антимикробным препаратам (АМП) – антибиотикам, антисептикам, дезинфицирующим средствам – и усиления вирулентности. Кроме того, формируется устойчивость штаммов во внешней среде, усиливаются колонизационные свойства возбудителей [4, 5].
Описано большое количество молекулярно-генетических механизмов антибиотикорезистентности. В результате ее эволюции появились бактериальные патогены со множественной лекарственной устойчивостью (MDR), экстремальной лекарственной устойчивостью (XDR) и полной лекарственной устойчивостью (PDR) [6].
Определена группа наиболее распространенных клинически значимых патогенов с высоким уровнем лекарственной устойчивости (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumanii, Pseudomonas aeruginosa, Enterobacter spp.), объединенная аббревиатурой ESCAPE и представляющая растущую угрозу в инфекционной патологии.
В Российской Федерации, как и во всем мире, K. pneumoniae занимает лидирующее место среди госпитальных штаммов за счет быстрого формирования экстремального уровня резистентности к АМП. Исследования последних лет позволили выявить 2 эволюционные линии: K. pneumoniae классические и гипервирулентные [7, 8]. Классические K. pneumoniae (cKp) вызывают заболевания у детей младенческого возраста и взрослых, чаще у пожилых и лиц с ослабленным иммунитетом. До начала широкого использования АМП большинство штаммов cKp с низким уровнем вирулентности обладали только природной устойчивостью к пенициллину и карбенициллину. Широкое применение АМП привело к формированию MDR-штаммов [7]. Устойчивость к АМП обусловлена наличием у бактерий генов β-лактамаз (bla), интегронов, других генетических детерминант. Продуценты β-лактамаз устойчивы к ингибиторзащищенным АМП (амоксициллину-клавуланату), а также к цефалоспоринам III поколения (цефотаксиму, цефтриаксону, цефтазидиму)1. Отмечается стремительное распространение β-лактамаз СТХ-M-типа со способностью гидролизовать цефалоспорины IV поколения (цефепим) [9, 10].
Распространение штаммов ESBL (Extended-spectrum beta-lactamases) привело к снижению использования β-лактамных антибиотиков (наиболее употребляемой группы АМП) в лечении тяжелых госпитальных инфекций, возрастанию частоты применения карбапенемов (имипенема, меропенема). Вслед за этим стала формироваться устойчивость к препаратам резерва – карбапенемам, что может способствовать возникновению трудно ликвидируемых вспышек заболеваний [10]. Несколько типов карбапенемаз получили распространение среди клебсиелл и других энтеробактерий: КРС (Klebsiella Pneumoniae Carbapenemase – карбапенемаза), группа ферментов ОХА-типа, в частности, ОХА-48 (оксациллиназа 48) и NDM-типа (New-Delhi metallo-β-лактамаза – Нью-Дейли металло-β-лактамаза), VIM (Verona integron-borne metallo-β-lactamase – Верона-интегрон-кодированная металло-β-лактамаза). Наличие карбапенемаз является устойчивым маркером экстремальной антибиотикорезистентности. Игнорирование этого факта приводит к неадекватной стартовой терапии и повышению риска неблагоприятного исхода клинических случаев [6, 11].
Вторая эволюционная ветвь клебсиелл – гипервирулентные K. pneumoniae (hvKp), способные вызывать тяжелые заболевания с высокой частотой летальных исходов. Высокий уровень вирулентности hvKp-штаммов позволяет им инфицировать здоровых людей. Отличительным признаком большинства hvKp-штаммов является гипермукоидность (ГМ) с гиперпродукцией капсульных полисахаридов [12, 13]. Среди более чем 100 капсульных типов, выявленных в настоящее время у K. pneumoniae, штаммы капсульных типов К1 и К2 (в меньшей степени К5, К20, К54, К57), обладающие признаком гипермукоидности, являются наиболее вирулентными для человека [14, 15]. Приобретение лекарственной устойчивости у hvKp приводит к формированию «суперпатогенов», то есть гипервирулентных и одновременно антибиотикорезистентных K. pneumoniae [7].
Вирулентность клебсиелл детерминируется генами вирулентности плазмидной и хромосомной локализации. В целом сложный генетический аппарат, ассоциированный с капсульными типами, сиквенс-типами, генетическими детерминантами вирулентности и лекарственной устойчивости, определяет высокую пластичность, гетерогенность и клональную структуру возбудителя. Таким образом, в основу эпидемиологического надзора за ИСМП должно быть положено слежение за формированием и распространением госпитальных штаммов. При этом современный мониторинг предполагает определять не только общий уровень лекарственной устойчивости ведущих патогенов, но и выявлять с использованием фенотипических и генотипических методик агрессивные экстремально антибиотикорезистентные клоны бактерий, генотипы, а также отдельные генотипические линии (сиквенс-типы). Такая информация необходима для понимания механизмов развития и распространения в больничной среде и за ее пределами лекарственно устойчивых, в том числе карбапенемазопродуцирующих бактерий, для определения адекватных мер противодействия [3, 9, 16].
Цель исследования – эпидемиологическая оценка случаев заболеваний ГСИ, имевших место в роддоме Хабаровска в августе–сентябре 2017 г.
Материалы и методы
В период с 15 августа по 14 сентября 2017 г. в роддоме Хабаровска зарегистрированы случаи ГСИ, обусловленные условно-патогенными бактериями (УПБ).
В период вспышки специалистами Управления Роспотребнадзора по Хабаровскому краю и ФБУЗ «Центр гигиены и эпидемиологии в Хабаровском крае» было проведено эпидемиологическое расследование ситуации и обширное бактериологическое обследование как детей, поступивших после роддома с различной патологией в КГБУЗ «Перинатальный центр» Хабаровска (далее – Перинатальный центр), так и персонала роддома. Выполнено также исследование смывов с объектов окружающей среды акушерского стационара, проб воздуха и дезинфицирующих растворов.
Среди возбудителей зарегистрированы Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus haemolyticus, Streptpcoccus pyogenes, Enterococcus faecalis, Klebsiella pneumoniae, Enterobacter spp.
Бактериологические исследования выполняли классическим методом (посев на питательные среды, выделение чистых культур и их идентификация). Чувствительность к антибиотикам определяли диско-диффузионным методом по отношению к 22 АМП с оценкой результатов тестирования в соответствии с EUCAST, версия 8.0. Изучена также литическая активность 5 бактериофагов (пиофаг комплексный, секста-фаг, стафилококковый фаг, фаг клебсиелл пневмонии, клебсиеллезный поливалентный фаг) по отношению к выделенным микроорганизмам. Результаты фенотипической идентификации и определения лекарственных маркеров подтверждали в бактериологическом анализаторе Vitec 2 Compact в лаборатории ФБУН «Хабаровский НИИ эпидемиологии и микробиологии» Роспотребнадзора. На базе ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии» Роспотребнадзора (ФБУН ГНЦ ПМБ) проведено подтверждение видовой принадлежности выделенных культур клебсиелл масс-спектрометрическим методом (MALDI-TOF MS). Осуществлено также определение гипермукоидного фенотипа и молекулярно-биологическое исследование клебсиелл (RAPD-типирование; ПЦР-типирование по wzy-генам, специфичным для основных капсульных типов К1, К2, К5, К20, К54, К57; выявление факторов вирулентности). Рассчитывали удельный вес (М) выделенных в ходе исследования возбудителей и ошибку среднего (m) с использованием программы Exel.
Результаты
Акушерский стационар располагается в отдельно стоящем четырехэтажном здании, рассчитанном на 78 рожениц. В его составе – родильный блок (3 предродовые палаты, родильный зал, операционная, ординаторская, подсобные помещения), послеродовое отделение на 45 коек, отделение патологии беременных (25 коек), хозрасчетное отделение (8 коек), отделение новорожденных (50 коек). Предстерилизационная очистка, стерилизация изделий медицинского назначения проводятся в централизованном стерилизационном отделении (ЦСО) акушерского стационара.
В предшествующий вспышке период ситуация по заболеваемости ГСИ в учреждении была нестабильной. Так, в мае 2017 г. в роддоме были зарегистрированы 4 случая заболеваний новорожденных гнойным конъюнктивитом, обусловленным S. aureus. Этот возбудитель был обнаружен также в пробе воздуха в одной из палат детского отделения. После проведенного комплекса дополнительных противоэпидемических мероприятий результатов, не отвечающих требованиям санитарного законодательства, не обнаружено. С 30.06 по 14.08 2017 г. случаев заболеваний ГСИ среди новорожденных и родильниц не отмечено.
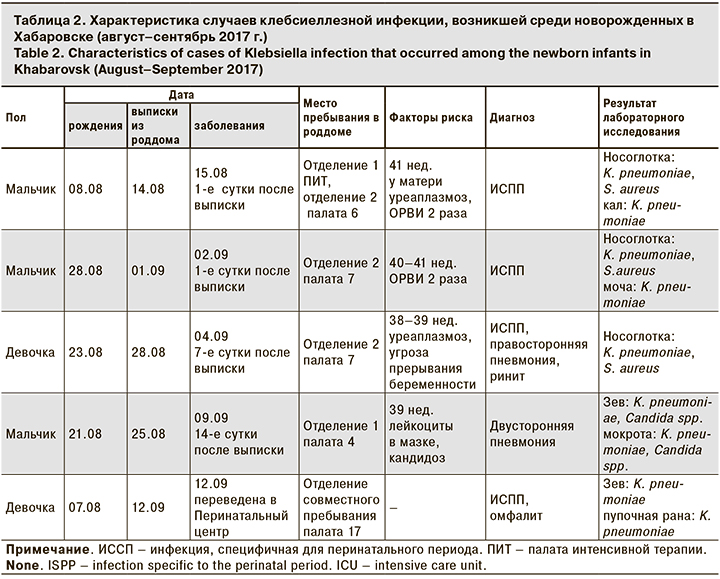
В период с 15.08 по 14.09 2017 г. зарегистрированы случаи заболеваний ГСИ среди новорожденных и случай заболевания ГСИ у родильницы (послеродовый эндометрит). Из 12 заболевших новорожденных трое заболели в день выписки из роддома, трое – в 1-й день после выписки, двое – на 2-й и 3-й день, двое – на 7-й день, 1 – на 14-й день и 1 новорожденная – на 19-й день после выписки. Все новорожденные после регистрации заболевания были госпитализированы в Перинатальный центр. В соответствии с СанПиН 2.1.3.2630-102 заболевания новорожденных инфекциями, вызванными условно-патогенной флорой и выявленные в период пребывания в акушерском стационаре и (или) в течение 7 дней после выписки, подлежат учету по данному стационару. Генерализованные формы (сепсис, остеомиелит, менингит) учитываются за стационаром в течение 1 мес. после рождения. Среди диагнозов у новорожденных – инфекции, специфичные для перинатального периода: омфалит, конъюнктивит, флебит пупочной вены, подкожный панариций, врожденная патология слезно-носового канала, осложнившаяся дакриоциститом. В 2 случаях диагностирована пневмония односторонняя и двухсторонняя. В 1 случае развился сепсис, некротизирующий энтероколит, септический шок, летальный исход.
Случаи заболеваний установлены среди детей, находившихся в 3 отделениях и разных палатах в пределах одного отделения. Клиническая картина ГСИ характеризовалась локальными проявлениями, наличием симптомов интоксикации, повышением температуры тела выше 38 °С, в некоторых случаях – кашлем, одышкой. Заболевания протекали в среднетяжелой форме, у части больных – в тяжелой.
В период расследования вспышки было проведено бактериологическое обследование детей, переведенных в Перинатальный центр для лечения (12 человек), а также персонала роддома (71 человек). Всего в период с 15.08. по 14.09 от 12 новорожденных выделены 24 изолята патогенных биологических агентов (ПБА), в том числе:
- от 5 младенцев – K. pneumoniae из ротоглотки, носоглотки, пупочной раны, мочи, мокроты, в том числе у 4 детей возбудитель выделен из 2 локусов, а также у 3 – в сочетании с S. aureus и C. аlbicans (всего 14 изолятов);
- от 4 детей – S. aureus из ротоглотки, панариция, при этом в 1 случае одновременно выделен S. epidermidis из пупочной раны (всего 5 изолятов);
- от 1 ребенка – Enterobacter cloacae из ротоглотки, Enterococcus faecalis из пупочной раны (2 изолята);
- от 2 детей (в том числе от 1 ребенка с летальным исходом) – S. pyogenes из крови, выпота брюшной стенки, пупочной раны (3 изолята). При обследовании персонала роддома (71 человек) от 13 человек из ротоглотки выделен S. aureus с интенсивностью обсеменения 104 КОЕ/тампон (18,3 ± 4,6% случаев). В числе бактериовыделителей оказались врач-неонатолог, акушерка, палатные и операционные медицинские сестры, буфетчица, санитарка. Следует учесть, что бактериологическое обследование персонала проведено в конце периода вспышки после мероприятий по санации персонала.
У 6 сотрудников роддома выделена K. pneumoniae (8,5 ± 3,3% случаев), в том числе у 4 – из ротоглотки или носоглотки, у 2 человек (младший медицинский персонал) – из мочи, в том числе у 1 санитарки – из двух локусов (7 изолятов).
Установлено, что все 20 штаммов S. aureus, выделенных от детей (7 штаммов) и персонала (13 штаммов), не относились к группе метициллинрезистентных (MRSA) вариантов. Большая часть культур S. aureus от детей по характеру лекарственной устойчивости принадлежала к одному фенотипическому варианту, что проявлялось в устойчивости только к эритромицину из 12 испытанных АМП. Такие штаммы были негативными по отношению к стафилококковому бактериофагу. Все штаммы S. aureus, выделенные от персонала роддома, также были чувствительны к большинству АМП, группировались в 4 фенотипа по лекарственным маркерам, отличаясь по устойчивости к ампициллину и эритромицину. При этом устойчивость к эритромицину также сочеталась со слабым лизисом стафилококковым фагом. Большая часть культур хорошо лизировалась фагом.
Напротив, 2 группы штаммов K. pneumoniae, выделенных от 5 новорожденных (1-я группа) и 6 сотрудников акушерского стационара (2-я группа), существенно различались по признаку лекарственной устойчивости. Штаммы от новорожденных относились к типичным госпитальным вариантам – продуцентам β-лактамаз расширенного спектра. Из 22 испытанных АМП штаммы проявляли устойчивость к большинству β-лактамных антибиотиков, включая ингибиторзащищенный амоксиклав и цефалоспорины III–IV поколения, и были чувствительны только к 4 препаратам (амикацину, левофлоксацину, меропенему, имипенему), то еcть не являлись продуцентами карбапенемаз.
Штаммы от персонала были чувствительны практически ко всем испытанным АМП, кроме ампициллина и цефуроксима.
Последующее более детальное фенотипическое и молекулярно-биологическое изучение 2 групп штаммов K. pneumoniae, выделенных от новорожденных и персонала роддома (всего 10 штаммов), было выполнено специалистами ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии» Роспотребнадзора (ФБУН ГНЦ ПМБ) г. Оболенска (табл.1).
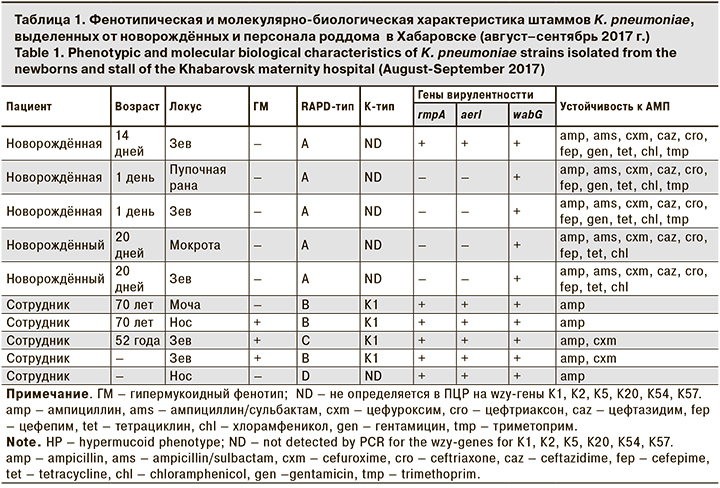
Результаты MALDI-TOF-исследования подтвердили принадлежность всех выделенных культур к виду K. pneumoniae. Для установления различий или сходства между двумя группами штаммов было проведено RAPD-PCR-типирование (метод случайно амплифицируемых полиморфных фрагментов ДНК), выявление признака гипермукоидного фенотипа, определение капсульных типов, генов вирулентности (rmpA, aerI, wabG), маркеров лекарственной устойчивости, чувствительности к лабораторным фагам. По этим характеристикам все 5 штаммов, выделенных от новорожденных, относились к единому генотипу А; не обладали признаком «гипермукоидного фенотипа»; по капсульному типу вошли в категорию ND (не определяются с праймерами на wzy-гены К1, К2, К5, К20, К54 и К57); в 4 случаях обладали только 1 геном вирулентности wabG; были не чувствительны к экспериментальным фагам KpV41, KpV74, KpV289 и устойчивы к 8–10 АМП. Эти результаты позволяют заключить, что штаммы, выделенные от новорожденных, составляют довольно однородную группу, что указывает на определенную эпидемиологическую связь между заболеваниями.
Штаммы 2-й группы, выделенные от персонала, напротив, относились к другим 3 RAPD-типам (B, C, D); 3 из 5 штаммов обладали признаком «гипермукоидного фенотипа»; все 5 штаммов относились к капсульным типам K1 и ND; 4 штамма обладали 3 факторами вирулентности, чувствительностью к экспериментальным фагам и большинству АМП. То есть штаммы 2-й группы представляют собой разнородную по генотипам и другим свойствам группу клебсиелл, что свидетельствует об их отличии от штаммов 1-й группы и об отдельных источниках инфицирования для каждого выделителя K. pneumoniae из числа персонала роддома.
Таким образом, детальное фенотипическое и молекулярно-биологическое изучение штаммов K. pneumoniae, выделенных от младенцев и от персонала роддома, – важный этап в анализе полиэтиологичной ситуации, сложившейся в роддоме. Его результаты выявляют существенные различия между двумя группами штаммов, акцентируют внимание на преобладающем и агрессивном патогене, выделенном от новорожденных, а также свидетельствуют о самостоятельных эпидемических процессах клебсиеллезной инфекции, сформировавшихся в больничной среде роддома среди новорожденных и носителей из числа персонала.
В табл. 2 представлена более детальная характеристика случаев клебсиеллезной инфекции, развившейся среди новорожденных.
При установлении причинно-следственных связей по формированию очага инфекционных заболеваний в роддоме были исследованы смывы, взятые в родильном отделении на условно-патогенную флору; пробы воздуха на бактериальную обсемененность; пробы на стерильность медицинских изделий, инструментария, лекарственных форм; пробы дезинфицирующих растворов для определения концентрации активного вещества и соответствия растворов заданной концентрации.
Среди негативных результатов этого блока исследований отмечены выделение условно-патогенных бактерий Enterobacter intermedium с детского матраца в палате интенсивной терапии отделения новорожденных № 1 и несоответствие заданной концентрации готового раствора «Бетадез» для дезинфекции палат детского отделения.
При проверке противоэпидемического режима роддома были выявлены нарушения условий содержания и эксплуатации помещений детского отделения, родильного блока; факты несвоевременной изоляции новорожденных и родильниц с признаками инфекционных заболеваний; нарушения в части стирки и замены санитарной одежды сотрудников, генеральных уборок в детском отделении; использования уборочного инвентаря; применения растворов дезинфицирующих средств.
Обсуждение
В последние годы появилось большое количество научных публикаций, касающихся различных аспектов ИСМП. Несмотря на значительный теоретический материал, остаются проблемными многие вопросы этого раздела медицины, в частности, точность оценки результатов бактериологической и эпидемиологической диагностики, что может определять трактовку ситуации эпидемического неблагополучия в целом в каждом конкретном случае.
Стандартное определение «госпитального штамма» следующее: однородная по фено- и генотипическим признакам совокупность микроорганизмов, сформировавшаяся в госпитальной экосистеме и адаптированная к условиям больничной среды [17–19].
Циркулирующие в больничных стационарах УПБ подразделяются на 2 эковара: больничные и внебольничные. Больничные штаммы формируются из внебольничных. При определенных условиях штамм приобретает эпидемический потенциал. Скорость формирования больничных эковаров, длительность их циркуляции зависят от многих факторов. Эти характеристики различны для отдельных микроорганизмов. Так, по наблюдениям Н.И. Брико и соавт. [17], больничный вариант K. pneumoniae формируется в течение 67 дней с длительностью циркуляции 35 сут.
Основными источниками инфекции являются пациенты, объекты окружающей среды и медицинские работники. Именно пациенты (в данном случае роженицы) являются наиболее значимым источником инфекции. Благоприятными условиями для длительного сохранения и размножения УПБ являются влажные объекты, жидкости, диагностическое и лечебное оборудование. Потенциально опасны медицинские отходы. Медицинский персонал с высоким уровнем носительства УПБ в различных биотопах без признаков инфекции также несет определенную опасность в условиях стационара [20–23].
Оценивая в целом ситуацию, наблюдавшуюся в роддоме Хабаровска, можно заключить, что доказанный источник инфекции в данном очаге ИСМП не установлен, хотя возможным источником инфекции могла быть окружающая среда акушерского стационара. Подтверждением тому является факт обнаружения УПБ (Enterobacter spp.) в смывах с детского матраца в период расследования вспышки на фоне проведенных дезинфекционных и противоэпидемических мероприятий. Косвенным подтверждением является и обнаружение S. aureus в пробах воздуха акушерского стационара в предшествующий вспышке период. Не исключается персонал роддома в качестве потенциального источника инфекции, так как при его бактериологическом обследовании установлен высокий уровень носительства K. pneumoniae (8,5 ± 3,3% случаев) и S. aureus (18,3 ± 4,6% случаев). Эти показатели довольно высоки для здоровых контингентов населения и приближаются, по нашим наблюдениям, к уровню носоглоточного носительства этих патогенов у взрослых лиц с респираторной патологией (12,8 и 30% для K. pneumoniae и S. aureus соответственно). Обращает на себя внимание факт выявления у штаммов K. pneumoniae, выделенных от персонала, таких «критических» признаков, как «гипермукоидный фенотип», ассоциированный с агрессивным капсульным типом К1, а также наличие 3 генетических факторов, контролирующих различные проявления вирулентности, в том числе устойчивость к бактерицидному действию сыворотки крови. Такой высокий потенциал патогенности клебсиелл мог сформироваться в госпитальной среде акушерского стационара, и персонал постепенно колонизировался такими вариантами. Присоединение лекарственной устойчивости к этому клону может привести к формированию «суперпатогенов» [7].
В научной литературе имеется также информация о выявлении множественных факторов вирулентности у S. aureus, выделенных от здоровых носителей, но клинические признаки могут проявиться при инфицировании ими ослабленных контингентов, например, в больничной среде [23].
Таким образом, в анализируемой ситуации не доказана роль персонала как источника инфекции в роддоме, так как и сами сотрудники роддома могли оказаться пострадавшим звеном и резервуаром, в котором сохраняются штаммы с высоким патогенным потенциалом, поддерживая циркуляцию возбудителя в учреждении. Высокий уровень носительства у персонала сформировался в течение определенного времени именно в госпитальной среде, которая должна быть безопасной и для пациентов, и для персонала.
Оценка эпидемической обстановки в роддоме с позиций и принципов предэпидемической диагностики заболеваемости ГСИ предполагает выявлять предпосылки и предвестники осложнения ситуации. Такая оценка возможна только при непрерывном микробиологическом и эпидемиологическом мониторинге [24, 25].
Предпосылками осложнения эпидемической обстановки в нашем случае служат эндогенные (сопутствующая инфекция у рожениц) и экзогенные факторы (нарушения дезинфекционного и противоэпидемического режима, правил асептики и эксплуатации помещений) в акушерском стационаре.
Основные предвестники: при всей полиэтиологичности вспышки увеличилась доля одного патогена (K. pneumoniae) в структуре возбудителей ГСИ, в том числе у детей – возбудителя с выраженной лекарственной устойчивостью, а у персонала – с факторами вирулентности.
Непрерывный и качественный микробиологический мониторинг позволяет выявлять эти признаки до вспышки (как донозологические) и своевременно прекращать развитие эпидемического процесса [24].
Заключение
Установлено, что в роддоме Хабаровска в августе–сентябре 2017 г. имел место полиэтиологичный очаг ГСИ с множественными случаями заболеваний. Преобладающий возбудитель – K. pneumoniae – полирезистентный продуцент β-лактамаз расширенного спектра действия, относящийся к единому генотипу А (RAPD-типирование).
Особенностью вспышки явились отличия фенотипических и молекулярно-биологических свойств 2 групп штаммов K. pneumoniae, выделенных от новорожденных и персонала, что свидетельствовало о самостоятельных эпидемических процессах клебсиеллезной инфекции, сформировавшихся в больничной среде роддома среди новорожденных и носителей из числа персонала.
Источник инфекции не установлен. Механизмы распространения – аэрогенный и контактный. Вероятные факторы передачи – воздушная среда, предметы окружающей больничной среды, руки персонала в родильном и детском отделениях, контаминированные K. pneumoniae. Нарушения санитарно-эпидемиологических правил в роддоме, выявленные в ходе расследования вспышки ГСИ, могли способствовать формированию групповой заболеваемости.



