Активация иммунитета является одной из основных составляющих патогенеза ВИЧ-инфекции [1–3]. Выраженность системного воспаления и иммунной активации является важнейшим прогностическим индикатором прогрессирования заболевания [4–6].
Патологические изменения в кишечнике у больных ВИЧ-инфекцией являются пусковым механизмом для начала иммунной активации. Развитие интестинального дисбиоценоза, истощение CD4+-лимфоцитов в кишечнике и нарушение их функции приводит к повышению проницаемости слизистой оболочки для микробных продуктов и выходу липополисахарида (LPS) в кровь [7–9]. Повышение уровня LPS в крови является мощным предиктором прогрессирования ВИЧ-инфекции.
Степень микробной транслокации может быть оценена либо непосредственно через определение концентрации бактериальных продуктов в плазме, таких как LPS и бактериальные фрагменты нуклеиновых кислот, либо косвенно – по уровню sCD14 [10], липополисахарид-связывающего белка (LBP), EndoCAb и анифлагеллиновых антител [11–13].
У пациентов с ВИЧ-инфекцией установлены более высокие уровни sCD14, фактора некроза опухоли (ФНО-α), интерлейкина 6 (IL-6) и LPS вне зависимости от уровня репликации ВИЧ [14, 15].
Активность системного воспаления зависит от стадии ВИЧ-инфекции и эффективности АРТ. Вместе с тем у больных ВИЧ-инфекцией даже на фоне успешного приема АРТ со стойким подавлением вирусной репликации определяются более высокие уровни маркеров активации иммунной системы и системного воспаления по сравнению с контрольной группой лиц без ВИЧ-инфекции, причем эта остаточная иммунная активация связана с повышенной заболеваемостью оппортунистическими инфекциями и смертностью [16–19]. По данным ряда исследований [20–23], повышенные уровни интерлейкинов (IL-6, IL-10), а также высокочувствительного С-реактивного белка (hs-CRP) являются прогностическими факторами развития сердечно-сосудистых осложнений и онкологических заболеваний у больных ВИЧ-инфекцией.
Воздействие стойкой остаточной виремии ВИЧ на иммунную активацию, системное воспаление и микробную транслокацию в настоящее время неясны. Одна из гипотез заключается в том, что, несмотря на низкий уровень вирусной репликации, постоянное присутствие вируса может препятствовать нормализации воспалительных маркеров.
В связи с этим представляется перспективной оценка целесообразности использования маркеров системного воспаления у больных ВИЧ-инфекцией для оптимизации его мониторинга при этом заболевании.
Цель исследования – определение диагностической значимости маркеров системного воспаления у больных ВИЧ-инфекцией в зависимости от уровня вирусной репликации ВИЧ.
Материалы и методы
Для реализации поставленной цели исследованы 224 образца периферической крови больных ВИЧ-инфекцией, проходивших диспансерное обследование на базе Южного окружного центра по профилактике и борьбе со СПИДом ФБУН «Ростовский научно-исследовательский институт микробиологии и паразитологии» Роспотребнадзора за период с 2016 по 2018 гг.
В исследование были включены больные ВИЧ-инфекцией мужского и женского пола старше 18 лет на всех стадиях заболевания. Средний возраст больных составил 36,8 ± 0,6 года. Пациенты в течение последних 6 мес. не должны были употреблять наркотических веществ, у них отсутствовали острые соматические заболевания, исключена беременность.
У всех пациентов ВИЧ-инфекция была диагностирована на основании эпидемиологических и клинических данных и подтверждена обнаружением специфических антител к белкам ВИЧ-1 методами ИФА и иммунного блоттинга.
У большинства больных (48,3%) была диагностирована стадия вторичных заболеваний 4А (из них фаза прогрессирования – у 11,1%, фаза ремиссии на фоне АРТ – у 37,2%). Стадия 3 (субклиническая) была установлена у 31,7% пациентов, стадия 4Б – у 18,5%, 4В – у 1,5%. Больные ВИЧ-инфекцией, включенные в исследование, были распределены на 3 основные группы: в 1-ю вошли пациенты с неопределяемой виремией с пороговым значением < 50 копий/мл (n = 82), во 2-ю – пациенты с определяемым уровнем концентрации РНК ВИЧ в диапазоне 50–10 000 копий/мл (n = 68), в 3-ю – пациенты с уровнем концентрации РНК ВИЧ > 10 000 копий/мл (n = 74). Все пациенты получали АРТ, которая проводилась в соответствии с рекомендациями, принятыми в Российской Федерации. Продолжительность АРТ в среднем составила 9,0 ± 0,5 года (диапазон значений – от 1 мес. до 21 года). Основные медико-социальные характеристики участников исследования представлены в табл.1.
Все пациенты были информированы о целях и задачах работы, получено их согласие на проведение необходимых диагностических мероприятий. Исследование одобрено этическим комитетом ФБУН «Ростовский научно-исследовательский институт микробиологии и паразитологии» Роспотребнадзора.
Основные клинические, иммунологические и вирусологические исследования выполнены на базе клинико-диагностической лаборатории Южного окружного центра по профилактике и борьбе со СПИДом ФБУН «Ростовский научно-исследовательский институт микробиологии и паразитологии» Роспотребнадзора.
Исследование концентрации LBP проводили методом ИФА с использованием тест-системы Hbt Human LBP ELISA Kit, Product Number: HK315 (Hycult biotechnology, Голландия).
Для иммуноферментного определения концентрации ФНО-α, IL-1β, IL-6, IL-8, IL-10, ИНФ-γ, ИНФ-α, ПКТ использовали наборы «Альфа-ФНО-ИФА-БЕСТ», «Интерлейкин-1бета-ИФА-БЕСТ», «Интерлейкин-6-ИФА-БЕСТ», «Интерлейкин-8-ИФА-БЕСТ», «Интерлейкин-10-ИФА-БЕСТ»,,«Гамма-Интерферон-ИФА-БЕСТ», «Альфа-Интерферон-ИФА-БЕСТ», «Прокальцитонин-ИФА-БЕСТ» (ЗАО «Вектор-Бест», Новосибирск) согласно инструкциям фирмы-производителя.
Методом Real-time PCR на аппаратах Roche Taqman 48, Biorad CFX-96 и Real-time DT-Prime («ДНК-Технология», Москва) определяли вирусную нагрузку (ВН) ВИЧ (копий/мл) с использованием лицензированных отечественных тест-систем «Реал-Тайм ПЦР», произведенных лабораторией Центра молекулярной диагностики ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора; применяли также тест-системы Abbot Real Time HIV-1 (Abbott Laboratories, США).
Все полученные результаты подвергнуты статистической обработке с использованием программы SPSS Statistics Base 22.0. Проводили определение средних и медианных величин, ошибки средней, стандартного отклонения, достоверности различий, наличия и силы корреляции признаков. Количественные величины представляли как среднее (М) ± ошибка средней (m). Определение достоверности различий при сравнении двух групп из совокупностей с нормальным распределением проводили с помощью t-критерия Стьюдента для двух выборок. Величину уровня значимости p принимали равной 0,05, что соответствует критериям, принятым в медико-биологических исследованиях.
Результаты
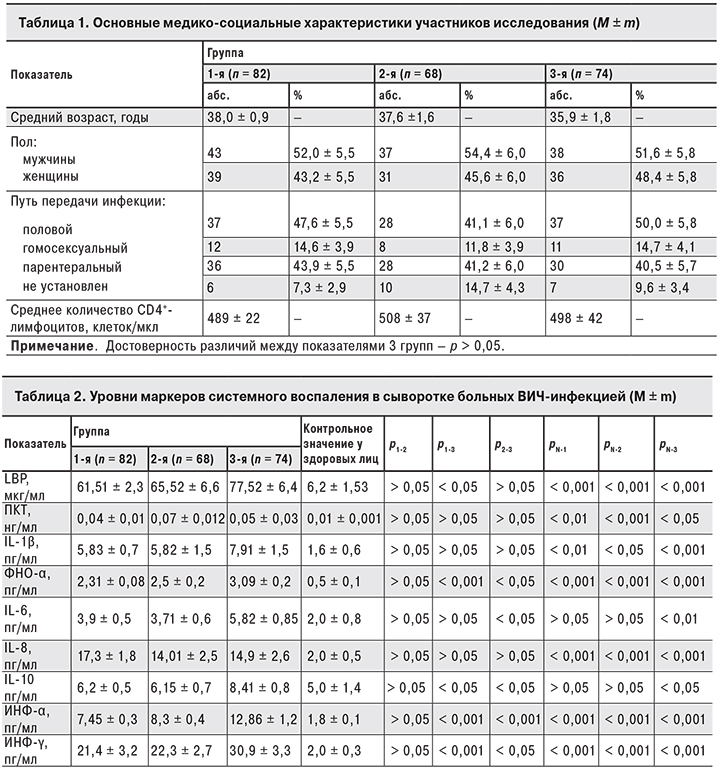
Согласно результатам проведенного исследования, у больных ВИЧ-инфекцией концентрация LBP определялась в диапазоне от 12,3 до 213,5 мкг/мл. Отмечена прямая зависимость между его концентрацией и уровнем ВН (рис. 1). У всех пациентов выявлено достоверное превышение среднего уровня LBP по сравнению со здоровыми лицами (6,2 ± 1,53 мкг/мл; p < 0,001) (табл. 2). В 3-й группе у больных уровень LBP был существенно выше, чем в 1-й: 77,52 ± 6,4 мкг/мл против 61,51 ± 2,3 мкг/мл (p < 0,05). Во 2-й и 3-й группах между уровнем ВН и содержанием LBP определялась корреляционная связь среднего уровня (r = 0,4).
Уровень IL-1β у 74,0% обследованных не превышал 11,0 пг/мл, указанный как верхний предел значений у здоровых людей; диапазон колебаний составил от 1,05 до 97,7 пг/мл. У пациентов всех 3 групп выявлено достоверное превышение среднего значения концентрации IL-1β по сравнению со здоровыми лицами: 5,83 ± 0,7, 5,82 ± 1,5 и 7,91± 1,5 пг/мл против 1,6 ± 0,6 пг/мл соответственно (pN-1 < 0,01, pN-2 < 0,05; pN-3 < 0,001).
ФНО-α – провоспалительный цитокин, по биологической активности близкий к IL-1β, определялся в диапазоне 0,8–6,2 пг/мл, при этом у 98,8% больных его показатель не превышал максимального значения нормы (6 пг/мл). У пациентов 3-й группы по сравнению с пациентами 1-й и 2-й групп средний уровень ФНО-α был существенно выше: 3,09 ± 0,2 пг/мл против 2,31 ± 0,08 и 2,5 ± 0,2 пг/мл соответственно (р1-3 < 0,001, p2-3 < 0,05). У пациентов всех 3 групп выявлено достоверное превышение среднего уровня ФНО-α по сравнению со здоровыми лицами (0,5 ± 0,1 пг/мл; p < 0,001).
Концентрация IL-6, регулирующего острофазный ответ, воспаление и другие механизмы иммунного ответа, в 80,2% образцов не превышала верхнего значения у здоровых, указанного в инструкции (0‒10 пг/мл; М = 2,0 пг/мл). Диапазон показателей концентрации IL-6 в трех группах – от 0,5 до 30,6 пг/мл. При этом выявлено достоверное превышение IL-6 в 3-й группе по сравнению со 2-й (5,82 ± 0,85 пг/мл против 3,71 ± 0,6 пг/мл; p2-3 < 0,05) и со здоровыми лицами (2,0 ± 0,8 пг/мл; pN-3 < 0,01).
Средний уровень концентрации IL-8 в трех группах варьировал в пределах 0,8–149,4 пг/мл. Показатели IL-8 превышали таковые у здоровых лиц (0–10 пг/мл) в 1-й группе у 22,3% пациентов, во 2-й – у 26,5%, в 3-й – у 47,1%. Между тем выявлены достоверные различия с нормой при сравнении средних уровней IL-8 во всех 3 группах: 2,0 ± 0,5 пг/мл против 17,3 ± 1,8, 14,01 ± 2,5 и 14,9 ± 2,6 пг/мл соответственно; p < 0,001).
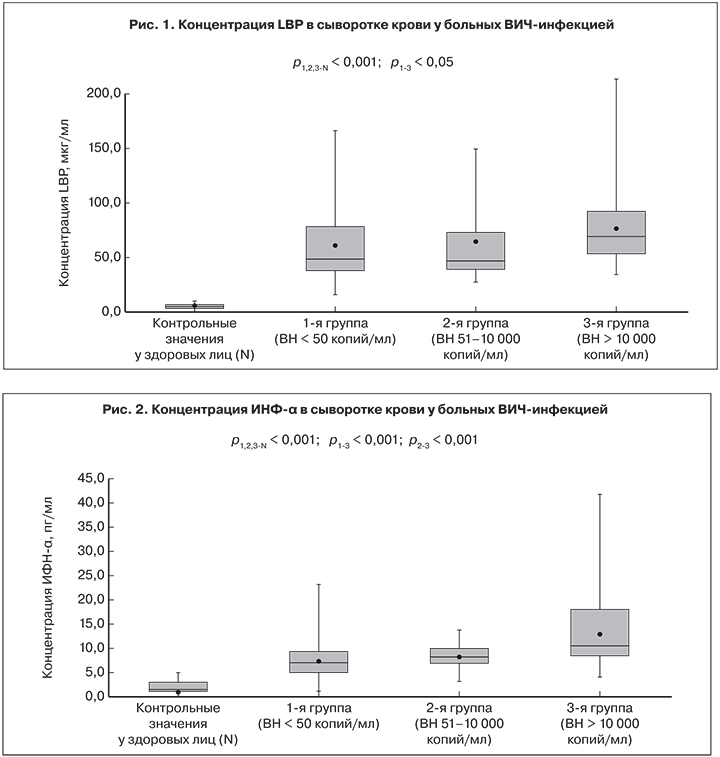
Содержание двух провоспалительных цитокинов – интерферона-альфа (ИНФ-α) и интерферона-гамма (ИНФ-γ) – играющих ключевую роль в противовирусной защите организма, оказалось значительно повышенным (> 5 и > 10 пг/мл соответственно) у ,большинства, пациентов всех групп. Концентрация ИНФ-α определялась в пределах 1,1–95,6 пг/мл. В 3-й группе по сравнению с 1-й и 2-й группами средний уровень ИНФ-α был существенно выше: 12,86 ± 1,2 пг/мг против 7,45 ± 0,3 и 8,3 ± 0,4 пг/мг соответственно (р1-3 и p2-3 < 0,001). Частота повышенных значений ИНФ-α (показателей, превышающих верхние значения у здоровых лиц) в 1-й группе составила 84,8 ± 4,0%, во 2-й – 88,2 ± 3,9%, в 3-й – 99,1 ± 1,1% (рис. 2).
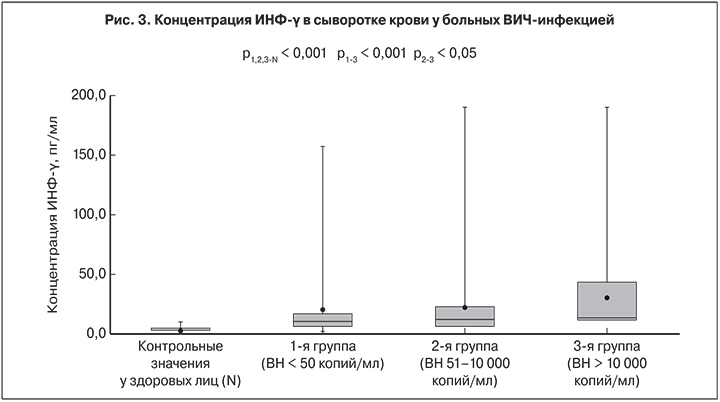
Продукция ИНФ-γ в исследуемых группах определялась в диапазоне от 1,8 до 380,0 пг/мл. Во 2-й и 3-й группах по сравнению с 1-й уровень ИНФ-γ был существенно выше: 22,3 ± 2,7 и 30,9 ± 3,3 пг/мл против 21,4 ± 3,2 пг/мл соответственно (р1-3< 0,001; р2-3 < 0,05). Превышение верхнего значения нормы ИНФ-γ (0‒10 пг/мл; М = 2 пг/мл) зафиксировано в 1-й группе у 50,9% пациентов, во 2-й – у 52,9%, в 3-й – у 85,3%. У больных ВИЧ-инфекцией выявлено достоверное превышение среднего уровня ИНФ-γ по сравнению со здоровыми (2,0 ± 0,3 пг/мл; p < 0,001) (рис. 3).
Уровень ПКТ у пациентов в исследуемых группах варьировали от 0,027 до 0,5 нг/мл, что в большинстве случаев соответствовало контрольным показателям у здоровых лиц (не выше 0,1 нг/мл). Только у 8,75% больных было зафиксировано превышение максимального значения показателя. Тем не менее при сравнении средних уровней ПКТ у ВИЧ-инфицированных пациентов всех 3 групп выявлено достоверное превышение концентраций по сравнению со здоровыми: 0,04 ± 0,01, 0,07 ± 0,012 и 0,05 ± 0,02 нг/мл против 0,01 ± 0,001 нг/мл соответственно (табл. 2)
Концентрация противовоспалительного цитокина IL-10 определялась в диапазоне от 3,4 до 25,9 пг/мл и не превышала верхней границы нормы (до 31 пг/мл). В 3-й группе средний уровень IL-10 был существенно выше, чем в 1-й и 2-й группах (8,41 ± 0,8 пг/мл против 6,2 ± 0,5 и 6,15 ± 0,7 пг/мл соответственно; р1-3 и p2-3 < 0,05) и по сравнению со здоровыми – 5,0 ± 1,4 пг/мл (pN-3 < 0,05).
Обсуждение
В последние годы роль хронической иммунной активации и воспаления в патогенезе ВИЧ становится все более очевидной [4, 7, 9, 18, 19]. Однако остаются невыясненными причины возникновения иммунной активации и не определены пути ее снижения. Полученные нами данные о значительно повышенной концентрации LBP у больных ВИЧ-инфекцией подтверждают, что у этих пациентов наблюдается усиленная продукция антиэндотоксиновых белков, приводящая к гиперактивации иммунной системы и формированию системного воспаления. Следует отметить, что, хотя у больных с подавленной вирусной репликацией на фоне АРТ регистрировали более низкие уровни LBP, чем у больныхв с виремией, у всех пациентов выявлено достоверное превышение уровня LBP по сравнению со здоровыми лицами. Определяемый нами методом ИФА количественный маркер антиэндотоксинового иммунитета LBP продемонстрировал зависимость активности антиэндотоксиновой защиты от степени вирусной репликации, о чем свидетельствует корреляционная связь средней силы между концентрацией РНК ВИЧ и содержанием LBP в крови в группах пациентов с определяемым уровнем виремии ВИЧ. Информативность LBP как показателя, отражающего активность системного воспаления, была показана и другими исследователями на примере хронических заболеваний кишечника, цирроза печени, хронического гепатита С. Принимая во внимание доступность метода ИФА, возможно использовать определение уровня LBP у больных ВИЧ-инфекцией для прогноза прогрессирования заболевания при проведении клинико-лабораторного мониторинга.
Содержание ИНФ-α и ИНФ-γ оказались значительно повышенными у большинства пациентов, что является неблагоприятным фактором для больных с тяжелыми стадиями ВИЧ-инфекции [24]. Более выраженным было повышение концентраций ИНФ-α и ИНФ-γ у пациентов с определяемым уровнем ВН ВИЧ. Уровни IL-1β, ФНО-α, IL-6, IL-8 и IL-10 были выше во 2-й и 3-й группах, но корреляционной связи между этими показателями и концентрацией РНК ВИЧ установлено не было. Тем не менее у пациентов 3-й группы средний уровень концентрации ФНО-α, IL-10, ИНФ-α и ИНФ-γ был достоверно выше, чем у больных 1-й группы. Таким образом, АРТ позволяет существенно снизить выраженность системного воспаления у больных ВИЧ-инфекцией, но даже на фоне эффективного лечения не происходит нормализации показателей цитокинового статуса. Даже при неопределяемом уровне РНК ВИЧ у больных сохраняется дисбаланс цитокиновой секреции, что проявляется более высоким, чем у здоровых содержанием в крови IL-1β, ФНО-α, IL-8, ИНФ-α и ИНФ-γ. Пациенты с более высоким уровнем маркеров системного воспаления, даже на фоне АРТ, подвергаются повышенному риску преждевременной смерти в связи с развитием печеночной, метаболической, почечной и сердечно-сосудистой патологии [4], и дальнейшее понимание их роли при ВИЧ-инфекции расширит наши знания о ее патогенезе и лечении.
Заключение
Таким образом, результаты нашего исследования доказали, что полное подавление вирусной репликации РНК ВИЧ связано с более низким уровнем LBP, ФНО-α, IL-10, ИНФ-α и ИНФ-γ. Это подтверждает важность поддержания ВН ВИЧ на неопределяемом уровне. Однако отсутствие нормализации маркеров микробной транслокации и системного воспаления у пациентов с устойчивой необнаруживаемой виремией на фоне АРТ доказывает, что необходимо дальнейшее изучение механизмов формирования иммунной активации с целью разработки дополнительных терапевтических подходов к коррекции антиэндотоксинового иммунитета и повышения эффективности лечения ВИЧ-инфекции.



