Холера – острая диарейная особо опасная инфекция, возбудителем которой является бактерия Vibrio cholerae, продолжает оставаться актуальной проблемой здравоохранения в странах Юго-Восточной Азии, Африки и Латинской Америки, где периодически возникают эпидемии и вспышки этого заболевания. В связи с увеличением миграции населения существует высокая вероятность завоза холеры на неэндемичные территории, включая Российскую Федерацию [1–3]. Возбудителем текущей, седьмой пандемии холеры является V. cholerae биовара Эль-Тор. За развитие основного клинического симптома при холере (водянистой диареи) ответственны гены ctxAB в составе профага СТХφ, кодирующие холерный токсин. Кластер генов tcpA-F, входящий в состав острова патогенности VPI-1, связан с биосинтезом токсин-корегулируемых пилей адгезии (ТСР), обеспечивающих колонизацию тонкого кишечника человека холерными вибрионами. Эти 2 фактора патогенности необходимы для развития инфекционного процесса при холере, поэтому штаммы, в геноме которых присутствуют гены ctxA и tcpA, являются эпидемически опасными. Кроме этого, такие штаммы в своем геноме имеют 2 острова пандемичности – VSP-I и VSP-II с генами, необходимыми для адаптации к стрессовым условиям окружающей среды [4, 5].
На территории Российской Федерации при мониторинге водной среды нередко выделяют нетоксигенные штаммы V. cholerae биовара Эль-Тор, не имеющие в своем геноме основных детерминант патогенности (ctxAB−tcpA–). Но время от времени из водной среды, а также от людей выделяются нетоксигенные штаммы холерных вибрионов с неполным набором генов патогенности. Особое значение имеют штаммы, сохранившие в своем геноме гены ТСР (tcpA)1 [6]. Такие штаммы сохраняют способность колонизировать кишечник, что может обусловливать появление вибриононосителей, а также за счет фаговой конверсии способствовать возникновению токсигенной популяции [7, 8]. В связи с этим штаммы холерных вибрионов с генотипом ctxAB−tcpA+ некоторые авторы считают потенциально опасными [9–11]. Впервые об изолятах V. cholerae с генотипом ctxA–tcpA+ сообщили S.M. Faruque и соавт. в 1998 г. [12]. Считалось, что все они представляют потенциальную эпидемическую опасность, так как пили TCP являются рецептором для фага CTXφ. Согласно гипотезе авторов, нетоксигенные штаммы холерных вибрионов с генотипом ctxA–tcpA+, находящиеся в объектах окружающей среды, при попадании в кишечник человека могут быть инфицированы CTXφ-фагом, образовывать токсигенные клоны и в дальнейшем приводить к эпидемическим вспышкам. Образование новых эпидемически опасных клонов определяется условиями как организма человека, так и окружающей среды. Однако в ряде публикаций было указано, что TCP-зависимая передача фага CTXφ между вибрионами происходит преимущественно в условиях in vivo, так как пили TCP V. cholerae биовара Эль-Тор в большей степени образуются в организме хозяина [8, 12, 13]. Для успешного формирования токсигенных клонов из нетоксигенных необходимо одновременное попадание в кишечник как нетоксигенных штаммов с генотипом ctxA–tcpA+, так и фага CTXφ. Такое развитие событий возможно на эндемичных по холере территориях, где открытые водоемы часто контаминируются токсигенными штаммами. На территории Российской Федерации, которая является неэндмичной территорией, в последнее время регистрировали только завозные случаи холеры, обусловленные токсигенными штаммами, а выделение токсигенных штаммов холерных вибрионов из объектов окружающей среды носило единичный характер. Поэтому вероятность одновременного попадания в организм человека нетоксигенных штаммов ctxA–tcpA+ и фага CTXφ в условиях нашей страны крайне низкая [7].
Ранее нами [14] была показана генетическая неоднородность нетоксигенных штаммов с генотипом ctxAB−tcpA+, которые разделялись на 2 группы. К первой группе были отнесены нетоксигенные штаммы, изолированные на эндемичных территориях и сохранившие в своем геноме гены пилей ТСР и острова пандемичности VSP-I и VSP-II. Эта группа оказалась наиболее близка к группе токсигенных штаммов. Поэтому при наличии пилей и соответствующих условий штаммы с генотипом ctxA−tcpA+VSP+ могут посредством фаговой конверсии приобрести профаг СТХφ с генами холерного токсина. В связи с этим данную группу штаммов можно назвать потенциально эпидемически опасной. Ко второй группе были отнесены нетоксигенные штаммы ctxA−tcpA+VSP−, у которых отсутствовали профаг СТХφ и острова пандемичности VSP-I и VSP-II. Общая протяженность отсутствующих участков генома составляет около 50 т.п.н. Такие штаммы не представляют эпидемической опасности вследствие того, что приобретение достаточно протяженных участков ДНК и формирование из них токсигенной популяции весьма маловероятно в природных условиях и экспериментально не доказано. Различие между двумя группами нетоксигенных штаммов имеет принципиальное значение для оценки их эпидемической значимости в ходе мониторинга объектов окружающей среды.
В настоящий момент для индикации и идентификации штаммов холерных вибрионов разработаны способы2-5 и тест-системы для определения серогрупп, биовара, токсигенности (вирулентности), измененных штаммов возбудителя и эпидемического потенциала [15, 16]. Недостатком существующих способов является невозможность одновременно выявлять штаммы с разной эпидемической значимостью, так как все предыдущие изобретения предназначены для идентификации и дифференциации по эпидемическому потенциалу только токсигенных штаммов холерных вибрионов.
В связи с этим существует очевидная потребность в разработке быстрого и информативного способа одновременной идентификации токсигенных эпидемически опасных штаммов V. cholerae биовара Эль-Тор и дифференциации нетоксигенных штаммов на потенциально эпидемически опасные и эпидемически безопасные.
Материалы и методы
В работе использовали 167 штаммов V. cholerae биовара Эль-Тор, выделенных в разные годы из разных источников (объекты окружающей среды, человек) на территории Российской Федерации и стран ближнего зарубежья, 6 нетоксигенных штаммов V.cholerae non O1/O139, 5 штаммов бактерий близкородственных видов рода Vibrio и 3 штамма энтеробактерий, хранящихся в Государственной коллекции патогенных бактерий ФКУЗ РосНИПЧИ «Микроб». Штаммы культивировали с использованием бульона и агара LB (Luria-Bertani) (рН 7,6) (Sigma-Aldrich, США) при температуре 37 °С.
Подготовку проб осуществляли согласно МУ 1.3.2569-69 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I–IV групп патогенности». Выделение ДНК проводили методом нуклеосорбции коммерческим набором ChargeSwitch gDNA Mini Bacteria Kit (Invitrogen, США) согласно инструкции производителя. Выделенную ДНК хранили при температуре 4 °С.
Амплификацию ДНК проводили на программируемом амплификаторе Mastercycler GRADIENT (Eppendorf, Германия). Детекцию продуктов амплификации после ПЦР проводили в 1,5% агарозном геле (Helicon, Россия) в однократном буфере трис-борат-ЭДТА (Thermo Scientific, Литва) с добавлением бромистого этидия (Amresco, США). Визуализацию продуктов амплификации осуществляли с помощью гель-документирующей системы VersaDoc (Bio Rad, США) и пакета программ QuantityOne v. 4.6.9 (Bio-Rad, США). В качестве контроля молекулярной массы использовали коммерческие маркеры GenеRulerTM 100 bp DNA Ladder (Thermo Scientific, Литва). В работе использовали праймеры, рассчитанные с помощью программ Integrated DNA Technologies (http://eu.idtdna.com/site) и OligoAnalyzer 1.0.2, а также из литературных источников5 (табл. 1) и синтезированные в НПО «Синтол» (Россия).

Результаты и обсуждение
На первом этапе работы были выбраны ДНК-мишени для определения токсигенности, пилей TCP, а также островов пандемичности. В качестве генетического маркера для определения токсигенности был использован фрагмент гена ctxA, кодирующий А-субъединицу холерного токсина и входящий в состав профага CTXφ [5], для определения наличия пилей – фрагмент гена tcpA, ответственный за биосинтез основной субъединицы токсин-корегулируемых пилей адгезии [12]. Для определения наличия в геноме штаммов островов пандемичности VSP-I и VSP-II в качестве мишеней были выбраны участки генов vc0180 и vc0514 соответственно. Выбор генов-мишеней был обусловлен тем, что данные гены присутствуют во всех типах VSP-I и VSP-II, а также в геноме токсигенных эпидемически опасных штаммов холерных вибрионов биовара Эль-Тор [3, 4].
Далее для каждой пары праймеров экспериментально была подобрана оптимальная концентрация для образования ПЦР-продукта и установлены соотношения концентрации праймеров в реакционных смесях. Для лучшего разделения амплифицированных фрагментов ДНК и легко интерпретируемых результатов мультиплексная ПЦР была разделена на 2 реакционные смеси. В первую смесь (№ 1) включены праймеры к генам vc0180 и vc0514 в концентрации 6 пмоль/мл каждого; во вторую (№ 2) – праймеры к генам ctxA и tcpA в концентрации 10 и 6 пмоль/мл соответственно. Подбор праймеров проводили с учетом минимизации вероятности их неспецифического отжига, а размер получаемых фрагментов был выбран для упрощения процесса визуализации и учета результатов (см. рисунок). Далее был подобран оптимальный состав реакционных смесей, включающий 10-кратный ПЦР-буфер (трис-HCl, рН 8,8), 2 мMdNTP, 25 мМ раствор MgCl2, Taq-полимераза (5 ед/мкл) (все компоненты производства НПО «Синтол», Россия), деионизованную воду (Thermo Scientific, Литва) и смесь праймеров № 1 или № 2. Объем реакционной смеси составлял 15 мкл из расчета на 1 реакцию. Также экспериментальным путем была подобрана оптимальная программа амплификации, которая включала 1 цикл при 95 °С в течение 5 мин; 32 цикла при 94 °С – 30 с, при 56,7 °С – 30 с; 1 цикл при 72 °С – 3 мин. Учет результатов мультиплексной ПЦР проводили методом горизонтального электрофореза в 1,5% агарозном геле путем сравнения полученных фрагментов с контрольными образцами. Результаты идентификации приведены в табл. 2.
При использовании нетоксигенных штаммов V. cholerae non O1/O139, штаммов энтеробактерий (E. coli, S. Еnteritidis, Sh. sonnei), а также близко родственных видов рода Vibrio (V. parahaemolyticus, V. alginolyticus, V. anguillarum, V. albensis, V. vulnificus) (табл. 3) была определена специфичность разработанной мультиплексной ПЦР, которая оставила 100%.
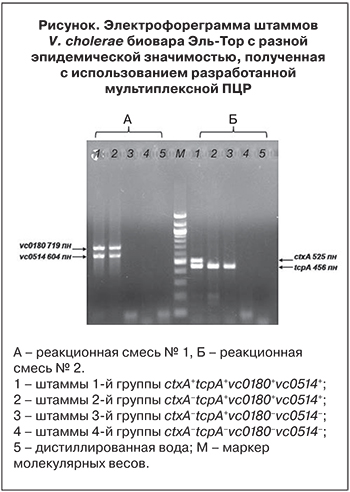 Эффективность разработанной мультиплексной ПЦР подтверждена исследованием 25 токсигенных и 142 нетоксигенных штаммов V. cholerae биовара Эль-Тор. Было установлено, что они разделяются на 4 группы по наличию или отсутствию идентифицируемых генов. К 1-й группе были отнесены 25 токсигенных штаммов, имеющих весь набор генетических маркеров эпидемически опасных штаммов. Как видно на электрофореграмме (см.рисунок, дорожка 1) в ходе реакции происходит образование 4 фрагментов размером 719, 604, 525 и 456 п.н., что соответствует генам vc0180, vc0514, ctxA и tcpA. Все штаммы из этой группы были выделены от больных холерой. Во 2-ю группу вошли 9 нетоксигенных штаммов. На рисунке (дорожка 2) показано, что у этой группы штаммов происходит образование 3 фрагментов, соответствующих по размерам генам vc0180, vc0514 и tcpA, поэтому генотип данной группы – ctxA–tcpA+VSP+. Эти штаммы являются спонтанными нетоксигенными мутантами, которые были получены из токсигенных. В ходе ранее проведенного SNP-анализа с привлечением полногеномных нуклеотидных последовательностей экспериментальных штаммов и штаммов, взятых из международной базы данных NCBI GenBank (https://www.ncbi.nlm.nih.gov/), было показано, что по составу генов патогенности и эпидемичности эти штаммы достаточно близки к токсигенным эпидемически опасным. Нетоксигенные штаммы ctxA–tcpA+VSP+ могут представлять потенциальную эпидемическую опасность. При сохранении генов токсин-корегулируемых пилей в ходе фагоконверсии такие штаммы могут приобрести профаг CTXφ с генами холерного токсина. Но стоит отметить, что практически все штаммы ctxA–tcpA+VSP+ были обнаружены только в эндемичных по холере странах. На территории Российской Федерации такие штаммы выявлены не были. Возможно, что они могут являться производными токсигенных штаммов ctxA+tcpA+VSP+, появившихся в результате изменений в геноме последних в водной среде, что было показано в экспериментах in vitro [17].
Эффективность разработанной мультиплексной ПЦР подтверждена исследованием 25 токсигенных и 142 нетоксигенных штаммов V. cholerae биовара Эль-Тор. Было установлено, что они разделяются на 4 группы по наличию или отсутствию идентифицируемых генов. К 1-й группе были отнесены 25 токсигенных штаммов, имеющих весь набор генетических маркеров эпидемически опасных штаммов. Как видно на электрофореграмме (см.рисунок, дорожка 1) в ходе реакции происходит образование 4 фрагментов размером 719, 604, 525 и 456 п.н., что соответствует генам vc0180, vc0514, ctxA и tcpA. Все штаммы из этой группы были выделены от больных холерой. Во 2-ю группу вошли 9 нетоксигенных штаммов. На рисунке (дорожка 2) показано, что у этой группы штаммов происходит образование 3 фрагментов, соответствующих по размерам генам vc0180, vc0514 и tcpA, поэтому генотип данной группы – ctxA–tcpA+VSP+. Эти штаммы являются спонтанными нетоксигенными мутантами, которые были получены из токсигенных. В ходе ранее проведенного SNP-анализа с привлечением полногеномных нуклеотидных последовательностей экспериментальных штаммов и штаммов, взятых из международной базы данных NCBI GenBank (https://www.ncbi.nlm.nih.gov/), было показано, что по составу генов патогенности и эпидемичности эти штаммы достаточно близки к токсигенным эпидемически опасным. Нетоксигенные штаммы ctxA–tcpA+VSP+ могут представлять потенциальную эпидемическую опасность. При сохранении генов токсин-корегулируемых пилей в ходе фагоконверсии такие штаммы могут приобрести профаг CTXφ с генами холерного токсина. Но стоит отметить, что практически все штаммы ctxA–tcpA+VSP+ были обнаружены только в эндемичных по холере странах. На территории Российской Федерации такие штаммы выявлены не были. Возможно, что они могут являться производными токсигенных штаммов ctxA+tcpA+VSP+, появившихся в результате изменений в геноме последних в водной среде, что было показано в экспериментах in vitro [17].
3-я (30 изолятов) и 4-я (103 изолят) группы состоят из нетоксигенных штаммов (ctxA−tcpA+VSP– и ctxA−tcpA−VSP–), которые, в отличие от нетоксигенных штаммов 2-й группы, являются эпидемически безопасными вследствие отсутствия в их геноме разных протяженных участков ДНК, необходимых для проявления вирулентных и эпидемических свойств возбудителя, приобретение которых в природных условиях невозможно. Для 3-й группы характерно образование только 1 фрагмента, соответствующего гену tcpA (см. рисунок, дорожка 3), а у штаммов 4-й группы не образуется ни одного фрагмента детектируемых генов из-за отсутствия таковых в геноме штаммов данной группы (см. рисунок, дорожка 4).
Заключение
Впервые сконструирована мультиплексная ПЦР, позволяющая дифференцировать штаммы V. cholerae биовара Эль-Тор на токсигенные эпидемически опасные, нетоксигенные потенциально эпидемически опасные и нетоксигенные эпидемически безопасные. Разработанная мультиплексная ПЦР специфична и эффективна. Она может быть использована при проведении эпидемиологических расследований, мониторинге объектов окружающей среды, а также для паспортизации штаммов холерных вибрионов.
* * *
На созданную мультиплексную ПЦР оформлена заявка на получение патента (приоритет № 2018100692 от 10.01.2018 г.).



