Проблема хронического гепатита В (ХГВ) остается актуальной в связи с высокой инфицированностью населения (в мире более 300 млн человек имеют маркеры ВГВ) и тяжестью исходов в виде цирроза печени и гепатоцеллюлярной карциномы1. Несмотря на широкий охват населения иммунизацией, вследствие чего заболеваемость ГВ в России за последние годы снизилась до 10,1 на 100 тыс. населения, новые случаи продолжают регистрироваться. Возможность полного излечения с эрадикацией вируса при ХГВ пока остается дискуссионной. Целью противовирусной терапии (ПВТ) является подавление репликации возбудителя, достижение фазы иммунного контроля и прекращение прогрессирования заболевания [1]. Наиболее благоприятным исходом лечения является устойчивый вирусологический ответ, сохраняющийся не менее 6 мес. после окончания лечения. Другим исходом, представляющим большую трудность в лечении ХГВ, является вирусологический рецидив [2]. Стандарт ПВТ в России включает следующие препараты: ламивудин, энтекавир, тенофовир [3]. В настоящее время нет четких критериев для применения определенной схемы лечения, а при использовании препаратов прямого противовирусного действия – аналогов нуклеозидов/нуклеотидов – нет общепринятого стандарта по срокам прекращения ПВТ1. Возможность прогнозирования исхода терапии до ее начала для определения тактики ведения больных ХГВ является весьма актуальной задачей.
Цель исследования – разработать способ прогнозирования исходов ПВТ энтекавиром у HBeAg-негативных больных ХГВ.
Материалы и методы
В Самарском областном гепатологическом центре на базе клиники инфекционных болезней ФГБОУ ВПО «Самарский государственный медицинский университет» Минздрава России была обследована группа первичных пациентов с НВeАg-негативным ХГВ (n = 154). Диагноз был поставлен на основании клинико-эпидемиологических, биохимических (параметры цитолиза, мезенхимального воспаления, холестаза), серологических, молекулярно-генетических данных. Качественное и количественное выявление ВГВ проводили методом ПЦР, используя набор реагентов «РеалБест ДНК ВГВ» (ЗАО «Вектор-Бест», Новосибирск) с чувствительностью 15 МЕ/мл. Функциональные пробы печени исследовали на анализаторе Cobas INTEGRA 400 plus (F. Hoffmann-La Roche, Швейцария). Содержание цитокинов в плазме определяли с помощью набора реагентов ЗАО «Вектор-Бест», основным компонентом которого являются моноклональные антитела к изучаемым интерлейкинам (IL) и интерферонам (IFN), сорбированные на поверхности лунок полистирольного планшета, или набором реагентов ProCon (Санкт-Петербург, Россия), для изучения состояния параметров IFN-α. Ультразвуковое исследование органов брюшной полости проводили на сканере E-CUBE 9 с использованием двух мультичастотных датчикой (конвексный 3,0–6,0 Мгц и линейный 6,0–11,0 Мгц). Применяли базовый серошкальный режим для оптимальной оценки структуры органов технологии Dynamic MRTM, позволяющей представлять базовое двухмерное изображение в реальном времени с оптимальной контрастностью, четкостью изображения, максимально улучшающей визуализацию контуров объектов и границы тканей с разной акустической плотностью с частотой от 2,5 до 5,0 МГц.
На основании результатов проведенных клинико-лабораторных и инструментальных исследований была создана база данных, которая включала, кроме гендерных, основные лабораторные показатели [уровень лейкоцитов, эритроцитов, тромбоцитов, билирубина, аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы, общего белка, альбуминов, цитокинов (сывороточных, спонтанных, индуцированных): IL-2, IFN-α, IFN-γ] и ультразвуковые параметры (косовертикальный размер правой доли печени; краниокаудальный размер левой доли печени; длина, толщина и площадь сечения селезенки; соотношение площади сечения печени и селезенки), а также уровень вирусной нагрузки, количество HBsAg и генотип ВГВ.
Пациентам была проведена противовирусная терапия (ПВТ) энтекавиром (0,5 мг) в течение 12 мес., после которой у 51 больного зарегистрирован устойчивый вирусологический ответ (УВО), у 103 – рецидив заболевания.
Полученные данные подвергали математико-статистической обработке, включавшей дескриптивное оценивание, дискриминантный анализ и анализ нормальности распределения, который осуществляли с использованием χ2-критерия согласия и критерия согласия Колмогорова–Смирнова.
Дискриминантный анализ проводили на основе групповых центроидов, используя пошаговый его алгоритм с исключением дискриминирующих переменных, в качестве которых использовали все регистрировавшиеся клинические, лабораторные и ультразвуковые показатели. Целью дискриминатного анализа было построение дискриминантной функции классификации, позволяющей по оптимальному набору дискриминирующих переменных отнести каждое новое наблюдение к одному из прогнозируемых исходов ПВТ: устойчивый вирусологический ответ или рецидив заболевания. В соответствии с указанным алгоритмом на первом этапе анализа все переменные были включены в дискриминантную модель, а затем на каждом шаге устранялись те из них, которые вносили малый вклад в задачу прогнозирования исхода ПВТ. В качестве определяющего фактора для включения или исключения переменных из модели использовали значения соответствующих F-статистик. Помимо F-статистик каждой из переменных на каждом шаге алгоритма оценивали такие показатели, как λ дискриминантной модели в целом, λ каждой из переменных дискриминантной модели, частные статистики λ каждой из переменных модели, F-статистики дискриминантной модели в целом и толерантность каждой переменной дискриминантной модели.
Статистическую обработку данных производили с использованием приложений Microsoft Excel пакета Office 2007 и Statistica (StatSoft) версии 7.0. При использовании критериев согласия различия считались значимыми при α < 0,05.
Результаты и обсуждение
Проведенный анализ показал, что наиболее адекватной в аспекте прогнозирования исхода ПВТ является дискриминантная модель вида:
DF = 5,3769х1 – 0,8186х2 – 0,4369х3, где
DF – значение дискриминантной функции;
х1 – сечение селезенки, мм;
х2 – концентрация IFN-α сывороточного, МЕ/мл;
х3 – концентрация IFN-α индуцированного, МЕ/мл.
Групповые центроиды модели составили 57,8 для группы пациентов с УВО и 477,7 для группы с рецидивом. Отсюда константа, разделяющая совокупности пациентов с УВО и рецидивом, равнялась 267,7.
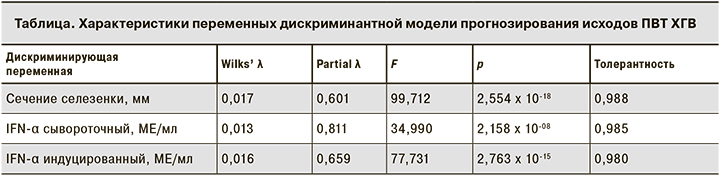
Построенная дискриминантная функция в целом являлась статистически значимой (λ = 0,011; F = 4711,0, p < 0,00001). Остальные оценки качества дискриминантной функции приведены в таблице.
Совокупности оценок разработанной дискриминантной функции приближенно подчинялись нормальному распределению в группах пациентов как с УВО (χ2 = 7,117, p = 0,130; D = 0,144, p > 0,05), так и с рецидивом (χ2 = 2,498, p = 0,869; D = 0,044, p > 0,05). Это позволило рассчитать вероятности ошибочного попадания прогнозных оценок из одной группы исходов ПВТ в другую. При этом оказалось, что значительная удаленность друг от друга центров распределений (∆χ = 419,9), а также выборочного максимума (xmax = 108,5) и минимума (xmin = 445,2) оценок дискриминантной функции в группах УВО (x = 57,7) и рецидива (x = 477,7) и небольшая дисперсия этих оценок (s = 30,3 в группе УВО и s = 13,3 в группе рецидивов) обеспечивают практическую безошибочность прогноза исходов ПВТ ХГВ. В частности, максимальная вероятность ошибки прогноза в случаях принятия оценками дискриминантной модели значений вблизи константы оказалась менее 10-26. По мере удаления возможных оценок от константы вероятность ошибочности прогноза стремилась к нулю, достигая значений порядка 10-300. Практическая безошибочность рассчитанной дискриминантной модели и простота позволяют рекомендовать ее для практического применения в клинической практике для прогнозирования исходов ПВТ ХГВ.
Практическое использование разработанной дискриминантной модели целесообразно показать на следующих клинических примерах.
Пример 1.
У пациентки М., 18 лет (код SA0120), с ХГВ определены следующие значения иммунологических показателей крови и эхографического показателя селезенки: сечение селезенки – 58 мм; концентрация IFN-α сывороточного – 84 МЕ/мл, IFN-α индуцированного – 308 МЕ/мл.
Значение дискриминантной функции для данных показателей равняется:
DF = 5,3769×58 – 0,8186×84 – 0,4369×308 = 108,5.
Поскольку полученное значение меньше константы (С = 267,7), у пациентки должен быть стойкий ответ после стандартной ПВТ. Истинный исход стандартной ПВТ у этой пациентки был представлен стойким ответом.
Пример 2.
У пациента А., 64 лет (код SA0179), с ХГВ определены следующие значения иммунологических показателей крови и эхографического показателя селезенки: сечение селезенки – 89 мм; концентрация IFN-α сывороточного – 2,9 МЕ/м, IFN-α индуцированного – 71 МЕ/мл.
Значение дискриминантной функции для данных показателей равняется:
DF = 5,3769×89 – 0,8186×2,9 – 0,4369×71 = 445,2.
Поскольку полученное значение больше константы (С = 267,7), у данного пациента следует ожидать рецидив после стандартной ПВТ. Истинным исходом стандартной ПВТ у этого пациента и стал рецидив ХГВ.
Заключение
Разработана дискриминантная модель, позволяющая до начала лечения у больных с HBeAg-негативным ХГВ прогнозировать исход ПВТ препаратом энтекавир с вероятностью ошибочного прогноза менее 10-26. Модель рекомендуется использовать в клинической практике при лечении этой категории больных.



