Экологическое неблагополучие страны, воздействие стресса, повышенный радиационный фон, неполноценность питания, массовое бесконтрольное применение антибиотиков и химиотерапевтических препаратов приводят к увеличению числа детей с нарушениями микробиоценоза кишечника, выявляемыми уже в раннем возрасте [1]. Сформировавшиеся нарушения микрофлоры кишечника у детей раннего возраста снижают иммунобиологическую реактивность организма, что способствует возникновению у них различных соматических и инфекционных заболеваний, в том числе острых кишечных инфекций [2]. У таких детей часто выделяются условно-патогенные энтеробактерии (УПЭ) (клебсиеллы, протеи, гемолизирующие и лактозонегативные кишечные палочки, патогенные стафилококки, синегнойные палочки) в монокультурах или ассоциациях в количествах, превышающих допустимые нормы. Продукты метаболизма этих микроорганизмов вызывают воспалительный процесс в кишечнике, аллергизацию организма детей, инициируют и поддерживают дисбиотические состояния [3, 4]. Бактерии родов Klebsiella, Escherichiae, Proteus, Pseudomonas, Staphylococcus относятся к разряду внутригоспитальных и являются причиной хирургических и кишечных инфекций, обладают высокой антибиотикорезистентностью [5, 6]. Одним из свойств УПЭ является быстрая выработка устойчивости к антибиотикам уже на этапе первой линии антимикробной терапии, что затрудняет лечение и профилактику этих нарушений. В связи с растущей резистентностью микроорганизмов к антибиотикам и возникающими на этом фоне проблемами при подборе антибактериальных препаратов в качестве альтернативных средств антимикробной терапии хорошие перспективы приобретают бактериофаги [7, 8]. Они оказывают специфическое направленное действие, не угнетают нормальную микрофлору, не вызывают аллергических реакций, опосредованно стимулируют факторы специфического и неспецифического иммунитета [9, 10]. Отсутствие побочных патологических реакций на применение препаратов бактериофагов позволяет эффективно использовать их у новорожденных и детей первого года жизни [11]. Эффективное этиотропное лечение и профилактика дисбиотических нарушений микрофлоры кишечника, обусловленных условно-патогенными микроорганизмами, невозможны без учета эпидемиологических данных об их чувствительности к антибактериальным препаратам. Все это делает актуальным и целесообразным не только изучение микрофлоры толстого кишечника у детей раннего возраста из групп риска, но и постоянное слежение за изменением антибиотико- и фагорезистентности выделяемых УПЭ.
Цель исследования – характеристика особенностей качественного и количественного состава микрофлоры толстого кишечника у детей раннего возраста и изучение чувствительности выделенных от детей условно-патогенных микроорганизмов к отечественным препаратам бактериофагов.
Материалы и методы
В течение 2 лет изучали фекальную микрофлору толстого отдела кишечника у 870 детей в возрасте от нескольких недель до 3 лет, проживающих в Южном регионе с высокой техногенной нагрузкой (Ростов и Ростовская область), родители которых обращались в Ростовский НИИ микробиологии и паразитологии для проведения анализов фекальной микрофлоры на дисбактериоз. Обязательным условием включения детей в исследование было наличие письменного информированного согласия родителей на его проведение.
Все обследованные дети относились к группам риска по общей заболеваемости, в том числе острыми кишечными инфекциями. В группу вошли дети, родившиеся от матерей с различной патологией, с осложненной беременностью и родами, имеющие неврологическую патологию и проходившие курсы соответствующего лечения. В исследование были включены 568 детей в возрасте от нескольких недель до 1 года и 302 ребенка в возрасте от 1 года до 3 лет с клиническими проявлениям функциональных нарушений кишечника (нарушение характера стула: диарея, запор, неустойчивый стул). 28,5% детей с первых дней после рождения находились на искусственном вскармливании. Дети периодически получали препараты нормофлоры или молочные смеси, обогащенные бифидобактериями и лактобактериями. Микрофлору кишечника, выделение и идентификацию энтеробактерий проводили с применением классических бактериологических методов [12], результаты оценивали в соответствии с ОСТ 91500.11.0004-2003 «Протокол ведения больных. Дисбактериоз кишечника»1. В исследование были включены 650 штаммов условно-патогенных микроорганизмов, выделенных от детей, в количествах, превышающих допустимые нормы (4–9 lg КОЕ/г) и обладающих множественной антибиотикорезистентностью. В их числе 145 штаммов Staphylococcus aureus, 110 штаммов коагулазоотрицательных стафилококков (COS), 113 штаммов Klebsiella pneumoniae, 95 штаммов Proteus vulgaris и Proteus mirabilis, 107 штаммов E. coli (лактозонегативных и гемолитических), 80 штаммов Pseudomonas aeruginosa. Культуры были идентифицированы по типичным биохимическим признакам традиционными методами [13], а также с применением бактериологического анализатора Vitek-2 (bioMérieux SA, Франция) и масс-спектрометрических исследований MALDI-TOF на базе оборудования Bruker Daltonik Microflex MALDI Biotyper (Bruker, Германия). У всех штаммов определяли чувствительность к специфическим бактериофагам методом «стерильных пятен», результаты учитывали по четырехкрестовой схеме. Использовали соответствующие моно- и поливалентные бактериофаги производства НПО «Микроген» (Н. Новгород и Пермь) и «Иммуноген» (Уфа). Чувствительность энтеробактерий к фагам проводили одномоментно со всеми образцами моно- и поливалентных препаратов бактериофагов.
Статистическую обработку результатов осуществляли с помощью программы Microsoft Office Excel 2003. Описание количественных признаков выполнено с помощью среднего арифметического (М) и стандартной ошибки (m). Различия считали статистически значимыми при p < 0,05.
Результаты
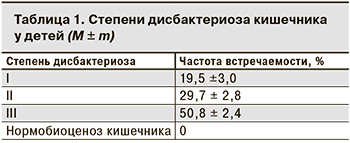 Была отмечена высокая распространенность кишечных дисбактериозов, особенно у детей первого года жизни (табл. 1).
Была отмечена высокая распространенность кишечных дисбактериозов, особенно у детей первого года жизни (табл. 1).
У всех обследованных детей выявлены бактериологические признаки дисбактериоза различной тяжести. Преобладали дети с дисбактериозом III степени и ниже, характеризующимся выделением большого количества условно-патогенных микроорганизмов на фоне дефицита нормальной микрофлоры.
Анализ результатов исследований показал, что практически у всех обследованных детей выявлены отклонения в составе микрофлоры кишечника относительно общефизиологических норм. Частота дисбиотических нарушений у детей, соответствующих II и III степени дисбактериоза, составила 80,5%. У 19,5% детей выявлен дисбактериоз I степени. Нарушения микробиоценоза кишечника характеризовались статистически значимым (p <0,05) снижением или отсутствием облигатной флоры, в основном бифидобактерий, в меньшей степени – лактобацилл и типичной кишечной палочки. Ни у одного ребенка количество бифидобактерий не достигало нормы (109–1011 КОЕ/г фекалий). В 89,5% случаев в количествах, равных 105–1010 КОЕ/г фекалий, обнаруживали условно-патогенные микроорганизмы как в монокультурах, так и в ассоциациях. На первом месте по частоте выделения были стафилококки и K. pneumoniae, затем следовали P. mirabilis и P. vulgaris, E. coli (гемолизирующие и лактозонегативные), P. aeruginosa, Citrobacter. Монокультуры чаще всего были представлены S. aureus, а микробные ассоциации – S. aureus + K. pneumoniae или P. mirabilis и грибами рода Candida. Ассоциации из 2–3 УПЭ определены в биоценозе у 26,5% детей, из 3–4 микроорганизмов – у 50,8% детей. Наиболее глубокие нарушения микрофлоры кишечника отмечены у детей, с первых дней жизни находящихся на искусственном вскармливании. II и III степени нарушений микрофлоры кишечника сопровождались клиническими проявлениями дисбактериоза.
Наряду с исследованием фекальной микрофлоры у детей изучена чувствительность 650 штаммов УПЭ к препаратам бактериофагов, выпускаемым в нашей стране (табл. 2).
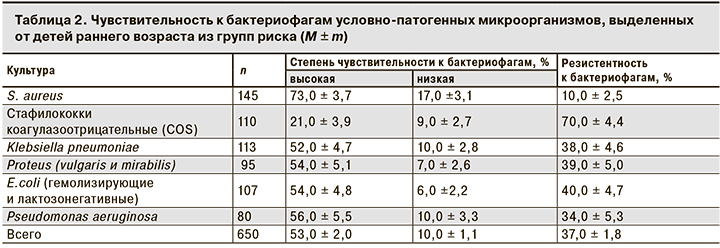
Анализ предварительного изучения чувствительности к антибиотикам выявил высокую степень антибиотикорезистентности у этих микроорганизмов. Наибольшую активность в отношении взятых на исследование культур проявляли карбапенемы (имипенем и меропенем), аминогликозиды (амикацин и гентамицин) и фторхинолоны (ципрофлоксацин и левофлоксацин) – от 81,3 до 61,0% высокочувствительных штаммов. Цефалоспорины и ингибиторзащищенные антибиотики были малоактивны или неактивны. К антибиотикам других групп культуры были резистентны. 12 штаммов Pseudomonas aeruginosa были мультирезистентными, то есть нечувствительными к антибиотикам всех классов.
Как видно из табл. 2, количество высокочувствительных штаммов бактерий семейств Enterobacteriaceae и P. aeruginosa колебалось от 52,0 + 4,7 до 56,0 + 5,5% и было практически одинаково для всех исследуемых энтеробактерий. Наибольшая чувствительность к бактериофагам выявлена у S. аureus (73,0 + 3,7%). У COS, напротив, отмечена самая высокая устойчивость к фагам (70,0 + 4,4%), и только 21,0 + 3,9% культур были высокочувствительными. Следует отметить, что чувствительность всех изученных микроорганизмов была практически одинакова как к моно-, так и к поливалентным препаратам бактериофагов. Достоверных различий не выявлено.
Обсуждение
Проведенная оценка результатов микробного пейзажа при дисбактериозе кишечника у детей раннего возраста основывалась на современных представлениях о физиологичных соотношениях разных видов нормальной микрофлоры. Степень тяжести дисбактериоза является интегративным показателем, который характеризуется нарушением нормальных соотношений основных популяций микроорганизмов кишечника [1]. В нашем исследовании преобладали дети с дисбактериозом II и III степени (29,7 и 50,8% соответственно). Анализ показал, что наиболее выраженные нарушения микробного пейзажа кишечника характерны для детей первого года жизни, у которых при низком содержании бифидобактерий в 2–3 раза чаще регистрировали колонизацию толстого кишечника стафилококками. При этом S. aureus в количественном отношении и по частоте встречаемости преобладал над COS. Также были выявлены высокое содержание дрожжеподобных грибов рода Candida у детей в возрасте от 1 года до 3 лет и более низкая частота встречаемости УПЭ и патогенных стафилококков. Отмечена зависимость между уровнем обсемененности УПЭ и S. aureus и количественным содержанием бифидобактерий и лактобактерий.
При проведении исследования нами был выявлена достаточно высокая доля фагорезистентных штаммов (37,0 ± 1,8%) и штаммов с низкой чувствительностью (10 ± 1,1%). Наиболее высокий уровень устойчивости зарегистрирован у COS – 70,0 + 4,4%.
При оценке фагорезистентности Staphlococcus spp. в целом установлена широкая распространенность устойчивости среди непатогенных стафилококков, в то время как S. aureus проявлял наиболее высокую чувствительность к бактериофагам. Нужно отметить, что среди COS доля устойчивых или низкочувствительных к фагам была в среднем в 2–3 раза больше, чем у S. aureus, и составила 79%. Тот факт, что устойчивость к фагам широко распространена у COS, является ожидаемым и объяснимым, так как лечебные препараты бактериофагов создавались с учетом литической активности в отношении прежде всего S. aureus. Изоляция устойчивых к фагам условно-патогенных микроорганизмов чаще всего регистрировалась в их микробных и грибково-микробных ассоциациях, что особенно характерно для клебсиелл, эшерихий и протеев, у которых из ассоциаций выделялось в 2–3 раза больше фагорезистентных культур (p < 0,05). Длительная циркуляция фагорезистентных штаммов в микробиоте, вероятно, инициирует и поддерживает продолжительность дисбиотических нарушений у детей.
Заключение
В результате исследования у всех детей раннего возраста, относящихся к группам риска, выявлены дисбиотические нарушения микрофлоры кишечника, в большинстве случаев II и III степени. Наиболее глубокие нарушения микробиоценоза отмечены у детей, находящихся на искусственном вскармливании с первых дней жизни. Установлено низкое содержание бифидобактерий и большой процент выделения УПЭ в ассоциациях. Выявлена значительная распространенность фагорезистентных штаммов у детей с дисбактериозом кишечника, что свидетельствует о необходимости предварительного определения их чувствительности к бактериофагам для решения вопроса о возможном включении последних в систему коррекции микрофлоры кишечника.
Полученные данные не являются стабильными и могут изменяться в зависимости от частоты использования антимикробных препаратов и изучаемого региона.



