С 2016 г. в связи с увеличением гетеросексуального пути распространения ВИЧ-инфекции отмечается тенденция к росту удельного числа женщин в структуре инфицированных ВИЧ. Согласно данным на 31 декабря 2020 г., их доля в Российской Федерации составила 37,4% [1–4]. В настоящее время 80% ВИЧ- инфицированных пациентов находятся в репродуктивном возрасте, каждая вторая женщина с ВИЧ-инфекцией заинтересована или не исключает наступления беременности в ближайшем будущем [5].
Рост случаев ВИЧ-инфекции среди женщин фертильного возраста сопровождается стабильно высоким числом родов в данной группе пациенток и ежегодным приростом числа детей с установленным диагнозом ВИЧ-инфекции, сохраняющимся несмотря на значительные успехи в профилактике перинатальной передачи ВИЧ. В 2019 г. в 28 субъектах РФ более 1% беременных были инфицированы ВИЧ, что свидетельствует о переходе этих регионов в генерализованную стадию, согласно классификации ВОЗ. За весь период наблюдения к концу 2020 г. в нашей стране ВИЧ- инфицированными матерями рождено 218 956 живых детей, у 11 724 из них была подтверждена ВИЧ- инфекция, а кумулятивная частота перинатальной передачи составила 5,4%. В 2020 г. в России ВИЧ- инфицированными женщинами рождено 13 186 детей, у 165 (1,3%) из них была подтверждена ВИЧ-инфекция [3]. Несмотря на то что за последние 12 лет частота перинатальной передачи ВИЧ в РФ снизилась почти в 7 раз и на протяжении последних 3 лет составляет менее 2%, что означает практическую элиминацию перинатального заражения, необходимо продолжить работу до полной его элиминации [6].
Если в настоящее время в РФ ВИЧ-инфицированными женщинами рождено более 218 000 детей, то в течение ближайших 3–5 лет, согласно прогнозу, их число может превысить 250 000. При этом сегодня у каждой 4-й ВИЧ-инфицированной матери наблюдается выраженная иммуносупрессия. Ежегодно увеличивается средний возраст ВИЧ-инфицированных беременных и длительность инфицирования, что закономерно сопровождается ростом соматической и акушерской патологии у данной группы, материнской и младенческой смертности [6]. Таким образом, вопросы перинатальной профилактики ВИЧ, поддержка ВИЧ- инфицированных женщин не только в течение беременности, но и на этапе ее планирования являются крайне актуальными. До настоящего времени известно 3 основных этапа перинатальной профилактики ВИЧ: при беременности, в родах и новорожденным. Согласно современным национальным клиническим рекомендациям [7], критерием начала антиретровирусной терапии (АРТ) у беременных является лабораторное подтверждение инфицирования ВИЧ. При лабораторном подтверждении инфицирования ВИЧ у беременных не рекомендуется откладывать начало АРТ до получения всех уточняющих результатов обследования, особенно при выявлении инфицирования на поздних сроках гестации, для предотвращения вертикальной передачи ВИЧ. При этом уточняется, что АРТ может быть отложена до окончания I триместра беременности при отсутствии показаний для быстрого начала АРТ (уровень вирусной нагрузки – ВН) в крови > 100 000 копий/мл и/или количество CD4+-лимфоцитов < 350 клеток/мкл), учитывая низкую частоту передачи ВИЧ от матери плоду на сроке гестации до 13 нед., а также во избежание потенциально возможного воздействия антиретровирусных препаратов (АРВП) на плод. Несмотря на низкую частоту интранатальной передачи ВИЧ в I триместре беременности, описаны случаи выделения ВИЧ-1 от абортированных плодов на 8-й неделе гестации [8]. Также установлено, что наиболее значимым фактором, влияющим на вероятность передачи ВИЧ-инфекции от матери плоду и ребенку, является уровень ВН во время беременности и родов [8–12].
В Санкт-Петербургском Центре СПИД был проведен анализ причин перинатальной передачи ВИЧ, в ходе которого оценивали влияние различных факторов путем сравнения женщин, у которых произошла перинатальная передача ВИЧ (1-я группа, n = 27) и родивших здоровых детей (2-я группа, n = 276). Беременные 1-й группы имели достоверно более высокие показатели ВН как исходно при беременности, так и перед родами по сравнению с пациентками 2-й группы (р < 0,001). При этом во 2-й группе АРТ до наступления беременности получали 65% женщин, а в 1-й – только 3,9% (рис. 1). Во 2-й группе женщины, начавшие АРТ до беременности, проявили низкую приверженность, у них подавить ВН не удалось. Таким образом, согласно результатам многофакторного анализа, одним из ведущих факторов риска перинатальной передачи ВИЧ является отсутствие эффективной АРТ у матери до наступления беременности (ОР = 46,38)1.
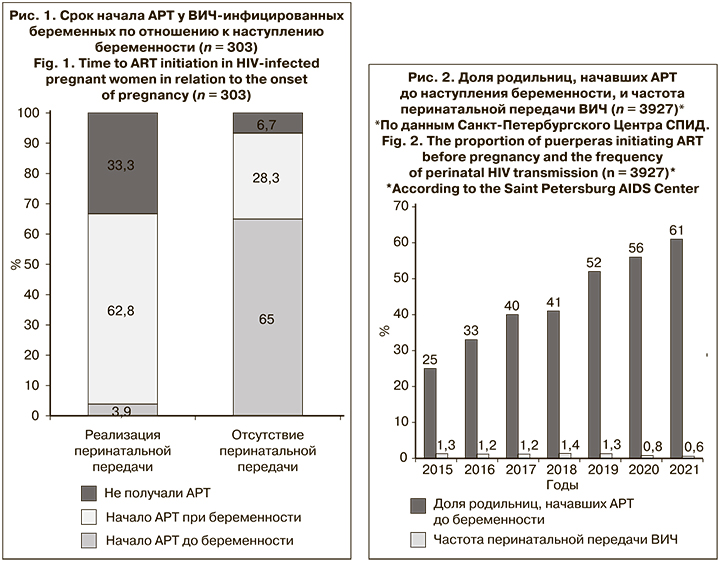
Очевидно, что начало АРТ и достижение неопределяемого уровня ВН в крови женщины до наступления беременности являются наиболее эффективным методом предотвращения передачи ВИЧ от матери ребенку и должно входить в программу прегравидарной подготовки – комплекса диагностических, профилактических и лечебных мероприятий по подготовке организма к полноценному зачатию, вынашиванию и рождению здорового ребенка. Соматические заболевания будущей матери значительно повышают гестационные риски, параллельно снижая вероятность своевременного рождения здорового ребенка, вследствие чего до наступления беременности необходимо добиться ремиссии и организовать поддерживающую терапию. Для ВИЧ-инфицированных пациенток это означает обязательное планирование беременности с учетом достижения ремиссии заболевания на фоне эффективного лечения АРВП с достижением неопределяемого уровня ВН крови будущей матери и нормальных показателей иммунного статуса, коррекцию иммунодефицита, если он был.
В международных и национальных рекомендациях отмечена важность продолжения АРТ у женщин, планирующих беременность или тех, у кого беременность наступила на ее фоне. В Европейских протоколах (EACS – European AIDS Clinical Society) старт АРТ рекомендован на этапе планирования беременности вне зависимости от уровня РНК ВИЧ и количества СD4+-лимфоцитов [13].
Схему лечения можно продолжить при наступлении беременности, если она эффективна и препараты, входящие в нее не имеют противопоказаний для применения во время беременности [13, 14]. Если в схему лечения входят препараты, потенциально обладающие эмбриотоксическим, тератогенным эффектами или недостаточно изученные для применения у беременных, женщине должно быть предложено заменить их на разрешенные для применения в данном случае [7, 13]. Выбор АРВП у женщин, планирующих беременность, и беременных осуществляется с учетом их эффективности, безопасности для матери и плода/ребенка, а также переносимости. В первую очередь необходимо учитывать тератогенный потенциал АРВП [12]. В ежегодном отчете Международного регистра антиретровирусных препаратов у беременных оцениваются и предоставляются данные по безопасности различных АРВП для плода, включая применение препарата в I триместре беременности. В настоящее время не получено данных о повышенной частоте врожденных аномалий у живорожденных детей, матери которых начали получать рекомендованные АРВП в I, II или III триместре беременности, по сравнению с популяционными показателями [15].
В результате анализа данных, полученных в Санкт-Петербургском Центре СПИД, установлена обратная зависимость между увеличением доли родильниц, начавших АРТ до наступления беременности (в 2021 г. – 477 (62%) и частотой перинатальной передачи ВИЧ (в 2021 г. – 0,6%).
Оптимальная схема АРТ для ВИЧ-инфицированной женщины, планирующей или не исключающей наступления беременности, должна соответствовать следующим характеристикам: минимальная токсичность, высокий порог резистентности, возможность продолжения при беременности и после родов, отсутствие побочных эффектов (снижение вероятности дифференциальной диагностики с токсикозом, гепатозом, анемией беременных), хорошее проникновение через плацентарный барьер, постоянство концентрации действующего вещества вне зависимости от увеличения объема циркулирующей крови во II и III триместрах, отсутствие риска преждевременных родов (фактор перинатальной передачи ВИЧ, патологические состояния, связанные с недоношенностью плода).
В настоящее время при назначении АРТ первого ряда (стартовой АРТ) рекомендуется использовать менее токсичные и наиболее удобные схемы лечения в виде комбинированных препаратов с фиксированными комбинациями доз (ФКД), что способствует уменьшению лекарственной нагрузки и, как следствие, – повышению приверженности АРТ [7]. Согласно действующим клиническим рекомендациям, единственным препаратом с ФКД, разрешенным для применения у женщин, не исключающих наступление беременности или в случае продолжения применения при наступлении беременности, является эвиплера (RPV/TDF/FTC) [7]. Применение препаратов, указанных в особых случаях, оправдано при следующих обстоятельствах: беременность или возможность наступления беременности, продолжение ранее начатой АРТ; наличие гепатита В, метаболические расстройства, пожилой возраст (применение ФКД RPV/TDF/FTC), пациенты с сердечно-сосудистыми заболеваниями, нарушением липидного и углеводного обмена. Использование лекарственных препаратов для АРТ при беременности ограничено инструкцией к медицинскому препарату, а также данными Международного регистра использования АРВП при беременности.
В РФ препарат RPV/TDF/FTC зарегистрирован для лечения инфекции, вызванной ВИЧ-) у взрослых пациентов и у детей в возрасте от 12 до 18 лет, имеющих показатели РНК ВИЧ-1 в пределах не более 100 00 копий/мл и не имеющих известных мутаций, связанных с резистентностью к ненуклеозидным ингибиторам обратной транскриптазы, тенофовиру или эмтрицитабину2. В инструкции к препарату эвиплера указано, что его применение во время беременности может быть рассмотрено, если это необходимо. При применении во время беременности была отмечена хорошая переносимость препарата в сочетании с устойчивым вирусологическим ответом. В соответствии с данными промежуточного отчета Международного регистра применения антиретровирусных препаратов при беременности частота возникновения врожденных дефектов при применении отдельных компонентов RPV/TDF/FTC не превышает частоты возникновения врожденных дефектов в популяции (4,17%; 95% ДИ 4,15–4,19): RPV – 1,44% (95% ДИ 0,62–0,81), TDF – 2,41% (95% ДИ – 1,98 – 2,90), FTC – 2,63% (95% ДИ 2,15–3,18) [15].
Данные о применении RPV/TDF/FTC при беременности в отечественной и зарубежной литературе ограничены, в связи с чем в рамках ретроспективно-проспективного исследования изучены результаты применения препарата у беременных, наблюдавшихся в Санкт-Петербургском Центре СПИД, а также результаты обследования на ВИЧ-инфекцию детей, рожденных ВИЧ-инфицированными матерями, включенными в исследование.
Цель исследования – оценка эффективности и безопасности применения RPV/TDF/FTC при беременности, включая I триместр.
Материалы и методы
Проведено ретроспективно-проспективное наблюдательное исследование применения RPV/TDF/FTC у беременных. В исследование были включены 43 пациентки, у которых беременность завершилась родами в период с 2015 по 2021 г.
Критериями включения в исследование были:
- подтвержденная беременность, завершившаяся родами, у ВИЧ-инфицированной женщины на территории Санкт-Петербурга;
- диспансерное наблюдение в Санкт-Петербургском Центре СПИД в течение данной беременности;
- применение RPV/TDF/FTC в течение беременности, включая I триместр;
- диспансерное наблюдение, включающее осмотры педиатра отделения материнства и детства Центра СПИД и лабораторное обследование на ВИЧ-инфекцию в регламентированные сроки детей, рожденных матерями, включенными в исследование.
Для выполнения исследования применяли клинико-анамнестический и лабораторные методы исследования.
Клинико-анамнестический метод. Анализ анамнестических данных проводили на основании информации, полученной из медицинских карт ВИЧ-инфицированных беременных и рожденных ими детей, статистической учетной формы МЗ РФ 309-у «Извещение о новорожденном, рожденном ВИЧ-инфицированной матерью», данных эпидемиологического расследования.
Собраны следующие данные:
- социально-демографический статус (возраст, употребление психоактивных веществ в анамнезе или в настоящее время, наличие или отсутствие наблюдения в медицинских учреждениях при беременности, приверженность к наблюдению и приему АРТ);
- репродуктивный анамнез (число беременностей в анамнезе и их исходы);
- эпидемиологический анамнез (путь инфицирования, наличие/отсутствие хронических гепатитов С и В);
- анамнез заболевания (длительность инфицирования ВИЧ, схема АРТ).
Лабораторное обследование ВИЧ-инфицированных беременных и рожденных ими детей включало качественное (ПЦР ДНК ВИЧ) и количественное (ПЦР РНК ВИЧ) вирусологическое исследование крови.
Иммунологическое обследование включало определение количественных показателей клеточного иммунитета – Т-хелперов/индукторов (абсолютного и относительного количества CD4+-лимфоцитов).
Статистическую обработку полученных данных осуществляли с помощью системы STATISTICA for Windows (версия 10) при уровне значимости p < 0,05.
Результаты и обсуждение
Средний возраст женщин в момент наступления беременности составил 34,9 ± 0,7 (18–42) года, что выше популяционных значений, а также среднего возраста ВИЧ-инфицированных беременных, состоявших на учете в Санкт-Петербургском Центре СПИД в период с 2014 по 2019 г. (31,9 ± 4,5 года; n = 2999) [5].
Большинство пациенток были социально адаптированы, у 74% заражение ВИЧ произошло половым путем, что сопоставимо с долей беременных с коинфекцией хроническим гепатитом С (ХГС) – 23%. Длительность инфицирования ВИЧ у пациенток представлена в табл. 1.
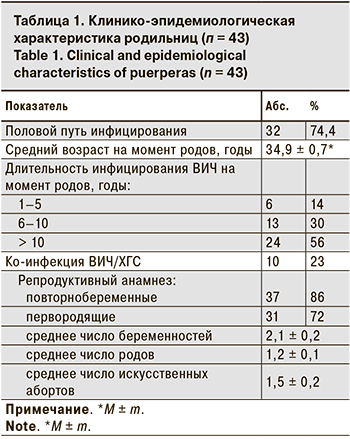
Более половины беременных имели стаж ВИЧ- инфекции более 10 лет, каждая 3-я – от 6 до 10 лет, что в сравнении с длительностью ВИЧ-инфекции у женщин, родивших детей в Санкт-Петербурге в 2014–2018 гг. (доля пациенток со «стажем» ВИЧ-инфекции более 10 лет в 2014 г. составляла 14,5%, в 2018 г. она выросла до 23,9%; n = 2999), достоверно больше (p < 0,001). Сочетание таких показателей, как значительная длительность ВИЧ- инфицирования у большинства женщин, высокий средний возраст у 2/3 первородящих говорит о том, что, скорее всего, первые роды были сознательно отложены в связи с необходимостью лечения ВИЧ-инфекции и до достижения уверенности в низком риске перинатального инфицирования ВИЧ. Возможно, переход на препараты с ФКД с низкой частотой побочных эффектов, удобством применения, а главное, достижением стабильной неопределяемой нагрузки ВИЧ в крови будущих мам мотивировал женщин на планирование беременности.
У 86% пациенток данная беременность была повторной, при этом роды более чем у 2/3 были первыми. Большинство женщин откладывали рождение ребенка, завершая предыдущие нежеланные беременности искусственным прерыванием. До недавнего времени стигматизация со стороны общества, медицинских работников и самостигматизация ВИЧ-инфицированных пациенток заставляла их делать выбор в пользу откладывания или прерывания беременности, особенно если диагноз впервые устанавливали во время постановки на диспансерный учет в женской консультации. В настоящее время ситуация изменилась в лучшую сторону за счет повышения образования населения, обучения до- и послетестовому консультированию врачей женских консультаций, организации эффективной медицинской и психологической помощи в центрах СПИД [16].
У 5 женщин беременность наступила с использованием вспомогательных репродуктивных технологий (ВРТ). Показанием для проведения ЭКО в 3 случаях явилось бесплодие по женскому фактору, в 2 случаях беременность наступила после применения процедуры интрацитоплазматической инъекции сперматозоида (ИКСИ) по сочетанным показаниям со стороны обоих партнеров. 3 из 5 пар были серодискордантными по ВИЧ-инфекции. Все 55 женщин в соответствии с клиническими рекомендациями по применению ВРТ у ВИЧ-инфицированных пациентов начали АРТ до начала программы ВРТ. При планировании ВРТ и/или искусственной инсеминации у ВИЧ-инфицированных пациентов следует учитывать условия, необходимые для проведения данных процедур, основной из которых является назначение АРТ, если они до настоящего времени ее не получали2,3. ВИЧ-инфицированным пациенткам перед ВРТ и во время стимуляции овуляции необходимо продолжать схему АРТ, назначенную при планировании беременности. При наступлении беременности АРТ следует продолжить в течение всей беременности, включая I триместр, до и после родов [17]. При проведении стимуляции овуляции ВИЧ- инфицированной женщине необходимо учитывать межлекарственные взаимодействия с препаратами, входящими в схему АРТ. В ходе подготовки к ЭКО или ИКСИ врач-инфекционист или акушер-гинеколог Центра СПИД в плановом порядке проводит коррекцию схемы АРТ пациентке с учетом планируемой беременности и предстоящей процедуры ВРТ [18]. Данная рекомендация была выполнена у 3 женщин, которые ранее получали схему АРТ, включающую ингибитор протеазы (ИП). Схема АРТ, в составе которой был ИП, согласно данным о межлекарственном взаимодействии (МЛВ), была заменена на RPV/TDF/FTC на этапе планирования процедуры ВРТ [13]. Игнорирование данных о МЛВ при планировании процедур ВРТ может снизить вероятность наступления беременности.
Длительность применения АРТ у женщин на момент наступления беременности в среднем составила 9,4 ± 0,9 года (2–13), при этом RPV/TDF/FTC они принимали в среднем 3,7 ± 0,7 года. У 72 беременных была стадия ВИЧ-инфекции 4А, у 16 – 4Б, у 5 пациенток – 4В.
Для подавляющего большинства женщин (n = 41, 95%) в группе исследования беременность была желанной (табл. 2), что сопоставимо с данными, полученными в общей группе ВИЧ-инфицированных родильниц, наблюдавшихся при беременности в Санкт-Петербургском Центре СПИД (95%), и значительно выше популяционных показателей [5]. Низкое число нежеланных беременностей связано с реализацией программы по планированию семьи среди ВИЧ- инфицированных женщин в Санкт-Петербурге. Она реализуется в Санкт-Петербургском Центре СПИД с 2007 г. при участии международного проекта по репродуктивному здоровью ВИЧ- инфицированных женщин, а с 2011 г. – в рамках территориальной программы, когда на основании фармакоэкономического обоснования начали закупаться современные средства контрацепции для предоставления ВИЧ- инфицированным пациентам, наблюдающимся в Центре СПИД [19].
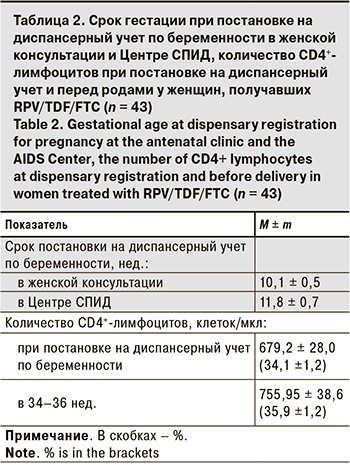
Пациентки, включенные в исследование, отличались высокой приверженностью наблюдению, что демонстрирует их своевременная постановка на диспансерный учет по беременности в женской консультации и у акушеров-гинекологов Центра СПИД. На фоне АРТ RPV/TDF/FTC, начатой до наступления беременности, в I триместре все женщины имели нормальные показатели количества CD4+-лимфоцитов (679,2 ± 28,0 клеток/мкл), перед родами на фоне АРТ они в среднем увеличились до 755,95 ± 38,6 клеток/мкл. Уровень РНК ВИЧ как при постановке на диспансерный учет в I триместре, так и в 34–36 нед. был ниже порога определения (< 40 копий/мл) у всех пациенток, что говорит о хорошей приверженности приему RPV/TDF/FTC на протяжении всей беременности.
На фоне АРТ при беременности ни у одной пациентки не было отмечено жалоб, связанных с приемом АРВП, побочных эффектов и нежелательных явлений, что можно объяснить началом получения данной схемы лечения ВИЧ-инфекции до наступления настоящей беременности. Такая практика является оптимальной и помогает проводить дифференциальную диагностику каких-либо состояний, связанных с беременностью (токсикоз первой половины беременности, анемия беременных, гепатоз беременных и др.) с побочными эффектами и нежелательными явлениями, связанными с АРТ. Тем не менее прием RPV/TDF/FTC может сопровождаться побочными эффектами со стороны разных органов и систем органов, которые подробно указаны в инструкции по применению препарата. Перед его назначением пациентки должны быть проконсультированы лечащим врачом о возможных побочных эффектах и необходимости срочного обращения к врачу при их появлении, особенно в период беременности.
Все женщины получили профилактику перинатальной передачи ВИЧ при беременности и в родах согласно клиническим рекомендациям [7].
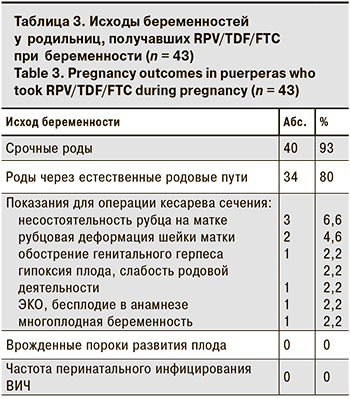
Средний срок гестации на момент родоразрешения составил 38,7 ± 0,3 нед., что соответствует доношенной беременности. Срочные роды произошли у 9 из 10 пациенток, что значительно выше, чем в группе ВИЧ- инфицированных родильниц (табл. 3). Согласно данным национальных исследований, частота преждевременных родов у ВИЧ-инфицированных женщин превышает популяционную в 4–5 раз и достигает в РФ 20% [20]. В ряде международных публикаций также подтверждается, что частота досрочного родоразрешения у пациенток с ВИЧ-инфекцией статистически значимо выше, чем в популяции, независимо от наличия или отсутствия АРТ при беременности [21, 22]. Наряду с другими причинами высокой частоты преждевременных родов у ВИЧ-инфицированных женщин (потребление психоактивных веществ, курение, ко-инфицирование ХГС и др.) установлена прямая корреляционная зависимость между длительным применением препаратов из группы ИП (SQV/r, LPV/r) с повышенной частотой досрочного родоразрешения, что объясняется снижением уровня ИЛ-10, противовоспалительного цитокина, продуцируемого моноцитами и макрофагами, играющего важную роль в пролонгировании беременности [23, 24].
В Санкт-Петербурге в 2021 г. роды наступили преждевременно у 14% женщин из числа родивших, что на 7% меньше по сравнению с 2020 г. Положительную динамику можно объяснить увеличением доли пациенток, у которых беременность наступила на фоне АРТ и неопределяемой ВН, а также подавленной ВН в III триместре беременности (97%). Дополнительным фактором снижения частоты преждевременных родов можно считать изменение соотношения схем АРТ у беременных за счет уменьшения доли схем с ИП и соответственно увеличением доли женщин, получивших при беременности АРТ, в состав которой входят ингибиторы интегразы (ИИ) и ненуклеозидный ингибитор обратной транскриптазы RPV в составе ФКД RPV/TDF/FTC. Учитывая, что преждевременные роды являются известным фактором риска перинатальной передачи ВИЧ [11, 16], снижение их частоты уменьшает риск перинатального заражения.
У большинства женщин беременность завершилась родами через естественные родовые пути (см. табл. 3). Операцией кесарева сечения по акушерским показаниям были родоразрешены 20% беременных. Показания для оперативного родоразрешения в плановом порядке представлены в табл. 3 и не связаны с ВИЧ-инфекцией.
Одними из показателей исхода беременности являются вес и рост новорожденного. Дети, рожденные ВИЧ- инфицированными матерями, включенными в исследование, имели нормальные средние показатели веса (3 363,3 ± 85,2 г) и роста (51,7 ± 0,5 см), соответствующие доношенному сроку беременности.
Ни у одного новорожденного не выявлено врожденного порока развития на фоне приема матерью в момент зачатия, в течение всей беременности, включая I триместр, АРТ с ФКД RPV/TDF/FTC.
Самым важным результатом применения АРТ беременными является рождение здорового ребенка, не инфицированного ВИЧ. Все новорожденные, рожденные матерями, включенными в исследование, были обследованы методом ПЦР на наличие ДНК/РНК ВИЧ в первые 48 ч жизни, затем в регламентированные сроки. Перинатальная передача ВИЧ не была реализована ни в одном случае.
На протяжении последних 3 лет уровень перинатальной передачи ВИЧ составляет менее 2%, что означает практическую ликвидацию вертикального инфицирования новорожденных в РФ [6]. По данным Центра СПИД, в Санкт-Петербурге частота перинатальной передачи в течение последних 2 лет составляет 0,6–0,8%. Безусловно, эти показатели определяются несколькими факторами: растущей долей женщин, начавших АРТ до наступления беременности (в 2018–2021 гг. – 41–61%); применением современных, высокоэффективных АРВП при беременности подавляющим большинством женщин; поддержанием неопределяемого уровня ВН ВИЧ в течение беременности и к моменту родов; снижением частоты преждевременных родов и безопасного родоразрешения.
После завершения беременности все пациентки продолжили наблюдение в Центре СПИД и прием АРТ (RPV/TDF/FTC) после родов.
Заключение
Применение АРТ с ФКД (RPV/TDF/FTC) до наступления беременности продемонстрировало высокую приверженность лечению и, как следствие, стойкое подавление ВН ВИЧ у всех пациенток, включенных в исследование. Неопределяемый уровень ВН сохранялся на протяжении всей беременности, что обеспечило отсутствие перинатального инфицирования ВИЧ в исследуемой группе. Безопасность применения RPV/TDF/FTC у беременных, в том числе в I триместре, подтверждена низкой долей преждевременных родов (в 3 раза меньше среднего показателя для популяции ВИЧ-инфицированных женщин в РФ) и нормальными показателями веса и роста новорожденных. Врожденные пороки развития не были выявлены ни у одного ребенка. Важной характеристикой применения ФКД является не только высокая приверженность пациенток лечению при беременности, но и продолжение приема препарата всеми матерями после родов. Таким образом, результаты исследования, проведенного в Санкт-Петербургском Центре СПИД, показали, что применение препарата эвиплера у беременных эффективно, безопасно и обеспечивает высокую приверженность лечению за счет низкой лекарственной нагрузки, удобства применения и отсутствия побочных эффектов.



