Грипп до сих пор является массовой сезонной быстро распространяемой инфекцией. По данным ВОЗ, ежегодно в мире гриппом болеют около 600 млн человек, из них 3–5 млн имеют среднетяжелое и тяжелое течение, и в 290 000–650 000 случаев инфекция завершается летальным исходом [1].
Наиболее тяжелые эпидемии вызывает вирус гриппа типа А. Хорошо известные пандемии, вызванные этим вирусом, произошли в 1918 (H1N1), 1957 (H2N2), 1968 (H3N2) и 2009 гг. (H1N1pdm09) [2]. Крайне редко и вирус гриппа типа В может доминировать в структуре циркулирующих штаммов. Кроме того, в мире циркулируют 2 эволюционные линии – В/Ямагата- и В/Виктория-подобные, не вызывающие перекрестного иммунитета. В последние время отмечена изменчивость штаммов В/Виктория-подобных. Вирусы гриппа типов С и D регистрируют крайне редко. С 2011 г. эпидемические подъемы заболеваемости определяют 4 вируса гриппа – A(H1N1)pdm09, A(H3N2), вирусы гриппа В/Ямагатской и В/Викторианской линий [3].
В последние годы сезонные подъемы заболеваемости гриппом чаще всего имеют умеренную интенсивность, при этом в сезоны доминирующей активности вируса гриппа A(H1N1)pdm09 регистрируют более высокие показатели госпитализации и смертности. При благоприятном течении заболевания репликация вируса ограничивается верхними отделами дыхательных путей. Но если вирусу удается проникнуть в нижние отделы, есть риск развития пневмонии и летального исхода. Причины, приводящие к тяжелому течению гриппа и летальности, до конца не установлены. Предполагается, что это результат неблагоприятного сочетания состояния организма человека, прежде всего иммунной системы, и особых свойств вируса [4, 5]. Есть данные, указывающие на значение аминокислотных замен в гемагглютинине в позициях 222 и 223, обеспечивающих усиление тропности таких вариантов вирусов к эпителиальным клеткам нижних отделов респираторного тракта [6].
По данным Европейского центра профилактики и контроля заболеваемости и российского Национального центра по гриппу, в сезоне 2018–2019 гг. грипп начали выявлять в нашей стране с 46-й недели 2018 г., пик заболеваемости наступил на 8-й неделе 2019 г. [7, 8]. До максимума заболеваемости чаще выявляли вирус гриппа А(H1), после нее – вирус гриппа А(H3). Доля вируса гриппа В была незначительной.
Целью данного исследования был анализ случаев среднетяжелого и тяжелого течения гриппа в одном клиническом центре в сезоне 2018–2019 гг., (последнем перед вспышкой новой короновирусной инфекции, вызванной вирусом SARS-CoV-2), и обобщение клинических проявлений, осложнений и катамнестических наблюдений.
Материалы и методы
Проанализированы данные 61 пациента (29 мужчин и 32 женщин) в возрасте от 18 до 95 лет, находившегося на стационарном лечении в Центральной клинической больнице с поликлиникой Управления делами Президента РФ. Большинство пациентов (71,7%) были в возрасте от 31 года до 65 лет, 10% – в возрасте 18–30 лет и 13% – 66–95 лет. Анализ данных пациентов был выполнен ретроспективно после их выписки и завершения амбулаторного наблюдения.
Детекцию РНК вирусов гриппа A(H1N1)pdm09, A(H3N2) и В проводили методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) с помощью тест-систем «АмплиСенс Influenza viruses A/B», «АмплиСенс Influenza virus A/H1-swine-FL», «АмплиСенс Influenza virus A-тип-FL» (ЦНИИЭ, Россия) согласно рекомендациям производителя. Обнаружение других респираторных вирусов (риновирусы, РС-вирус, аденовирусы, вирусы парагриппа, метапневмовирус, коронавирусы) выполняли, используя тест-систему «АмплисСенс ОРВИ-скрин-FL», (ЦНИИЭ, Россия) и протокол производителя.
 Для анализа аллельных вариантов полиморфных зон генов IFNL3 и IFNL4 выделяли ДНК из лейкоцитов крови, используя набор реагентов «Проба-рапид-генетика» («ДНК-технология», Россия). Определение генетических вариантов генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) выполняли методом ПЦР, используя сертифицированный набор реагентов «Иммуногенетика IL28B» и детектирующий амплификатор ДТлайт («ДНК-технология», Россия).
Для анализа аллельных вариантов полиморфных зон генов IFNL3 и IFNL4 выделяли ДНК из лейкоцитов крови, используя набор реагентов «Проба-рапид-генетика» («ДНК-технология», Россия). Определение генетических вариантов генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) выполняли методом ПЦР, используя сертифицированный набор реагентов «Иммуногенетика IL28B» и детектирующий амплификатор ДТлайт («ДНК-технология», Россия).
Для анализа достоверности различий между показателями применяли критерий χ2, корреляционную связь показателей рассчитывали методом Спирмена. Усредненные количественные величины представлены как М ± m. Использовали пакет программ Statistica 10 (StatSoft Inc., Тулса, США). Различия признавали статистически достоверными при р < 0,05.
Результаты
Анамнестические и клинико-лабораторные данные пациентов представлены в табл. 1.
У 8 больных (13,1%) были выявлены сопутствующие респираторные вирусные инфекции: аденовирусная, риновирусная, метапневмовирусная, респираторно-синцитиальная, микоплазменная. Только 6 (9,8%) человек были привиты от гриппа осенью 2018 г.
При госпитализации у 57,4% пациентов отмечали фебрильную лихорадку с повышением температуры тела до 39,1–40 ºС, у 31,1% – до 38,1–39 ºС, значительно реже (у 11,5%) – до 37–38 ºС. Основные жалобы пациентов представлены в табл. 2.
Чаще всего больные жаловались на слабость, цефалгию, озноб. Кашель был основным проявлением катарально-респираторного синдрома, с близкой частотой были обнаружены ринит, бронхит, дыхательная недостаточность и фарингит.
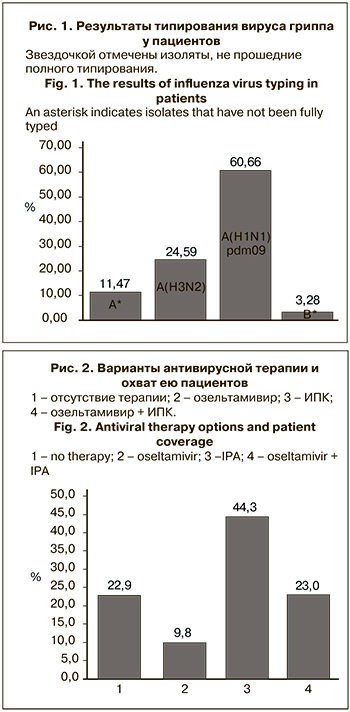
У пациентов доминировал грипп А, для которого характерно более тяжелое течение и более высокий риск развития осложнений. Данные о типировании вируса гриппа представлены на рис. 1.
Наиболее частые осложнения гриппа обусловлены присоединением вторичных бактериальных инфекций, приводящих к развитию пневмонии, синусита, отита, а также обострением хронических заболеваний, особенно со стороны бронхолегочной и сердечно-сосудистой систем [9, 10]. Среди осложнений доминировала внебольничная пневмония (54%), реже отмечали обострение хронических заболеваний (24%), острый обструктивный бронхит (14%) и острый тубоотит (8%).
Для терапии гриппа разрешены препараты, обладающие прямым противовирусным действием, такие как занамивир (ингибиторы нейроминидазы), арбидол (ингибитор слияния), триазавирин (аналог оснований пуриновых нуклеозидов), ремантадин (ингибитор белка М2, к которому in vitro отмечена высокая резистентность вируса), имидазолилэтанамид пентандиовой кислоты (ИПК), иммуномодуляторы и индукторы интерферонов: ИФН-α и -γ, тилорон, кагоцел, меглюмина акридонацетат и некоторые другие [9, 10].
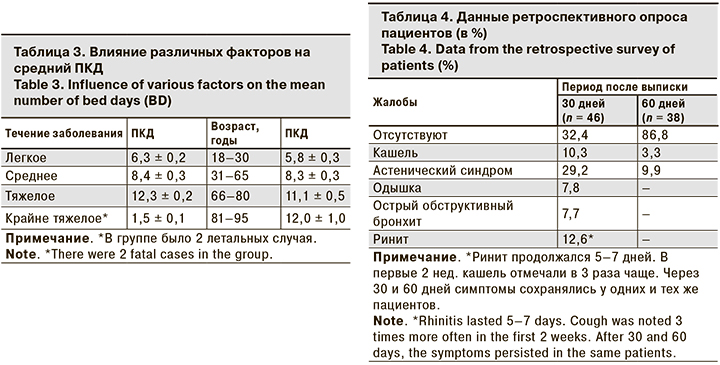
 В настоящем наблюдении не все пациенты получали противогриппозную терапию. Ее не назначали 22,9% пациентов, во-первых, из-за обнаружения бактериальной пневмонии, подтвержденной клинико-лабораторными исследованиями; во-вторых, из-за позднего лабораторного подтверждения гриппа (более 5 сут. от начала заболевания), связанного с отсутствием РНК вируса гриппа в мазках из носа и зева, но наличием его в мокроте. Большинство пациентов получали специфическую терапию (рис. 2).
В настоящем наблюдении не все пациенты получали противогриппозную терапию. Ее не назначали 22,9% пациентов, во-первых, из-за обнаружения бактериальной пневмонии, подтвержденной клинико-лабораторными исследованиями; во-вторых, из-за позднего лабораторного подтверждения гриппа (более 5 сут. от начала заболевания), связанного с отсутствием РНК вируса гриппа в мазках из носа и зева, но наличием его в мокроте. Большинство пациентов получали специфическую терапию (рис. 2).
Двойную терапию получали 23% пациентов. Критериями ее назначения были лихорадка выше 39,5 ºС, развитие пневмонии с первых суток заболевания или развитие острого обструктивного бронхита с первых суток.
Средний показатель койко-дней (ПКД) зависел от тяжести течения болезни, осложнений и возраста пациентов (табл. 3).
Коэффициент корреляции ПКД с тяжестью заболевания (без учета группы с крайне тяжелым течением) и возрастом составил 0,9. Различия в средних ПКД для групп 18–30 и 66–80 лет достоверны (р < 0,01). При наличии осложнений ПКД увеличился с 5,9 ± 0,3 до 9,9 ± 0,4 (р < 0,05).
В последнее время большое внимание вирусологов привлекает ИФН-λ3, который был открыт недавно и роль которого в ограничении вирусных инфекций интенсивно изучается [11]. Мы проанализировали генотипы пациентов по полиморфным локусам генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T). На рис. 3 представлены результаты сравнения групп больных гриппом с пневмонией и без нее.
Различия не достигли статистической достоверности, но у пациентов с пневмонией чаще выявляли генотип ТТ (rs12979860) в гене IFNL4 (старый термин «около гена IL28B»). Для аллельных пар ТТ, TG и GG (rs8099917) в гене IFNL3 ассоциации с развитием пневмонии или тенденции к ней не обнаружено (p > 0,05).
После выписки из стационара 47 пациентов были включены в ретроспективное наблюдение, результаты которого представлены в табл. 4.
У подавляющего большинства больных активность полностью восстановилась через 60 дней после выписки из стационара, но почти у 10% сохранялся астенический синдром.
Обсуждение
Основную группу инфицированных (71,7%) представляли больные в возрасте от 31 года до 65 лет (71,7%), что косвенно свидетельствует о связи заболеваемости с мобильностью этих пациентов и их более интенсивными контактами. Это предположение подтверждается обнаружением только в этой возрастной группе дополнительных вирусных респираторных инфекций. У пациентов старше 65 лет чаще наблюдались осложнения, 2 летальных случая зарегистрированы в группе старше 81 года. Среднетяжелое течение заболевания было выявлено у 9,8% пациентов, привитых от гриппа осенью 2018 г. Вероятно, поствакцинальный иммунитет у них был недостаточным, и/или они получили большую инфекционную дозу. Однако грипп протекал у них легче, чем у невакцинированных, и завершился без осложнений. Легче всего заболевание переносили пациенты до 30 лет, их пребывание в клинике в среднем составило около 6 дней, а для пациентов старше 65 лет – существенно больше (11–12 дней).
В подавляющем большинстве случаев грипп имел типичные клинические проявления: температура выше 38 ºС (87,5%), кашель (86,9%), слабость (59,15), ринит и дыхательная недостаточность (45,9%). Среди осложнений преобладала внебольничная пневмония. При наличии сопутствующей бронхолегочной патологии в 93% случаев регистрировали ее обострение, что влияло на длительность восстановительного периода после выписки. У 72,1% пациентов жалобы сохранялись в течение 30 дней после выписки из стационара, астенический синдром почти 10% пациентов отмечали в течение 2 мес. Эти данные свидетельствуют о более длительном восстановительном периоде после гриппа, чем принято считать.
 47 (77,1%) больных получали специфическую терапию в 2 вариантах: монотерапию (озельтамивир или ИПК) и комбинацию этих препаратов. Комбинация противовирусных препаратов не повысила эффективности лечения. Как установили Д.К. Львов и соавт. [8], подавляющее большинство изолятов вируса гриппа, циркулировавших в нашей стране в 2018–2019 гг., сохранили чувствительность к препаратам с антинейраминидазной активностью (озельтамивиру, занамивиру), но были резистентны к препаратам адамантанового ряда (ремантадину и амантадину).
47 (77,1%) больных получали специфическую терапию в 2 вариантах: монотерапию (озельтамивир или ИПК) и комбинацию этих препаратов. Комбинация противовирусных препаратов не повысила эффективности лечения. Как установили Д.К. Львов и соавт. [8], подавляющее большинство изолятов вируса гриппа, циркулировавших в нашей стране в 2018–2019 гг., сохранили чувствительность к препаратам с антинейраминидазной активностью (озельтамивиру, занамивиру), но были резистентны к препаратам адамантанового ряда (ремантадину и амантадину).
Этиологию эпидемических подъемов заболеваемости гриппом в нашей стране в сезон 2018–2019 гг. определяли вирусы гриппа A(H1N1)pdm09 и A(H3N2), в то же время, активность вируса гриппа В была повсеместно крайне низкой. В представленном исследовании у 97% участников был выявлен вирус гриппа А, из них у 61% – вирус A(H1N1)pdm09, а вирус гриппа В – всего у 3%. Таким образом, этиологическая структура в одном клиническом центре коррелировала с картиной, характерной для всей страны [8].
Нами обнаружена тенденция к более частому выявлению у пациентов с пневмонией аллельной пары ТТ rs12979860 в гене IFNL4. Генетические вариации (СС, СТ, ТТ) влияют на продукцию ИФН-λ3 – одного из ключевых компонентов врожденного иммунитета, участвующего в защите слизистых покровов человека от патогенов [11]. В 2019 г. иранские исследователи, изучая роль однонуклеотидного полиморфизма у ряда цитокинов, включая и ИФН-λ3, показали, что вариации T/G rs8099917 около гена IFNL3 не связаны с тяжестью течения гриппа [12]. Такие же данные получены и в нашем исследовании. Таким образом, только для одного однонуклеотидного полиморфизма (в гене IFNL4 генотип ТТ rs12979860) обнаружена тенденция к ассоциации с развитием пневмонии, что нуждается в более детальном изучении.
Заключение
В настоящем ретроспективном исследовании, включавшем больных гриппом одного клинического центра, показано, что большинство пациентов были инфицированы вирусом гриппа А с преобладанием штамма A(H1N1)pdm09. Заболевание протекало благоприятно у пациентов до 30 лет и у привитых лиц, независимо от возраста. У большинства пациентов грипп завершился без стойких осложнений, за исключением 2 случаев. Среди осложнений доминировала внебольничная пневмония. Комбинация противовирусных препаратов озельтамивира и ИПК не повышала эффективности лечения. У значительной части пациентов жалобы сохранялись в течение 30 дней после выписки из стационара. При наличии сопутствующей бронхолегочной патологии происходило ее обострение, что влияло на длительность восстановительного периода после выписки. Доля вакцинированных лиц среди госпитализированных больных была низкой. При анализе генетического полиморфизма в гене IFNL4, влияющего на продукцию ИФН-λ3, обнаружена тенденция к более частому выявлению у пациентов с пневмонией генотипа ТТ rs12979860.



