С момента выявления Helicobacter pylori интерес научного мира к этому микроорганизму постоянен. Обсуждается влияние H. pylori на развитие заболеваний не только желудочно-кишечного тракта, но и на течение сахарного диабета, сердечно-сосудистой патологии, аллергических дерматитов и т. д. [1–6]. Не исключено, что наличие инфекции H. pylori влияет и на развитие и течение заболеваний гепатобилиарной системы, особенно хронических вирусных гепатитов, циррозов печени, неалкогольного жирового гепатоза печени [7–9]. Однако влияние этой инфекции на функциональное состояние печени при острых вирусных гепатитах изучено недостаточно. В то же время, по данным ряда исследователей, установлена высокая частота одновременного присутствия антител к вирусу гепатита А (анти-HAV) и H. pylori среди населения [10–14]. При этом у больных острым гепатитом А (ОГА) недостаточно изучен риск развития патологических изменений слизистой оболочки гастродуоденальной зоны, не изучено влияние сопутствующего пилорического хеликобактериоза на функциональное состояние печени, не определена необходимость проведения эрадикационной терапии инфекции H. pylori в остром периоде ГА.
Цель исследования – определение влияния H. pylori на течение ОГА.
Задача исследования:
- оценить наличие и степень контаминации H. pylori среди больных ОГА;
- оценить влияние инфекции H. pylori на развитие эрозий и язвы гастродуоденальной зоны у больных ОГА;
- определить наличие или отсутствие взаимосвязи между инфицированностью H. pylori и функциональным состоянием печени в период разгара ОГА.
Материалы и методы
В исследование были включены 69 больных ОГА легкой и средней степени тяжести: 39 мужчин и 30 женщин в возрасте от 16 до 55 лет, средний возраст составлял 30,3 ± 10,8 года.
В исследование не включали пациентов с безжелтушными, инаппарантными и атипичными формами инфекций; с микст-гепатитами (ОГА в сочетании с другими гемоконтактными вирусными гепатитами, гепатитами невирусной этиологии, циррозами печени); беременных; ВИЧ-инфицированных; лиц, страдающих психическими заболеваниями; больных, имеющие на момент госпитализации тяжелые сопутствующие заболевания, сопровождающиеся полиорганной недостаточностью.
Всем пациентам с предварительным клиническим и эпидемиологическим диагнозом ОГА выполняли стандартное лабораторное исследование, включающее общие анализы крови и мочи, биохимический анализ крови с определением количества билирубина, ферментной активности АлАТ и АсАТ, уровня глюкозы и холестерина крови, протромбинового индекса; УЗИ органов брюшной полости; ЭКГ. Всем пациентам после подписания информированного согласия в 1-е сутки госпитализации (3–10-е сутки от начала заболевания) проводили фиброэзофагогастродуоденоскопию (ФЭГДС) по стандартной методике. При выявлении эрозивных и язвенных дефектов у больных через 7–10 дней проводили контрольную ФЭДГС. Во время проведения ФЭДГС осуществляли забор биологического материала по стандартной методике для обследования на наличие H. pylori с использованием тест-системы ХЕЛПИЛ® (ООО «АМА», Россия) и установления уровня контаминации при проведении цитоскопии. При изучении цитологических мазков-отпечатков слизистой оболочки антрального отдела желудка определяли наличие H. pylori в препаратах, его количество, а также форму бактерии: спиральную (активную) и кокковую (неактивную). Степень обсемененности в цитологических мазках-отпечатках оценивали на световом микроскопе «ЛОМО МИКМЕД-1» (ОАО «ЛОМО», Россия) при увеличении х 630. При наличии менее 20 микробных тел в поле зрения уровень контаминации оценивался как минимальный, в пределах от 20 до 50 микробных тел – как умеренный, при выявлении более 50 микробных тел – как выраженный [15]. Ряду пациентов проводили ПЦР- диагностику с определением генотипа H. pylori.
Расчеты проводили на портативном мультимедийном компьютере DELL 500 с использованием статистического раздела электронной таблицы Microsoft Office Excel 2007 for WindowsXP и программы Biostatistica. Для количественных параметров, имеющих нормальное распределение, рассчитывали среднюю арифметическую (М) и среднюю ошибку средней арифметической (m). Для сравнения средних значений использовали t- критерий Стьюдента, при работе с непараметрическими показателями – критерий χ2. Анализ малых выборок проводили с помощью точного критерия Фишера. Результаты считали статистически значимыми при р < 0,05.
Результаты
Проведение ФЭДГС у больных ОГА выявило наличие патологических изменений слизистой оболочки гастродуоденальной зоны (гастриты/гастродуодениты, острые эрозии и язвы). Эрозии и язвы встречались у 30 пациентов из 69, у остальных 39 отмечали неэрозивные гастриты и гастродуодениты. Данные ФЭДГС подтверждались морфологически (рис. 1 и 2, см. на вклейке).
Среди больных ОГА выявлен высокий уровень инфицированности H. pylori – 92,8% (64 пациента из 69). При этом H. pylori с одинаковой частотой выявляли как при наличии острой эрозивно-язвенной патологии слизистой оболочки гастродуоденальной зоны (27 пациентов из 30 – 90%), так и при неэрозивных гастритах и гастродуоденитах (37 пациентов из 39 – 94,9%). Таким образом, H. рylori-статус у больных ОГА не был ассоциирован со степенью поражения слизистой оболочки гастродуоденальной зоны. Полученные данные, однако, не исключают влияния H. рylori на характер патологических изменений слизистой оболочки верхних отделов желудочно-кишечного тракта, что в целом согласуется с представлениями о возможности различных вариантов клинических и эндоскопических (морфологических) проявлений пилорического хеликобактериоза [16, 17].
У 18 пациентов было проведено генотипирование H. pylori. В основном преобладала комбинация штаммов vacA s1 и s2 с другими штаммами. Такое сочетание было отмечено у 17 (94%) пациентов. Чаще всего аллельные типы vacA s1 и vacA s2 ассоциировались с генотипом сagA или vacA m2 .
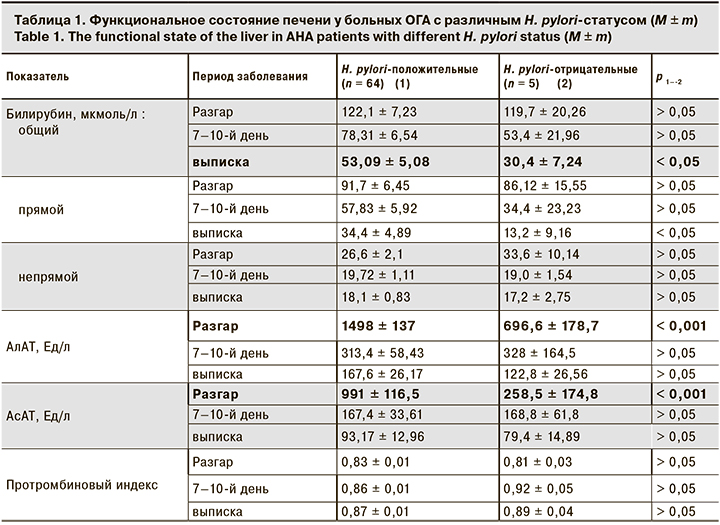
При исследовании влияния сопутствующего пилорического хеликобактериоза у больных ОГА на функциональное состояние печени на момент госпитализации были установлены более высокие уровни трансаминаз у H. pylori-положительных больных по сравнению с H. pylori-отрицательными. Выявленные различия исчезли к 7–10-му дню госпитализации и не определялись при выписке. В то же время показатели пигментного обмена (общий билирубин, прямой билирубин), не отличающиеся на момент госпитализации, у H. pylori-положительных пациентов при выписке были выше, чем у H. pylori-отрицательных» (табл.1).
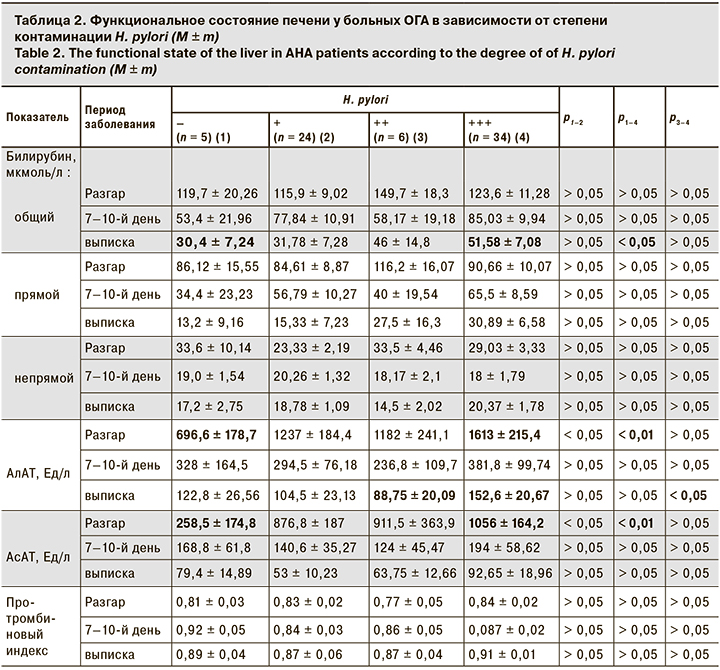
Анализ зависимости функционального состояния печени от степени контаминации H. pylori слизистой оболочки желудка показал, что у пациентов с контаминацией более 50 микробных тел в мазках-отпечатках биоптатов изменения были более выраженным, чем у пациентов с минимальной контаминацией (до 20 микробных тел в мазках-отпечатках биоптатов).
У больных с выраженной контаминацией H. pylori отмечены значимая разница в уровне повышения трансаминаз при поступлении и замедленное восстановление пигментного обмена при выписке (табл. 2).
Обсуждение
У больных ОГА H. pylori выявляли с одинаково высокой частотой как при эрозивно-язвенной патологии слизистой оболочки гастродуоденальной зоны, так и без нее. Не исключено, что у таких больных инфицирование H. pylori является дополнительным фактором тяжести гепатита, поскольку наличие инфекции H. pylori было ассоциировано со степенью цитолиза по АсАТ и АлАТ и замедленной нормализацией уровня билирубина. При этом наиболее значимые нарушения функционального состояния печени были типичны для пациентов с выраженной контаминацией H. pylori слизистой оболочки верхних отделов желудочно-кишечного тракта. Выявление высокопатогенного штамма H. pylori vac s1 у пациентов с ОГА может указывать на его возможную роль в развитии патологии слизистой оболочки гастродуоденальной зоны [18].
Полученные результаты, в том числе отсутствие четких данных о влиянии H. pylori на степень поражения слизистой оболочки гастродуоденальной зоны у больных ОГА, в целом согласуются с представлениями о возможности различных вариантов клинических и эндоскопических (морфологических) проявлений хеликобактериоза [15, 17]. Однако, мы считаем, что проведение эрадикационной терапии может быть отсрочено и выполняться амбулаторно.



