На сегодняшний день в научном и практическом аспекте весьма актуальным остается освещение вопросов, касающихся особенностей эпидемиологии, иммунологии, клинических проявлений и терапии гепатита С (ГС). Эпидемический процесс ГС в последние годы характеризуется увеличением частоты хронических форм, снижением возраста больных, ростом показателей смертности от цирроза печени и гепатоцеллюлярной карциномы [1–4]. Это связано с тем, что вирус гепатита С (ВГС) имеет ярко выраженную гетерогенность и характеризуется формированием огромного числа квазивирусов. Кроме того, известно, что именно ГС занимает доминирующее положение среди посттрансфузионных вирусных гепатитов, обладает наибольшим хрониогенным потенциалом и является одной из основных причин формирования всей группы хронических болезней печени [4–6]. Частота хронизации после перенесенного острого ГС может достигать 85% [7]. Такой высокий процент хронизации ГС заставляет исследователей задуматься об эффективных средствах борьбы с этой инфекцией. В настоящее время проводятся широкие дискуссии о правильном выборе препаратов, дозировании, длительности лечения, новых схемах, критериях оценки проведенной терапии [8]. Однако, несмотря на множество исследований, которые проводятся с целью правильного выбора лекарственных препаратов и схем лечения, эти вопросы остаются далекими от совершенства. По данным разных авторов, эффективность лечения у больных ХГС с ВГС генотипа 1 не превышает 46–51%, а у больных с ВГС других генотипов – 65–80% [9]. Известно, что на конечные результаты лечения влияет множество факторов как со стороны вируса, так и со стороны «хозяина»: наиболее важными прогностическими факторами вируса являются его генотип и исходная ВН, среди многочисленных факторов «хозяина» значительную роль играют иммунологические особенности больного [10]. Исследования системы иммунитета больных ХГС, его зависимости от результатов противовирусной терапии и, следовательно, от выраженности ФП в обнаруженных нами источниках литературы фрагментарны и неоднозначны. Между тем эти вопросы имеют большое теоретическое и практическое значение, так как позволяют глубже понять патогенез ХГС, а значит, выработать прогностические критерии ответа на лечение и совершенствовать существующие схемы терапии. Все вышеизложенное обусловило необходимость проведения данного исследования.
Цель исследования – выявление взаимосвязи иммунологических показателей с выраженностью ФП у больных ХГС.
Материалы и методы
На базе клинического отдела инфекционной патологии Центрального НИИ эпидемиологии Роспотребнадзора (далее – ЦНИИЭ) были обследованы 117 пациентов с подтвержденным диагнозом ХГС в возрасте от 18 до 80 лет, находящихся на диспансерном учете не менее 3 лет. Пациенты были отобраны с учетом отсутствия отягощающих анамнез состояний: сопутствующих заболеваний (ВИЧ-инфекция, туберкулез, метаболический синдром, сахарный диабет, ожирение 2-й степени и выше, неалкогольная жировая болезнь печени, бронхиальная астма, заболевания щитовидной железы, аутоиммунные и онкологические заболевания). Контрольная группа состояла из 30 здоровых лиц, не имевших на момент обследования жалоб и отклонений клинико-лабораторных показателей.
Всем пациентам, находящимся под наблюдением, проводили комплексное клинико-лабораторное и инструментальное обследования с обязательным проведением фиброэластометрии. Все больные были обследованы по единому плану: стандартное лабораторное обследование (общий и биохимический анализ крови.). РНК ВГС в сыворотке крови определяли методом ПЦР с использованием тест-системы «АмплиСенс HCV-Монитор», генотипирование ВГС проводили методом ПЦР с помощью коммерческой тест-системы «АмплиСенс HCV-генотип» (ЦНИИЭ).
Анализ иммунологических параметров у больных ХГС включал определение количества и функциональной активности субпопуляций Т-лимфоцитов. Исследование стандартной панели субпопуляционного состава лимфоцитов и дополнительные панели окрашивания для определения числа циркулирующих лимфоцитов, экспрессирующих цепь 2 рецептора ИФН-α/β и α-цепи рецептора ИФН-γ (CD118+, CD119+) в периферической крови, проводили методом проточной цитофлюориметрии на цитометре EPICS XL (Beckman Coulter, США).
Концентрации интерферонов (ИФН-α, -γ, -λ) в сыворотке крови определяли методом твердофазного ИФА, используя наборы Bioscience, с автоматической обработкой микропланшетным ридером Anthos 2020 (Anthos Labtec Instruments GmbH, Австрия) при длине волны 450 нм с коррекцией 620 нм с построением стандартной кривой зависимости оптической плотности и концентрации исследуемых цитокинов согласно инструкциям производителя.
Фиброэластометрию печени проводили на аппарате «Фиброскан 502» (Echosens, Франция), а стадии ФП определяли по шкале METAVIR.
Статистический анализ результатов проводили с помощью программ IBM SPSS Statistics 24 (IBM) и Microsoft Office Excel 2016 (Microsoft). Сравнение двух групп при анализе показателей, измеряемых в количественной шкале и имеющих нормальное распределение, осуществляли с применением параметрического t-критерия Стьюдента для независимых групп.
Результаты и обсуждение
Среди обследованных было 69 (59%) мужчин и 48 (41%) женщин. Средний возраст пациентов основной группы составил 45,7 ± 2,1 года. По результатам фиброэластометрии пациенты были разделены на 4 группы в зависимости от стадии ФП: F0–F1 – 38 пациентов, F2 – 25, F3 – 25 и F4 – 29 .
При анализе иммунологических показателей у больных ХГС в сравнении с группой контроля было обнаружено достоверное повышение уровней CD3+-, CD4+- и СD118+-лимфоцитов, Т-хелперов, экспрессирующих СD119+ (CD4+СD119+) (р < 0,05), а средние значения активированных CD45+ и CD38+ достоверно снижены (р < 0,05), различия по другим иммунологическим показателям не выявили достоверности (рис. 1).
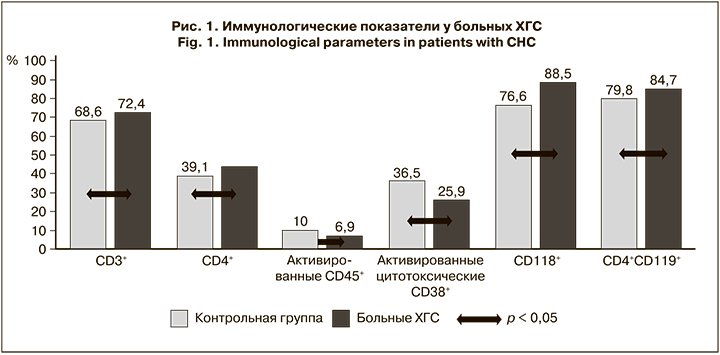
Анализ иммунологических параметров у больных ХГС на каждой стадии ФП показал разнонаправленные изменения: так, у больных ХГС со стпдией ФП F0–F1 отмечено достоверное повышение общего количества Т-лимфоцитов, Т-хелперов и иммунорегуляторного индекса на фоне снижения общего количества цитотоксических Т-лимфоцитов (ЦТЛ). Для таких пациентов характерно значимое снижение степени ранней и средней активации (популяции CD45+CD3+CD8+CD38+ и доли ЦТЛ, несущих на своей поверхности активационную молекулу CD38+), а также повышение количества CD118+-лимфоцитов по сравнению с контрольной группой. При этом особо важное значение имеют выявленные различия между этой группой больных и группой со стадией F4: у больных ХГС на стадии F0–F1 были достоверно повышены уровень активированных Т-лимфоцитов, несущих рецептор СD119+ (CD45+CD4+CD119+), и количество лимфоцитов, продуцирующих ИФН-γ (CD4+CD119+). У больных ХГС со стадией F2, как и при стадии F0–F1, отмечено повышение общего количества Т-лимфоцитов, Т-хелперов, снижение NKT-клеток и достоверное снижение активности ЦТЛ на фоне значимого нарастания популяции экспрессирующей СD118+.
Иммунограмма пациентов ХГС со стадией F3 характеризовалась повышением уровня общих Т-лимфоцитов и достоверным, по сравнению с группой контроля, снижением В-лимфоцитов, а уровень ЦТЛ и иммунорегуляторного индекса постепенно нарастал, возвращаясь к нормальным значениям. При этом происходило нарастание количества NK- и NKT-клеток, уровней активированных ЦТЛ (CD45+CD3+CD8+CD38+) и доли ЦТЛ, несущих на своей поверхности молекулу CD38+.
Значительный рост числа общих Т-лимфоцитов, нарастание числа Т-хелперов, значимое снижение В-лимфоцитов, достоверное увеличение уровня СD118+ (р = 0,021), активированных ЦТЛ, экспрессирующих маркер CD38+ (p = 0,04), и лимфоцитов, продуцирующих СD119+ (р = 0,031), характеризовали иммунограмму у больных со стадией ФП F4.
Таким образом, было показано, что наиболее отчетливые изменения иммунологических показателей выявлены при выраженном ФП (F3–F4).
Очень важно было показать взаимосвязь между иммунологическими данными и стадией ФП. Для этого были проанализированы средние значения эластичности печеночной паренхимы по шкале METAVIR (в кПа) в зависимости от стадии ФП. Для пациентов со стадией ФП F0–F1 эластичность печени составляла 5,5 ± 0,2 кПа, со стадией F2 – 8,2 ± 0,1 кПа, со стадией F3 – 10,6 ± 0,2 кПа и со стадией F4 – 22,1 ± 1,3 кПа. Убедительные корреляционные связи были выявлены у больных с выраженным ФП (F3–F4): положительная связь умеренной силы определялась между F3 и уровнями CD4+ и CD119+ (r = 0,463; p = 0,040); положительная корреляционная связь отмечена между ФП F4 и показателями В-клеток и активацией Т-лимфоцитов (активированные ЦТЛ, доля активированных ЦТЛ, несущих маркер CD38+, а также лимфоцитов, экспрессирующих на своей поверхности молекулу HLA-DR).
В ходе корреляционного анализа для выраженного ФП (F3–F4) установлены сильная положительная связь количества CD119+ с уровнем Т-хелперов, экспрессирующих ИФН-γ (r = 0,807; р = 0,001), а также умеренной силы взаимосвязь CD119+ с уровнем СD45+CD4+CD119+ (r = 0,494; р = 0,001). Установлены положительные умеренные взаимосвязи между количеством CD4+ и CD45+, экспрессирующих ИФН-γ (r = 0,492; р = 0,004). Эти данные подтверждают значимость Т-клеточного иммунитета и ИФН-γ в прогнозе выраженного ФП.
При проведении связи интерфероновой системы в зависимости от стадии ФП была выявлена тенденция к снижению концентрации ИФН-α и повышению уровня ИФН-λ с прогрессированием стадии ФП. Сравнительный анализ показателей ИФН-γ у больных с выраженным фиброзом и стадиями F0–F2 выявил достоверное увеличение этого показателя у больных со стадиями F3–F4 (p < 0,05) (рис. 2).
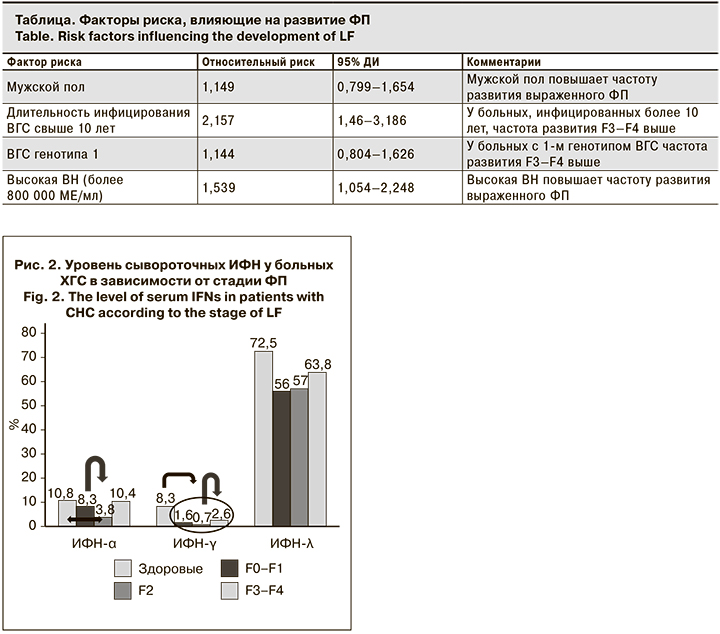
Поскольку ФП развивается постепенно, и на его развитие влияют многочисленные факторы, было важно рассчитать относительный риск таких факторов, как пол, длительность инфицирования ВГС, генотип и ВН, что имеет первостепенное значение для развития выраженного ФП у больных ХГС (см. таблицу). Было показано, что все исследуемые факторы повышают риск развития выраженного ФП у больных ХГС.
Заключение
Проведенное исследование выявило у больных ХГС с разными стадиями ФП значимое повышение общего количества Т-лимфоцитов, Т-хелперов. Значительное снижение количества В-лимфоцитов отмечено у больных со стадиями F3 и F4. Анализ интерфероновой системы выявил тенденцию к снижению концентрации ИФН-α и повышению уровня ИФН-λ с прогрессированием стадии ФП. Установлено, что у больных с выраженным ФП уровень ИФН-γ достоверно выше, чем у пациентов со стадиями ФП F0–F2. Для выраженного ФП (F3–F4) установлены сильная положительная связь количества CD119+ с уровнем Т-хелперов, экспрессирующих ИФН-γ (r = 0,807; р = 0,001), а также умеренной силы взаимосвязи CD119+ с уровнем СD45+CD4+CD119+ (r = 0,494; р = 0,001). Установлены положительные умеренные взаимосвязи между количеством CD4+ и CD45+, экспрессирующих ИФН-γ (r = 0,492; р = 0,004).
Полученные данные не только подтверждают мнение о выраженном иммуносупрессивном действии ВГС, но и подчеркивают значимость Т-клеточного иммунитета и ИФН-γ для прогноза выраженного ФП.



