До настоящего времени инфекции кожи и мягких тканей (ИКМТ) остаются наиболее частой причиной обращения больных за амбулаторной и стационарной помощью [1–5]. По экспертным оценкам, ИКМТ ежегодно регистрируются примерно у 700 000 пациентов и являются либо самостоятельным заболеванием, либо следствием механических повреждений и хирургических манипуляций [1, 6–8]. Важность проблемы ИКМТ подчеркивает тот факт, что в структуре обращений к врачам поликлинического звена (хирурги, инфекционисты, дерматологи) их частота достигает 70%, а процент хирургических инфекций мягких тканей (послеоперационные нагноения, постинъекционные осложнения) в России составляет около 24% [1].
В последние годы наблюдается трансформация ИКМТ [1, 7, 8]. Например, увеличивается доля наиболее тяжелых – геморрагических форм рожи, особенно у больных с сопутствующей соматической патологией [9]. Развитие геморрагического синдрома сопровождается повышением риска осложнений и затягиванием сроков реконвалесценции. Риск развития геморрагических форм рожи в 9,9 раз выше при локализации инфекционного очага на нижних конечностях по сравнению с лицом (ОШ = 9,9 [2,8; 34,7]) [10].
Общепризнанным основным возбудителем рожи как инфекционного воспаления принято считать β-гемолитический стрептококк групп А и G, однако в последнее время обсуждается участие золотистого стафилококка и грамотрицательных бактерий с повышением их роли при осложненных вариантах болезни [11–13]. Описанная тенденция расценивается как одна из причин роста числа случаев рожи тяжелой степени, часто –рецидивирующей рожи с затяжным периодом реконвалесценции [14].
За последнее десятилетие в развитии нозокомиальных инфекций возрастает роль метициллин-устойчивых штаммов золотистого стафилококка (CA-MRSA), микст-инфекции [7, 8, 11, 14–16]. Следует отметить увеличение частоты выделения штаммов MRSA у больных сахарным диабетом, осложнившимся развитием диабетической стопы: в 1974 г. – 2%, в 1995 г. – 22%, в 2003 г. – 60%, в 2004 г. – 63% [1, 17].
В хирургических стационарах РФ частота выделения штаммов MRSA в последние годы постоянно увеличивается и составляет около 65%, летальность достигает 21% [1, 18].
Наиболее частой этиологической причиной ИКМТ служат бактерии Staphylococcus aureus, Streptococcus spp. (Streptococcus pyogenes, в меньшей степени – стрептококки групп В, С и G), энтеробактерии и анаэробные микроорганизмы (Bacteroides группы fragilis и Clostridium spp.). S. aureus является наиболее актуальным возбудителем в большинстве случаев ИКМТ [1, 13, 15, 17, 19]. Эффективность лечения стафилококковых инфекций снижается вследствие широкого распространения в стационарах штаммов MRSA, которые, помимо закономерной устойчивости к β-лактамным антибиотикам, часто характеризуются устойчивостью к другим классам антибактериальных препаратов, в частности к аминогликозидам, макролидам, линкозамидам, фторхинолонам [3, 15].
По данным исследований А.А. Еровиченкова и соавт. [20], при молекулярно-биологическом исследовании мазков (полимеразная цепная реакция с обратной транскрипцией) с поверхности кожи, пунктатов подкожной клетчатки из области воспалительного очага, содержимого булл и образцов крови при буллезно-геморрагической роже нижних конечностей у 54,6% больных получены образцы ДНК Streptococcus spp, у 36,3% – Staphylococcus spp. и у 25,9% – одновременно ДНК 2 или 3 микроорганизмов. В содержимом булл обнаруживали ДНК Streptococcus spp. в 52,9% случаев, Staphylococcus spp. – в 38,2%, Pseudomonas aeruginosa – в 6,0%, Klebsiella spp. – в 2,9%. Следовательно, структура возбудителей ИКМТ не ограничивается S. аureus и отличается микробным разнообразием [1, 20–26].
Осложненные бактериальные ИКМТ, вызванные штаммами MRSA, имеют большое медицинское и социальное значение, так как требуют больших материальных затрат на лечение [1, 7, 8]. Высокая актуальность MRSA при данных заболеваниях подразумевает включение в протоколы лечения антибактериальных препаратов, активных против этих микроорганизмов (линезолид, ванкомицин и др.), в том числе в качестве средств эмпирической терапии при наличии факторов риска MRSA-инфекций. Другой актуальной проблемой является широкое распространение устойчивых к цефалоспоринам грамотрицательных энтеробактерий, прежде всего E. coli и Klebsiella spp. [18, 21–26].
Рост антибиотико-резистентных штаммов грамотрицательной и грамположительной флоры, отражающий общую тенденцию эволюции микроорганизмов, а в ряде случаев являющийся следствием нерационального использования антибактериальных препаратов, вызывает определенные трудности в выборе тактики лечения и негативно влияет на клинические результаты лечения ИКМТ. Необходимо отметить, что в выборе адекватной тактики лечения важную роль играют знание анатомии мягких тканей, уровень локализации инфекции, что в совокупности с анализом конкретной клинической ситуации, учетом факторов риска и знанием эпидемиологической обстановки позволяет с достаточно высокой долей вероятности определить потенциального возбудителя и назначить адекватную рациональную эмпирическую антибактериальную терапию.
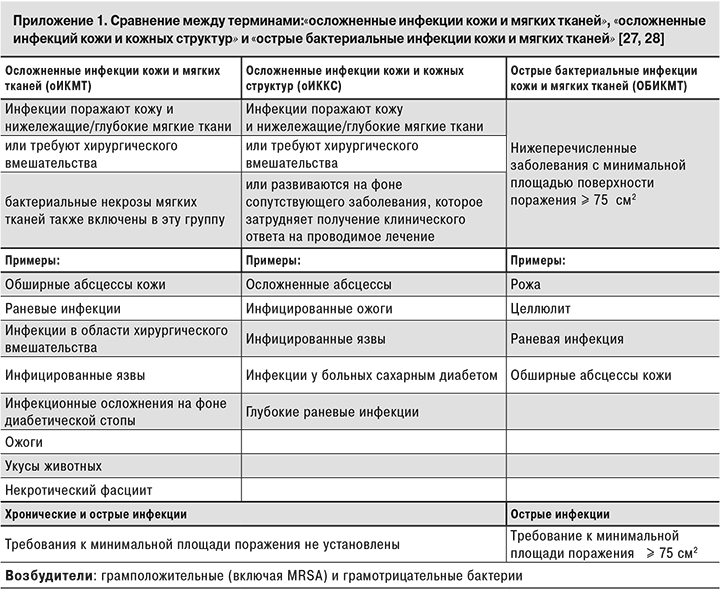
Необходимо подчеркнуть, что существенную помощь в выборе тактики лечения может оказать использование в клинической практике современных классификаций ИКМТ, учитывающих степень тяжести, глубину и площадь поражения кожи и подкожных структур и характер преморбидного фона при различных бактериальных процессах [1, 3, 27, 28].

Управление по надзору за качеством пищевых продуктов и лекарственных средств США (FDA) с 1998 г. регламентирует деление «острых бактериальных инфекций кожи и кожных структур» (Acute Bacterial Skin and Skin Structure Infections – ABSSSIs) на неосложненные и осложненные [27]. «Неосложненные инфекции кожи и мягких тканей» определяют как инфекции, для лечения которых требуется обычный курс антибактериальной терапии или проведение дренирования. Сюда отнесены фолликулит, неосложненные абсцессы, целлюлит и необширные раневые инфекции. «Осложненные инфекции кожи и мягких тканей» требуют более сложного лечения, госпитализации и хирургического вмешательства и включают в себя осложненные инфекции кожи и кожных структур и некротические инфекции мягких тканей [27].
В октябре 2013 г. FDA обновила классификацию ABSSSIs – «Острые бактериальные инфекции кожи и кожных структур», добавив новую категорию – «острые бактериальные инфекции кожи и мягких тканей (Skin and Soft Tissue Infections)» или сокращенно ОБИКМТ.
Тем самым была выделена отдельная группа заболеваний (целлюлит, рожа, раневая инфекция и абсцесс кожи с минимальной площадью поражения ≥ 75 см2), вызываемая различными грамположительными, в том числе метициллин-резистентным S. aureus (MRSA), реже – грамотрицательными бактериями [8, 27, 28]. Сравнение терминологии «осложненные инфекции кожи и мягких тканей», «осложненные инфекции кожи и кожных структур» и «острые бактериальные инфекции кожи и мягких тканей», принятое в зарубежных рекомендациях, приведено в Приложении.
В РФ, согласно национальным рекомендациям «Хирургические инфекции кожи и мягких тканей» (2009), используется классификация ИКМТ с указанием кода болезни по МКБ -10 в следующем виде (табл. 1).
Таким образом, изменение структуры заболеваемости ИКМТ в сторону более тяжелых клинических вариантов болезни, включая геморрагические формы, затяжной период реконвалесценции, рост доли MRSA в структуре патогенных возбудителей диктует необходимость непрерывного поиска новых, современных и безопасных антибактериальных препаратов [1, 15, 16, 18, 29–31].
 В этой связи особый интерес представляют антибиотики группы оксазолидинонов, к которым относится препарат СИВЕКСТРО® (МНН: тедизолид), характеризующийся более высоким профилем эффективности и безопасности в сравнении с другими препаратами стандартной антибактериальной терапии [32–34]. Это первый препарат из группы оксазолидинонов второго поколения, получивший одобрение FDA к применению при ИКМТ [28]. Имеющийся к настоящему времени опыт применения тедизолида показал его преимущества в сравнении с предшественником – линезолидом – в отношении противомикробной активности, включая микроорганизмы со сниженной чувствительностью к линезолиду и ванкомицину [23–26]. Кроме того, был отмечен более высокий профиль безопасности препарата в сравнении с линезолидом [32–48]. В настоящем обзоре представлен анализ проведенных исследований эффективности и безопасности препарата тедизолид.
В этой связи особый интерес представляют антибиотики группы оксазолидинонов, к которым относится препарат СИВЕКСТРО® (МНН: тедизолид), характеризующийся более высоким профилем эффективности и безопасности в сравнении с другими препаратами стандартной антибактериальной терапии [32–34]. Это первый препарат из группы оксазолидинонов второго поколения, получивший одобрение FDA к применению при ИКМТ [28]. Имеющийся к настоящему времени опыт применения тедизолида показал его преимущества в сравнении с предшественником – линезолидом – в отношении противомикробной активности, включая микроорганизмы со сниженной чувствительностью к линезолиду и ванкомицину [23–26]. Кроме того, был отмечен более высокий профиль безопасности препарата в сравнении с линезолидом [32–48]. В настоящем обзоре представлен анализ проведенных исследований эффективности и безопасности препарата тедизолид.
Структура и механизм антимикробной активности
Тедизолид представляет собой антибиотик, предлагающий удобный (1 раз в день), короткий (в течение 6 дней) курс лечения осложненных ИКМТ с возможностью проведения ступенчатой (внутривенный → пероральный путь введения) терапии с отсутствием необходимости индивидуального мониторинга и корректировки дозы.
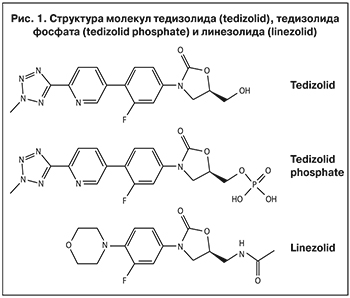
Активным компонентом препарата СИВЕКСТРО® является тедизолид [(5R)-3-{3- фтор-4-[6-(2-метил-2H-тетразол-5-ил)пиридин-3-ил]фенил}-5-(гидроксиметил)-1,3-оксазолидин-2-он]. Тедизолида фосфат является пролекарством, в организме он превращается в активный метаболит – тедизолид.
В структуру молекулы тедизолида по сравнению с линезолидом были внесены существенные изменения, благодаря которым антибактериальная активность повысилась в 4–32 раза, риск развития резистентности снизился в 16 раз, и препарат приобрел более широкий спектр действия по сравнению с линезолидом [35, 36].
Химическое строение тедизолида отличается наличием принципиально нового D-кольца, содержащего дополнительную метилтетразольную группу (рис. 1).
Эти структурные особенности обеспечивают повышение антибактериальной активности препарата и уменьшают риск развития резистентности микроорганизмов. Химическая структура тедизолида характеризуется также наличием гидроксильной группы на A-кольце в положении C-5. В отличие от более крупной ацетамидной группы линезолида в условиях сfr-опосредованного метилирования нуклеотидного остатка A2503 рРНК 23S, гидроксильная группа меньшего размера у тедизолида отлично связывается с метилированным участком связывания, подходя как «ключ к замку», что обеспечивает антибактериальную активность препарата при наличии у микроорганизмов cfr-опосредованной резистентности. D-кольцо за счет прочных водородных связей повышает аффинность тедизолида к рибосомальной субъединице 50S и усиливает его противомикробные свойства.
 Механизм действия тедизолида основан на способности связываться с 23S рибосомальной РНК (рРНК) пептидилтрансферазного центра, входящего в состав рибосомальной субъединицы 50S, в результате чего блокируется процесс белкового синтеза. Антибактериальная активность оксазолидинонов коррелирует с их аффинностью к участку связывания на рибосоме. Более высокая активность тедизолида по сравнению с линезодидом обусловлена лучшей взаимосвязью его с рРНК [35].
Механизм действия тедизолида основан на способности связываться с 23S рибосомальной РНК (рРНК) пептидилтрансферазного центра, входящего в состав рибосомальной субъединицы 50S, в результате чего блокируется процесс белкового синтеза. Антибактериальная активность оксазолидинонов коррелирует с их аффинностью к участку связывания на рибосоме. Более высокая активность тедизолида по сравнению с линезодидом обусловлена лучшей взаимосвязью его с рРНК [35].
Активность тедизолида in vitro
Благодаря структурным изменениям на обоих концах молекулы, активность тедизолида in vitro в отношении грамположительных бактерий повышается в 4–32 раза. К этим возбудителям относят Staphylococcus aureus (включая штаммы MRSA и MSSA), Staphylococcus haemolyticus, Staphylococcus lugdunensis, Streptococcus pyogenes, Streptococcus agalactiae, группу Streptococcus anginosus (в том числе Streptococcus anginosus, Streptococcus intermedius и Streptococcus constellatus), а также Enterococcus faecalis (включая ванкомицин-резистентные энтерококки – VRE). Минимальная подавляющая концентрация (МПК) тедизолида в 4–32 раза ниже, чем МПК линезолида [32–34, 41].
Активность in vitro усиливается in vivo благодаря высокой внутриклеточной кумуляции тедизолида в гранулоцитах, макрофагах, что способствует более быстрой эрадикации бактерий (например, S. aureus) по сравнению с линезолидом [38–40].
Механизмы, препятствующие развитию резистентности
Частота развития микробной резистентности к тедизолиду у S. aureus и других возбудителей в 16 раз ниже, чем к линезолиду [34].
На чувствительность бактерий к оксазолидинонам влияют 2 типа хромосомных мутаций. Это точечные мутации в 23S рРНК (то есть G2576T; C2192T; G2447T; T2500A; A2503G; T2504C; G2505A; G2766T) или в рибосомных белках (белки L3, L4, кодируемые генами rplC, rplD в хромосоме соответственно). Третий механизм снижения чувствительности опосредован действием расположенного на плазмиде cfr-гена/фермента (хлорамфеникол/флорфеникол), который метилирует 23S рРНК в положении A2503. Однако между гидроксиметильной группой на конце молекулы тедизолида и cfr-метилированной РНК в положении A2503 не образуется пространственного несоответствия, чем объясняется сохранение антибактериальной активности тедизолида в отношении cfr-положительных штаммов. За счет этого препарат сохраняет активность in vitro в отношении бактерий (например, S. aureus), несущих cfr-ген. При наличии мутаций рРНК и рибосомальных белков МПК тедизолида в 4–8 раз ниже, чем у линезолида [43, 44, 49–51].
Фармакокинетическая характеристика
Тедизолид выпускается в двух лекарственных формах, предназначенных для внутривенного введения и перорального приема. Готовый раствор для внутривенного введения содержит 200 мг тедизолида фосфата, который вводят в течение 60 мин. Каждая таблетка содержит 200 мг тедизолида фосфата и принимается независимо от приема пищи. После перорального приема тедизолида фосфата пиковая (Cmax) концентрация действующего вещества (тедизолида) в плазме крови достигается в течение 3 ч. Период полувыведения тедизолида составляет около 10–11 ч (табл. 2) [45].
Такая продолжительность периода полувыведения позволяет вводить препарат в организм 1 раз в сутки. При применении тедизолида фосфата после приема пищи (высококалорийной, с высоким содержанием жиров) или натощак были получены сходные значения площади под кривой «концентрация–время» (ПФК 0-∞).
Таким образом, тедизолид можно применять независимо от приема пищи. Биодоступность тедизолида фосфата при пероральном приеме составляет 91,5%, что позволяет проводить ступенчатую терапию (внутривенное введение →пероральный прием) без корректировки дозы [45, 48, 50].
Связь с белками крови составляет приблизительно 70–90%. Средний равновесный объем распределения тедизолида у здорового взрослого человека после однократного внутривенного введения 200 мг тедизолида фосфата варьирует от 67 до 80 л.
В клиническом исследовании с использованием микродиализа тедизолид проникал в подкожно-жировую клетчатку и скелетно-мышечную ткань в концентрациях, равных содержанию свободной фракции препарата в плазме крови [37].
Установлено, что тедизолид избирательно накапливается в жидкости эпителиальной выстилки легочной ткани и альвеолярных макрофагах. Коэффициент пенетрации тедизолида в жидкость эпителиальной выстилки и альвеолярные макрофаги был соответственно в 40 и 20 раз выше концентрации свободной фракции препарата в плазме крови [40].
 Кроме тедизолида (95%), у человека не обнаруживается других значимых циркулирующих метаболитов в плазме крови. Препарат не взаимодействует с печеночными ферментами CYP450. Большая часть антибиотика выводится в течение 96 ч через печень, при этом 82% дозы выводится с калом и 18% – с мочой в неактивном виде [45, 48, 50].
Кроме тедизолида (95%), у человека не обнаруживается других значимых циркулирующих метаболитов в плазме крови. Препарат не взаимодействует с печеночными ферментами CYP450. Большая часть антибиотика выводится в течение 96 ч через печень, при этом 82% дозы выводится с калом и 18% – с мочой в неактивном виде [45, 48, 50].
Показания к применению
СИВЕКСТРО® (тедизолид) зарегистрирован в РФ для лечения осложненных ИКМТ, вызванных чувствительными грамположительными микроорганизмами. Спектр антибактериальной активности препарата включает патогенные микроорганизмы, чувствительные к тедизолиду in vitro, в отношении которых в клинических исследованиях была показана эффективность.
Аэробные и факультативные грамположительные бактерии:
- Staphylococcus aureus (включая штаммы MRSA и MSSA);
- Streptococcus pyogenes (β-гемолитические стрептококки группы А);
- Streptococcus agalactiae (β-гемолитические стрептококки группы В),
- группа Streptococcus anginosus, включая Streptococcus anginosus, Streptococcus intermedius и Streptococcus constellatus;
- Enterococcus faecalis.
Клиническая эффективность тедизолида в отношении перечисленных ниже патогенных микроорганизмов не была установлена, однако результаты исследований in vitro позволяют предполагать, что они чувствительны к тедизолиду в отсутствие приобретенных механизмов резистентности.
Аэробные и факультативно анаэробные грамположительные бактерии:
- Staphylococcus epidermidis (включая штаммы MRSA и MSSA);
- Staphylococcus haemolyticus;
- Staphylococcus lugdunensis;
- Enterococcus faecium.
Тедизолид, как правило, неактивен в отношении грамотрицательных бактерий.
Профиль безопасности
Возраст до 18 лет является противопоказанием для назначения тедизолида, так как безопасность и эффективность препарата в данной возрастной группе не установлены. Препарат не назначают беременным и женщинам в период грудного вскармливания.
Прием тедизолида по 200 мг 1 раз в сутки в течение 21 дня оказывал минимальное воздействие на содержание гранулоцитов и тромбоцитов по сравнению с плацебо у здоровых добровольцев и в клинических исследованиях III фазы [32–34, 39–47, 51].
Такие демографические или клинические факторы, как возраст, пол, расовая и этническая принадлежность, вес, ИМТ и состояние почек или печени, не оказывают значимого влияния на фармакокинетику тедизолида фосфата.
Отсутствует необходимость корректировать дозу препарата у пациентов с почечной недостаточностью или находящихся на гемодиализе. Согласно исследованиям, у пациентов с ожирением, в том числе алиментарным, необходимость корректировки дозы также отсутствует.

Тедизолид не оказывает влияния на сердечную реполяризацию, корректировать дозу препарата у пожилых пациентов не требуется.
При оценке неврологической и офтальмологической безопасности у здоровых добровольцев (получавших перорально тедизолид по 200 мг 1 раз в сутки в течение 10 дней) не было зарегистрировано отклонений от нормы по неврологическим и офтальмологическим показателям [51].
Побочное действие
Тедизолид может вызывать головокружение, тошноту, в редких случаях – сонливость, поэтому может влиять на способность управления транспортными средствами и механизмами.
Результаты клинических исследований эффективности препарата тедизолид при оИКМТ
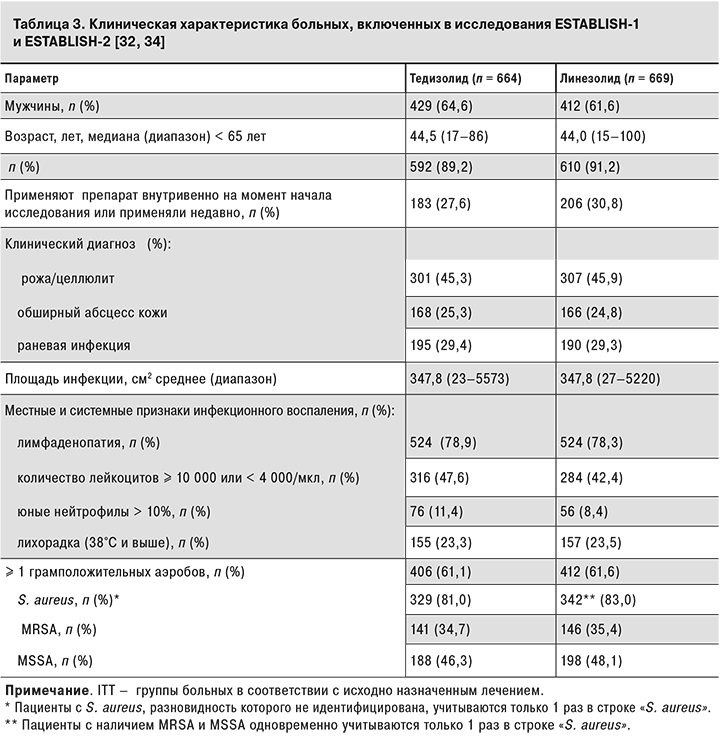
Применение тедизолида было изучено при острых ИКМТ (целлюлит, рожа, обширные кожные абсцессы и раневые инфекции с площадью поражения ≥ 75 см2) в двух крупных рандомизированных международных многоцентровых двойных слепых исследованиях III фазы («Tedizolid phosphate vs linezolid for treatment of acute bacterial skin and skin structure infections: the ESTABLISH-1 randomized trial», «Tedizolid for 6 days vs linezolid for 10 days for acute bacterial skin and skin-structure infections (ESTABLISH-2): a randomised, double-blind, phase 3, non-inferiority trial»).
Дизайн исследований ESTABLISH-1 (п = 667) и ESTABLISH-2 (п = 666) включал оценку эффективности и переносимости антибактериальной терапии тедизолидом фосфатом в сравнении с другим препаратом из группы оксазолидинонов – линезолидом – у больных ОБИККС [34].
В целом дизайн клинических исследований ESTABLISH-1 и ESTABLISH-2 имел много общего. В исследование ESTABLISH-1 были включены пациенты в возрасте от 18 лет, в исследование ESTABLISH-2 – от 12 лет. Более 60% испытуемых были мужчины, медиана возраста составила 44 года.
В ESTABLISH-1 и ESTABLISH-2, согласно дизайну исследования, были включены больные с клиническими диагнозами: рожа, целлюлит, обширный абсцесс кожи, раневая бактериальная инфекция с площадью поражения ≥ 75 см2. В исследование включали больных с наличием как минимум одного системного или регионального признака инфекционного процесса [лимфаденопатия, повышение температуры тела, изменение лейкоцитарной формулы (лейкоцитоз ≥ 10 000/мкл или лейкопения < 4000/мкл, увеличение числа юных нейтрофилов > 10%) с подозрением или обнаружением грамположительных бактерий в первичном очаге [32–34].
Согласно критериям ОБИККС, у 45% больных были диагностированы рожа и целлюлит, у 25% – обширный абсцесс кожи, у 30% – раневые инфекции. Средняя площадь инфекционного очага у больных, получавших тедизолид и линезолид, была сходной – 347,8 см2.
У 60% больных в обеих группах диагноз был подтвержден выделением из очага поражения не менее одного вида грамположительных бактерий. Частота выделения MRSA и MSSA при ОБИККС была сходной в группах больных, получавших тедизолид и линезолид (табл. 3).
В исследование ESTABLISH-1 и ESTABLISH-2 не включали больных с неосложненными ИКМТ; с инфекционным процессом, вызванным грамотрицательными бактериями; с септицемией, бактериемией и септическим шоком; с инфекциями, ассоциированными с установленным катетером и наличием тромбофлебита, а также пациентов, ранее получавших антибиотики и ингибиторы моноаминоксидазы [32, 34].
Кроме перечисленных нозологических форм в исследования не включали больных с инфекционными осложнениями диабетической стопы, инфицированными ожогами, хроническими язвами и перенесших гнойные хирургические операции [32, 33].
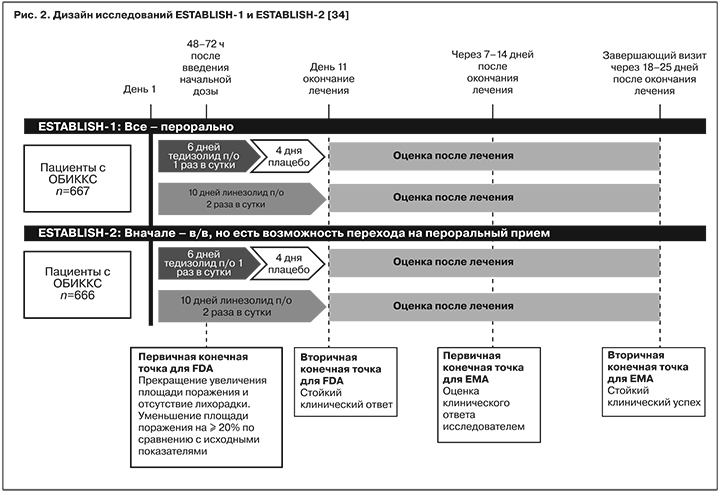
В рамках исследования ESTABLISH-1 пациенты получали антибиотики перорально: тедизолид – 200 мг 1 раз в сутки в течение 6 дней (с 7-го по 10-й день – плацебо), линезолид – 600 мг 2 раза в сутки (суточная доза – 1200 мг) в течение 10 дней. Для соблюдения протокола исследования все участники получали 3 таблетки в день, повышение или понижение дозы запрещалось (рис. 2) [32].
В исследовании ESTABLISH-2 пациенты сначала получали антибиотики внутривенно, далее мог быть осуществлен перевод на пероральный прием (см. рис. 2) [33].
Первичную точку эффективности определяли у всех больных, включенных в исследование (ITT-группа). Вторичную точку эффективности оценивали в mITT-группе, в которую были включены больные с обнаруженными грамположительными бактериями в очаге воспаления и завершившие исследование без серьезных нарушений.
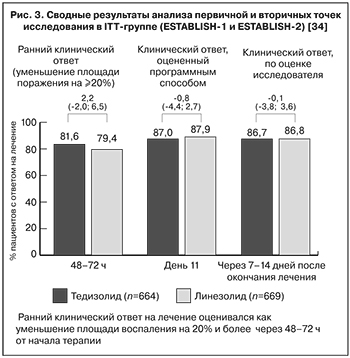
Сводный анализ результатов исследования продемонстрировал сопоставимую эффективность 6-дневного курса тедизолида в сравнении с 10-дневным курсом линезолида по итогам первичной и вторичной точек исследования. Ранний клинический ответ на лечение оценивали как уменьшение площади инфекционного воспаления на 20% и более через 48 –72 ч от начала лечения. Частота клинического успеха в группах тедизолида и линезолида была сходной на момент окончания лечения (87,0 и 87,9% соответственно, значение -0,8%; [-4,4; 2,7]) и сопоставима в катамнезе (на 7–14-й день после окончания лечения, 18–25-й день от начала терапии) (рис. 3) [34].
Среди больных рожей и целлюлитом через 48–72 ч на терапию ответили 81% больных, получавших тедизолид и 80% больных, получавших линезолид. Сопоставимая эффективность препаратов была получена при обширных абсцессах кожи (87 и 90% соответственно). При раневых инфекциях ранний клинический ответ был получен у большего числа больных, получавших тедизолид (92%) по сравнению с получавшими линезолид (82%) (рис. 4) [33].
Доля больных с бактериальной санацией инфекционного очага после курса антибиотикотерапии была одинаково высокой у пациентов, принимавших как тедизолид, так и линезолида. При выделении из очага инфекционного воспаления патогенного S. aureus ранний клинический ответ был достигнут в 85,1 и 80,7% случаев соответственно. Сходные результаты были получены при выделении из очага инфекционного воспаления MRSA (80,9 и 76,0%) и MSSA (88,3 и 84,3%).
Результаты исследований ESTABLISH-1 и ESTABLISH-2 продемонстрировали хорошую переносимость тедизолида, при этом нежелательные явления (НЯ) со стороны желудочно-кишечного тракта (ЖКТ) при приеме тедизолида в сравнении с линезолидом развивались реже (рис. 5) [34].
Доля больных в обеих группах была сопоставима по частоте развития НЯ (43%), которые в большинстве случаев были умеренной или легкой степени тяжести [34]. В группе пациентов, принимавших тедизолид, было 2 летальных исхода, в группе принимавших линезолид – 1. НЯ, которые привели к отмене испытуемого препарата, возникли у 0,5 и 0,9% больных соответственно.
Тромбоцитопения у больных при приеме тедизолида развивалась реже (4,9%), чем при приеме линезолида (10,8%) с уровнем р = 0,0003 на 11–13 день; после приема последней дозы препарата (3,7% на 7-й день для тедизолида и 10,8% на 11-й день для линезолида; р < 0,0001), на протяжении всего периода исследования (6,4 и 12,6%, соответственно; р = 0,0016). Число случаев снижения уровня гемоглобина крови и случаев нейтропении в обеих группах было сопоставимо [34].
Заключение
В настоящее время накоплен положительный опыт применения тедизолида для лечения ИКМТ. Масштабные международные исследования ESTABLISH-1 и ESTABLISH-2 у больных ОБИККС продемонстрировали, что 6-дневный курс лечения тедизолидом по эффективности не уступает 10-дневному курсу лечения линезолидом [32–34]. Доказана хорошая антибактериальная активность тедизолида в лечении заболеваний, вызванных грамположительными бактериями, включая метициллин-резистентные штаммы стафилококков (рожа, целлюлит, абсцесс кожи, раневые инфекции). Тедизолид продемонстировал ранний (через 48–72 ч от начала антибактериальной терапии) клинический ответ, в более 80% случаев коррелировавший с достижением положительного результата по окончании курса лечения [32–34].
В исследованиях ESTABLISH-1 и ESTABLISH-2 тедизолид обладал лучшей переносимостью по сравнению с линезолидом: тромбоцитопения и НЯ со стороны ЖКТ развивались реже [32–34].
Полученные результаты свидетельствуют о том, что новый антибактериальный препарат СИВЕКСТРО® (тедизолид) может быть рекомендован для лечения осложненных ИКМТ, вызванных чувствительными грамположительными микроорганизмами.