Менингококк (Neisseria meningitidis) – ведущая причина бактериального менингита и сепсиса в мире [1]. Показатели заболеваемости генерализованной формой менингококковой инфекции (ГФМИ) в разных странах составляют 0,5–15 на 100 тыс. населения, однако в странах так называемого «менингитного пояса» Африки они значительно выше: 100–1000 на 100 тыс. населения [2]. На основании биохимического строения полисахаридной капсулы вид Neisseria meningitidis классифицируется по серогруппам. Различают 12 серогрупп, однако лишь 6 – А, В, С, W (ранее W-135), Х и Y – могут стать причиной ГФМИ. Типирование менингококка основано на строении белков наружной мембраны (белок, связывающий фактор Н – FHbp; адгезивный белок А – NadA и гепаринсвязывающий антиген – Nhba), поринов А (PorA) и В (PorB) и рецептора энтеробактина (FetA) [3–8]. В зависимости от антигенной и генетической характеристик штаммы менингококка объединяют в сиквенс-типы (ST) и клональные комплексы (cc) [9]. Менингококк имеет пластичный геном, обмениваясь генетическим материалом от других бактерий рода Neisseria или других бактериальных видов путем различных рекомбинационных процессов [10]. С явлением «антигенного сдвига» (antigenic shift) – изменением генов, кодирующих белки-антигены поверхностной мембраны, – может быть связано повышение заболеваемости ГФМИ [11]. Механизм «переключения капсулы» (capsular switching) – приобретение новых или измененных капсульных генов – также может приводить к появлению новых вирулентных и/или эпидемически опасных клонов менингококка. Благодаря возникающему антигенному разнообразию, наблюдаемому даже среди штаммов одного клонального комплекса, менингококковые штаммы, принадлежащие к вирулентным клонам, могут уходить от индуцированного вакциной иммунитета [12].
Впервые Neisseria meningitidis серогруппы W (NmW) были выделены от больных ГФМИ среди рекрутов США в 1960 г. [13]. В 1970–1990-х годах NmW редко был причиной ГФМИ [14]. Первая в мире вспышка ГФМИ, вызванной NmW (W-ГФМИ), произошла в 2000 г. среди паломников во время хаджа, ежегодно проходящего в Мекке (Саудовская Аравия). Вспышка насчитывала 400 случаев, 52 из которых закончились летально. Штамм, вызвавший эту вспышку, впоследствии названный «хадж-клон» (Hajj clone) [14], имел сиквенс-тип ST-11, образующий гипервирулентный клональный комплекс сс11, и аллельный профиль P1.5,2:F1-1:2-2 (PorA VR1,VR2:FetA:PorB) [15]. Двумя годами позднее в Буркина-Фасо, одной из стран «менингитного пояса» Африки, вспыхнула самая большая в мире эпидемия W-ГФМИ, насчитывающая более 12 000 случаев и 1400 смертей [11]. За первое десятилетие XXI века штаммы NmW сс11 стали причиной серьезных вспышек на Тайване, в Южной Африке, Китае, Бразилии, Аргентине, Чили и Великобритании [16].
В период 1960–1999 гг. большинство штаммов менингококка, входящих в сс11, относились к серогруппе С [14]. Считается, что NmW сс11 образовался от Neisseria meningitidis серогруппы С (NmС) того же клонального комплекса сс11 в результате механизма переключения капсулы [14]. Установлено, что хадж-клон очень схож с исторически редкими, спорадическими штаммами NmW сс11, которые выделяли повсеместно в 1970–1990 гг. Применение молекулярно-биологических методов показало, что несколько кластеров NmW cc11 возникли независимо от хадж-эпидемии. Было обнаружено, что клональный комплекс cc11 состоит из числа генетически и географически разнообразных подсемейств, и разные подсемейства могут сосуществовать внутри одной страны в одно и то же время [16]. Было выделено 2 главных NmW-ассоциированных подсемейства в семействе клонального комплекса сс11: подсемейство «хадж-штамма» и подсемейство «южноамериканского штамма». Штаммы первого подсемейства стали причиной вспышек ГФМИ в разных странах в начале 2000-х годов. Второе подсемейство включает в себя штамм, внервые обнаруженный в 2003 г. на юге Бразилии и распространившийся затем в Аргентину и Чили. Потомок южноамериканского штамма, так называемый великобританский штамм, выделен в Великобритании в 2009 г. В дальнейшем также в Великобритании от этого штамма произошел 2013-штамм, названный по году его выявления [17].
Для отличия хадж-клона от других NmW, обладающих аналогичными антигенными и генетическими характеристиками, помимо классического мультилокусного секвенирования-типирования (МЛСТ), используют ряд молекулярно-генетических методов: электрофорез в пульсирующем поле (PFGE); типирование на основании 16s-фрагмента рибосомальной РНК (для хадж-клона характерен аллель 31, в то время как для NmW, ассоциированных со спорадическими случаями – аллели 13 и 14); типирование по белку FHbp (хадж-клон имеет аллель 9; аллель 22 преобладает среди не-хадж-штаммов в Чили, Аргентине и Европе, в то время как штаммы из Африки и Бразилии имеют аллели 23 и 151 соответственно); полногеномное секвенирование [16].
M.M. Mustapha и соавт. [16] провели сравнение доли NmW в структуре ГФМИ за 2 периода: до-хадж-период (1970–1999) и пост-хадж-период (2000–2015). В первом доля NmW в странах Европы, Африки, Австралии, Южной Америки, Азии, Ближнего Востока составляла не более 10%, тогда как во втором она увеличилась в несколько раз, и в структуре лабораторно-подтвержденных случаев ГФМИ во многих странах NmW вышел на первое место. По данным S.N. Ladhani и соавт. [18], на сегодняшний день нет такой европейской страны, в которой не было бы отмечено повышения заболеваемости W-ГФМИ.
Специалисты отмечают некоторые особенности клиники ГФМИ, обусловленной NmW. Заболевание может протекать в виде септического артрита, тяжелого поражения дыхательных путей, пневмонии, с гастроинтестинальной симптоматикой. Так, во Франции из 119 случаев W-ГФМИ у детей 8% сопровождались септическим артритом [19]. В США при W-ГФМИ также отмечена большая доля артритов (3,3%), в то время как для ГФМИ, обусловленных менингококками серогрупп В и С, артриты менее характерны (0,6 и 1,1% соответственно) [20]. В Голландии доля пациентов с атипичной клинической картиной была также выше в случае W-ГФМИ (25%), чем при ГФМИ, вызванной Neisseria meningitidis серогруппы В (NmВ) – 3–5% [21]. В Великобритании в 2015–2016 гг. 7 из 15 заболевших W-ГФМИ подростков преимущественно имели клиническую картину острого живота, и 5 из 7 умерли [22]. 3 пациента с септицемией в Голландии (1 из них умер) преимущественно имели гастроинтестициальные симптомы [23]. Такую редкую клиническую картину ассоциируют с южноамериканским штаммом NmW, входящим в cc11 [24].
Отмечены особенности возрастного распределения больных W-ГФМИ и уровня летальности. В Англии и Уэльсе из 129 случаев W-ГФМИ в 2010–2012 гг. лишь четверть случаев выявлена у детей в возрасте до 5 лет и половина – у взрослых старше 45 лет. Показатель летальности составил 13% [18]. Рост числа случаев W-ГФМИ в Аргентине и Бразилии произошел с 2008 г., при этом большинство заболевших – дети младшего возраста [25]. В Чили NmW, входящие в cc11, регистрируют с конца 2011 г., и уже в 2012 г. 58% лабораторно-подтвержденных случаев относилось к W-ГФМИ, 47% из которых выявлены у детей в возрасте до 5 лет. Показатель летальности составил 21% [26]. Возрастная структура больных W-ГФМИ в Голландии и Великобритании была схожей, хотя доля лиц старше 65 лет среди заболевших в Голландии была выше. Показатель летальности от W-ГФМИ в Голландии составил 11% [21].
В условиях атипичного клинического течения W-ГФМИ увеличивается вероятность диагностических ошибок, которых можно избежать путем выделения микроорганизма из крови, спинномозговой жидкости или других стерильных в норме жидкостей организма. В отсутствие клинического подозрения специфические лабораторные исследования назначают не всегда. Поэтому без проведения бактериологического исследования или в случае получения отрицательного результата могут возникать задержки с началом профилактических и противоэпидемических мероприятий, например, химиопрофилактики среди близко контактных лиц в очаге ГФМИ [27].
В связи со сложившейся ситуацией на сегодняшний день во многих странах мира внесены изменения в тактику вакцинопрофилактики менингококковой инфекции. Так, в рекомендациях по профилактике этого заболевания для посещающих хадж вместо полисахаридной вакцины против инфекции, обусловленной менингококками серогрупп А и С, стали использовать четырехвалентную полисахаридную вакцину (серогруппы A, C, W, Y) [17]. В результате массовой вакцинации в странах «менингитного пояса» Африки уменьшилось число случаев ГФМИ, обусловленной менингококками серогруппы А, но произошел рост заболеваемости W-ГФМИ. Этот факт в сочетании с появлением ГФМИ, вызванной менингококками серогрупп Х и С, подчеркивает необходимость применения поливалентных вакцин для стран «менингитного пояса». В Чили конъюгированную вакцину против W-ГФМИ стали применять в 2012 г. у детей в возрасте от 9 мес. до 5 лет. В дальнейшем (2013–2015) случаи W-ГФМИ в этой возрастной группе не были зарегистрированы [16]. Серьезным аргументом для включения вакцинации против W-ГФМИ в программу вакцинопрофилактики в Великобритании стало быстрое распространение NmW во всех возрастных группах [28]. Впервые за более чем десятилетие летальные случаи от W-ГФМИ были отмечены среди детей и подростков. Выделенный от больных NmW cc11 генетически принадлежит к южноамериканскому штамму, что также вызвало обеспокоенность из-за высокого уровня летальности в Чили [24]. Осенью 2015 г. было принято решение заменить вакцинацию подростков 13–14 лет конъюгированной вакциной против ГФМИ, обусловленной менингококком серогруппы С, на вакцинацию четырехвалентной коньюгированнной вакциной абитуриентов как когорту лиц с самым высоким уровнем менингококкового носительства. Также дополнительно реализована «догоняющая» вакцинация детей 13–18 лет в течение 2015–2017 гг. [21]. Данные исследований, проведенных среди выпускников школ, показали, что, несмотря на низкий охват вакцинацией, случаев W-ГФМИ в этой группе было на 69% меньше, чем прогнозировалось, и ни один из вакцинированных подростков не заболел [27]. Включенная в программу иммунизации в Великобритании в сентябре 2015 г. вакцина против ГФМИ, обусловленной NmВ, может также обеспечить некоторую защиту от NmW маленьких детей [29, 30].

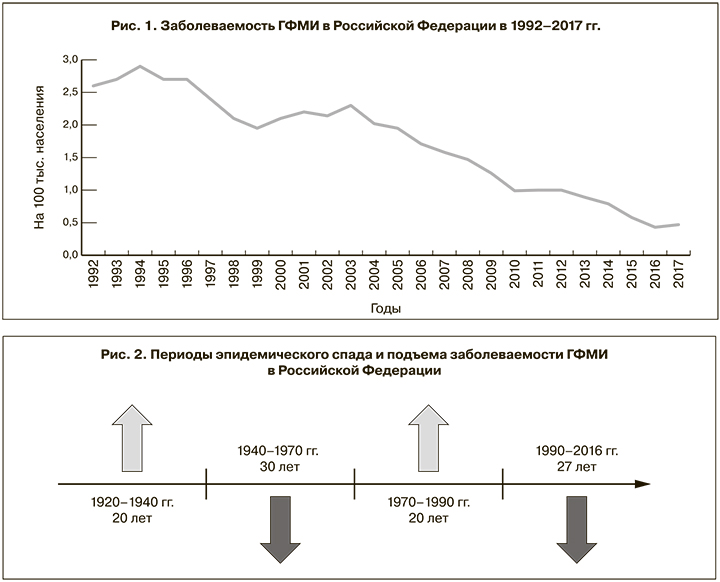
В Российской Федерации менингококк занимает первое место среди основных этиологических агентов гнойных бактериальных менингитов (менингококк, пневмококк, гемофильная палочка) [31]. Заболеваемость имеет многолетнюю тенденцию к снижению, однако по данным форм государственной статистической отчетности, в 2017 г. по сравнению с 2016 г. ее показатель повысился с 0,43 до 0,47 на 100 тыс. населения (рис. 1).
Прогноз, основанный на анализе многолетней цикличности спадов и подъемов заболеваемости ГФМИ, показывает, что мы можем находиться на пороге очередного эпидемического подъема, что потребует принятия неотложных мер по защите от возникновения эпидемий средствами вакцинопрофилактики [32] (рис. 2).
Целью настоящего исследования явились оценка доли NmW в структуре ГФМИ в РФ, анализ возрастного распределения больных W-ГФМИ и показателя летальности, а также характеристика циркулирующих в стране штаммов NmW в сопоставлении с зарубежными.
Материалы и методы
Были пронализированы персонифицированные учетные формы № 1 (заболеваемость ГФМИ) Российского Референс-центра по мониторингу за бактериальными менингитами за период с 2005 по 2017 г., полученные из всех территориальных образований РФ. Описание каждого случая включало следующую информацию: возраст и пол больного, социальный статус, городское или сельское место жительства, даты начала заболевания и госпитализации, первичный и окончательный диагнозы, выделенный возбудитель заболевания, результаты серогруппирования менингококка, локус выделения возбудителя, исход заболевания.
Характеристика штаммов NmW, циркулирующих в РФ, выполнена на основании результатов проведенных ранее молекулярно-генетических исследований, опубликованных в базе данных PubMLST (https://pubmlst.org/neisseria/).
Результаты
Серогрупповой пейзаж штаммов менингококка в РФ гетерогенен, в последние 4 года в нем преобладают штаммы серогруппы В. Наряду с ежегодным снижением числа случаев ГФМИ, вызванных менингококками серогрупп А, В и С, с 2013 г. наблюдается рост заболеваемости W-ГФМИ. Так, в 2005–2012 гг. их число не превышало 8 случаев в год, но в дальнейшем оно ежегодно увеличивалось: с 12 случаев в 2013 г. до 28 – в 2016 г.
В РФ в 2016 г. зарегистрировано 445 лабораторно-подтвержденных случаев ГФМИ. Среди возбудителей доля менингококка серогруппы B составила 28,5% (127 случаев), серогруппы С – 20,6% (92 случая), А – 9,4% (42 случая), W – 6,3% (28 случаев), Y – 1,1% (5 случаев). Не была определена серогруппа у 151 (33,9%) штамма. Несмотря на то что в целом по стране доля NmW в серогрупповом пейзаже штаммов менингококка составила лишь 6%, в Москве в 2017 г. он впервые занял лидирующую позицию – 29% (20 случаев из 68). Для сравнения: в 2014 г. на его долю приходилось 9% (8 из 89 случаев лабораторно-подтвержденных случаев ГФМИ), в 2015 г. – 5% (5 из 104), в 2016 г. – 28% (17 из 61) (рис. 3).
В 2014–2016 гг. среди заболевших ГФМИ, вызванными менингококками серогрупп А, В и С, дети до 15 лет составляли более половины (52, 69 и 64% соответственно), а при W-ГФМИ на их долю приходилось лишь 32% случаев (рис. 4).
В 2016–2017 гг. самый высокий уровень летальности среди больных ГФМИ отмечен при W-ГФМИ как в Москве (27%, 10 летальных исходов из 37 случаев), так в РФ в целом (29%, 8 из 28 случаев). Показатель летальности от ГФМИ, обусловленной NmA, составил 7% (3 из 43 случаев), NmB – 21% (27 из 127), NmC – 27% (25 из 92).
Обсуждение
В базе данных PubMLST на сегодняшний день содержится информация о 44 российских штаммах, вызвавших W-ГФМИ в 1999–2017 гг. Из них 32 (73%) имеют сиквенс-тип ST-11 и (за одним исключением) антигенный профиль P1.5,2:F1-1, то есть обладают генетическими и антигенными характеристиками, описанными ранее у представителей гипервирулентного клонального комплекса сс11 [16]. В подавляющем большинстве случаев антигенная и генетическая характеристика NmW была выполнена при молекулярно-биологическом мониторинге на территории Москвы, результаты представлены в работе С.В. Матосовой и соавт. [33]. Поскольку «классическое» МЛСТ, основанное на характеристике 7 генных фрагментов, не обладает дискриминирующей способностью, достаточной для определения подсемейств внутри сс11 [16, 17], 3 клинических образца и 1 штамм были исследованы методом массового параллельного секвенирования. В работе К.О. Миронова и соавт. [34] были определены дополнительные антигенные и генетические характеристики 4 NmW, согласно которым 3 из них имеют аллель 9 гена FHbp, соответствующий хадж-клону, и 1 – аллель 22, соответствующий южноамериканскому клону. Типирование на основании 16s-фрагмента рибосомальной РНК показало наличие у этих штаммов отличных от хадж-клона аллелей 5 и 72, в то время как для хадж-клона характерен аллель 31. Анализ расширенного профиля МЛСТ, определенного на основании массового параллельного секвенирования, также свидетельствует о циркуляции на территории Москвы как минимум 2 клонов возбудителей, принадлежащих клональному комплексу сс11 [34].
Заключение
Таким образом, проблема повышения заболеваемости W-ГФМИ коснулась и России, с 2013 г. отмечается ежегодный рост числа случаев. Впервые NmW занял первое место в этиологической структуре ГФМИ в Москве, его доля в 2017 г. среди лабораторно подтвержденных случаев составила 29%. Отмечен высокий показатель летальности от W-ГФМИ – 29%. В возрастной характеристике заболевших W-ГФМИ 65% составили лица 15–45 лет. Получена молекулярно-генетическая характеристика штаммов NmW, согласно которым из 43 исследованных методом МЛСТ российских штаммов NmW 72% составляют штаммы с гипервирулентным аллельным профилем. Применение метода массового параллельного секвенирования позволило получить дополнительные антигенные и генетические характеристики 4 штаммов. Необходим пристальный надзор за менингококковой инфекцией и более широкое применение полногеномного секвенирования штаммов, учитывая, что обычного молекулярного секвенирования-типирования для их описания недостаточно. При дальнейшем росте заболеваемости W-ГФМИ, а также учитывая быстроту распространения гипервирулентного штамма, высокую летальность и доступность безопасной и эффективной вакцины, необходимо принятие решения об увеличении охвата населения вакцинацией против менингококковой инфекции для предотвращения дальнейшего роста заболеваемости.



