Клещевой энцефалит (КЭ) остается одной из самых актуальных природно-очаговых вирусных инфекцией [1–8]. Частота клинических форм острого КЭ у детей, по данным разных авторов, различается в зависимости от региона. Наиболее тяжелыми являются формы с поражением нервной системы: менингеальная регистрируется у 30–87,1% детей, очаговые – у 4,9–50% [1–14]. Особенностью заболевания является возможность развития ацикличного двухволнового течения, которое у детей встречается в 1,5–2 раза чаще, чем у лиц старше 18 лет [1–5, 9–11]. Доказана возможность формирования после перенесенного острого КЭ иммунных дисфункций, поскольку вирус КЭ поражает нервную и иммунную системы [15, 16]. Особенности состояния иммунной системы могут влиять на эффективность иммунологического реагирования и явиться причиной более тяжелого, ацикличного течения и неблагоприятного исхода инфекционного заболевания с высоким риском инвалидизации [1, 2, 5, 17].
Цель исследования – изучение особенностей иммунного ответа при двухволновом течении менингеальной формы КЭ у детей школьного возраста в зависимости от наличия клинических признаков иммунных дисфункций в анамнезе.
Материалы и методы
В работе обобщены результаты наблюдения и обследования 62 детей 7–14 лет с острым КЭ (менингеальная форма, двухволновое течение). Критериями включения являлись подтвержденный КЭ, менингеальная клиническая форма, двухволновое течение, отсутствие микст-инфекции. Иммунологическое обследование проводили в динамике на 1, 2 и 3-й неделе болезни.
Пациенты в зависимости от наличия клинических признаков иммунных дисфункций в анамнезе (рецидивирующий инфекционный синдром) разделены на 2 группы: в 1-ю были включены дети без отягощенного анамнеза (n = 30), во 2-ю – дети с клиническими признаками иммунных дисфункций в анамнезе (n = 32). Проявлениями инфекционного синдрома были рецидивирующие заболевания кожи и подкожной клетчатки (фурункулез) (n = 1); рецидивирующие и хронические заболевания органов дыхания (пневмонии, осложненные пневмонии) (n = 2); ЛОР-органов (повторные гнойные отиты, тонзиллиты) (n = 9); повторные респираторные вирусные инфекции, типичные, или затяжные, и/или осложненные (n = 17); рецидивирующие герпетические инфекции (n = 3).
В контрольную группу вошли дети 7–14 лет (n = 34), не имеющие острых заболеваний последние 6 мес., без клинических признаков иммунных дисфункций в анамнезе.
Диагноз КЭ выставляли на основании эпидемиологического анамнеза, клинической картины заболевания, лабораторных данных и подтверждали обнаружением IgM к вирусу КЭ в крови методом ИФА с использованием наборов «ВектоВКЭ-IgМ» (АО «Вектор-Бест», Новосибирск).
В работе использованы иммунологические тесты 1-го и 2-го уровня. Оценивали все иммунологические показатели в гепаринизированной (25 ЕД/мл) венозной крови, забор которой проводили утром натощак в одно и то же время. Определяли дифференцировочные антигены лимфоцитов (расширенная панель моноклональных антител, проточный лазерный цитофлуориметр Becton Dickinson Facscan, США), IgA, IgM, IgG методом диффузии в геле по Манчини, фагоцитарную активность нейтрофилов с латексом (Фп), уровень циркулирующих иммунных комплексов (ЦИК), проводили НСТ-тест, рассчитывали коэффициент стимуляции (КС).
Исследования проведены на базе ГЛПУ ТО «Перинатальный центр» (Тюмень). Тюмени.
Полученные данные были подвергнуты статистической обработке с помощью пакета прикладных программ Windows XP (Excel), «Биостатистика» для Windows v.4.03. Проверку нормальности распределения изучаемых показателей производили методом визуализации и вычисления критерия Колмогорова–Смирнова, сравнение двух средних – с помощью t-критерия Стьюдента. В F-тесте определяли равенство дисперсий. T-тест с неравными дисперсиями применяли при отклонении гипотезы о равенстве дисперсий. Рассчитывали среднее значение (M) и стандартную ошибку среднего (m). Различия считали достоверными при p ≤ 0,05.
Результаты
При анализе маркеров дифференцировки и активации клеточного звена иммунитета выявлено, что для двухволнового течения КЭ характерно снижение количества CD3+- и CD7+-лимфоцитов, которое регистрировали на протяжении всего периода наблюдения (3 нед.) (табл. 1).
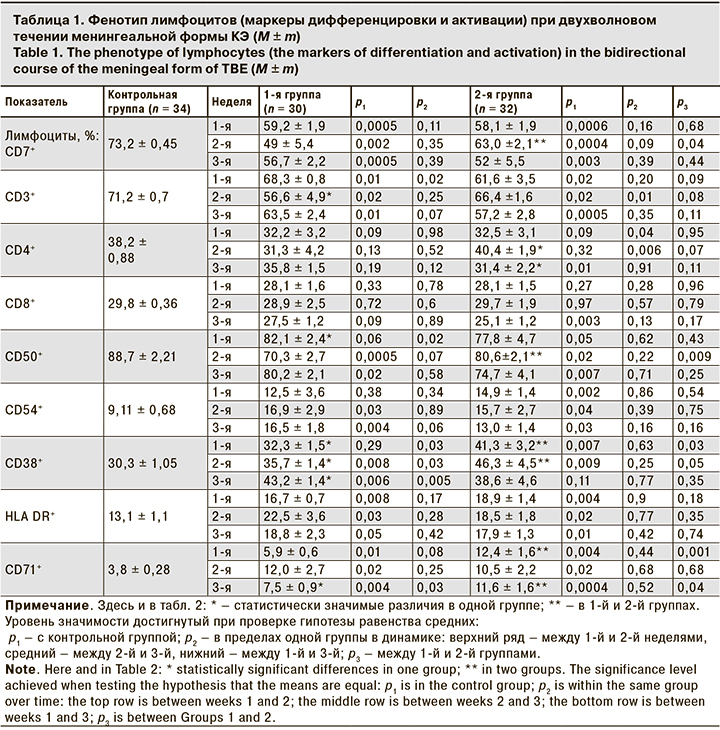
Показатели CD4+-лимфоцитов не имели значимых отклонений, снижаясь у детей 2-й группы к 3-й неделе. Аналогичная динамика была и со стороны CD8+-лимфоцитов.
Повышение экспрессии активационных маркеров (HLA-DR+- и CD71+-лимфоцитов) отмечено у пациентов обеих групп на протяжении всего периода наблюдения. У детей 2-й группы на 1-й и 3-й неделе активация была более выражена– повышение экспрессии CD71+-лимфоцитов в 4 раза (в 1-й группе только в 2 раза). Повышение количества CD38+-лимфоцитов, отражающее раннюю активацию Т- и В-клеток, зафиксировано у детей 1-й группы на 2-й и 3-й неделе, а у детей 2-й группы– на 1-й и 2-й неделе КЭ. Повышение экспрессии CD38+-лимфоцитов у пациентов 2-й группы оказалась больше – на 36 и 53% на 1-й и 2-й неделе (у пациентов 1-й группы – на 7 и 18% соответственно). Количество CD50+-лимфоцитов снижалось у пациентов 1-й группы на 2-й и 3-й неделе, у пациентов 2-й группы – на протяжении всего периода исследования. Уровень CD54+-лимфоцитов возрастал у всех детей, но во 2-й группе раньше (уже с 1-й недели КЭ).
Результаты исследования гуморального и неспецифического звеньев иммунитета представлены в табл. 2.
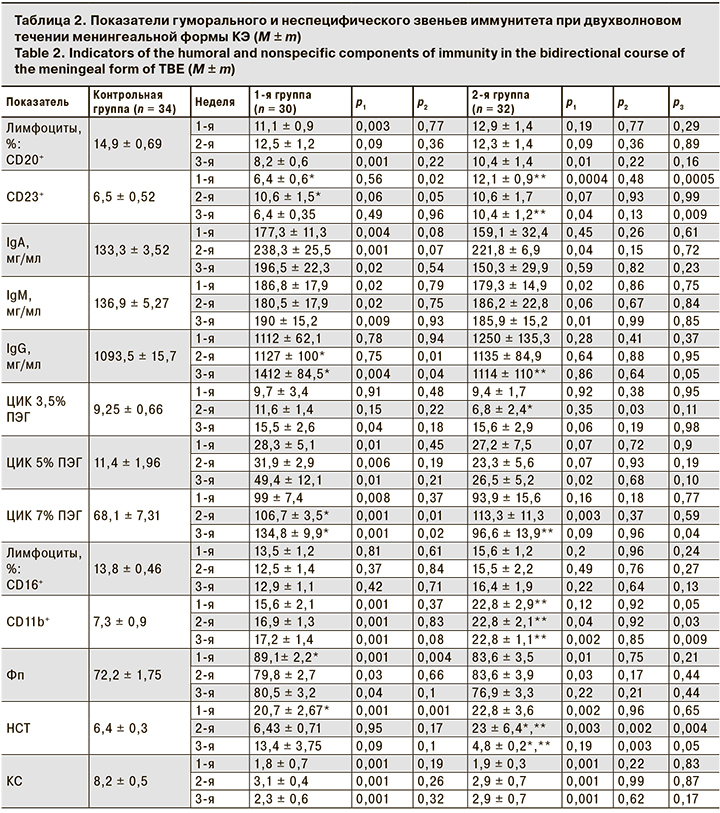
При анализе изменений со стороны гуморального звена иммунитета выявлено снижение количества CD20+-лимфоцитов у детей 1-й группы уже на 1-й неделе с сохранением в фазу исходов, а во 2-й группе эти изменения отмечены только на 3-й неделе заболевания. Динамика уровня CD23+-лимфоцитов была различной: у пациентов 2-й группы он был повышен на протяжении всего исследования, а в 1-й группе изменения отсутствовали.
Различия выявлены и при сравнении уровней Ig. По результатам нашего исследования у детей 1-й группы концентрации IgA и IgM были повышены на протяжении 3 нед., а нарастание IgG отмечено только после 7-го дня болезни. У пациентов 2-й группы регистрировали гипериммуноглобулинемию М в течение 3 нед., повышение синтеза IgА на 2-й неделе болезни; возрастания IgG не отмечено, что свидетельствует о более позднем переключении на вторичный тип иммунного ответа.
На протяжении всего периода наблюдения у всех детей были повышены концентрации средне- и низкомолекулярных ЦИК, а концентрации крупномолекулярных ЦИК возрастали к фазе исходов.
Достоверных изменений количества CD16+-лимфоцитов выявлено не было. На протяжении всего периода наблюдения была повышена экспрессия CD11b (показатель функциональной активности натуральных киллеров), в большей степени у детей 2-й группы. Рост фагоцитарной активности нейтрофилов был зафиксирован в динамике у всех пациентов. Параллельно происходила активация метаболической активности нейтрофилов, длительнее сохраняющаяся во 2-й группе. У всех пациентов отмечали снижение функционального резерва нейтрофилов.
Обсуждение
В данном исследовании предпринята попытка изучить некоторые аспекты иммунного ответа при ацикличном течении КЭ в зависимости от наличия иммунных дисфункций в анамнезе.
Выявленные изменения со стороны клеточного звена в виде снижения количества CD3+- и CD7+-лимфоцитов согласуются с данными других авторов [3–5, 11]. В то же время за весь период наблюдения мы не зарегистрировали значимых отклонений количества CD4+- и CD8+-лимфоцитов в обеих группах. Изменение данных показателей имело место только на 3-й неделе у детей 2-й группы. Выявленные данные частично не согласуются с литературными источниками [3–5, 11], где чаще описаны выраженный дефицит Т-хелперов, который сохраняется в течение 3 мес. после болезни, и активация Т-супрессоров. Зарегистрированные нами результаты, вероятнее всего, связаны именно с ацикличным течением КЭ.
Сроки появления антител к вирусу КЭ различны и связаны не только с возрастом, но и с клинической формой и вариантами течения. Острый период заболевания сопровождается нарастанием концентраций всех классов плазменных Ig в течение 3 нед. [4, 5, 11]. Результаты нашего исследования согласуются с этим фактом, но зарегистрированы различия в зависимости от преморбидного фона ребенка – дети с иммунными дисфункциями в анамнезе отличались сохранением высоких уровней IgM на протяжении всего периода наблюдения.
Проведенное исследование показало, что ацикличное течение менингеальной формы КЭ у детей школьного возраста сопровождается изменением всех звеньев иммунной системы. Значимые отклонения затрагивают клеточное звено иммунитета и проявляются длительной Т-лимфопенией, повышением активационных маркеров (HLADR, CD50+-, CD54+, CD38+- и CD71+-лимфоцитов), отсутствием достоверного снижения количества CD4+- и CD8+-лимфоцитов. Со стороны гуморального и неспецифического звеньев иммунитета типичными для большинства детей были уменьшение пула CD20+-лимфоцитов, повышение уровня Ig всех классов, возрастание фагоцитарной активности нейтрофилов с дефицитом функционального резерва.
Заключение
Иммунный ответ при менингеальной форме ацикличного течения КЭ имеет особенности в зависимости от преморбидного состояния иммунной системы. У детей с клиническими признаками иммунных дисфункций в анамнезе в виде рецидивирующего инфекционного синдрома преобладают процессы активации клеточного и гуморального звеньев, более позднее переключение на вторичный тип иммунного ответа.



