Своевременное начало этиотропной терапии гриппа сокращает продолжительность болезни и период восстановления после нее [1].
Позднее начало либо отсутствие этиотропной терапии являлось одной из причин неблагоприятного исхода пневмонии, вызванной вирусом пандемического гриппа A(H1N1)pdm2009 [2, 3].
Известно, что прием препаратов против вирусов гриппа наиболее эффективен в первые 48 ч после появления симптомов инфекции [4, 5].
В этой связи крайне важно как можно раньше диагностировать заболевание. Однако, несмотря на то что симптомы гриппа хорошо знакомы практикующим врачам, точность клинической диагностики ограничена по ряду причин. Во-первых, другие патогены также способны вызывать симптомы, сходные с гриппом [6–10]. Во-вторых, исследования показывают, что характерные симптомы гриппа проявляются не у всех пациентов. В одном из ретроспективных исследований было установлено, что клинический диагноз «грипп» был поставлен только 29% пациентов с лабораторно-подтвержденным гриппом [11]. Кроме того, у детей, особенно младшего возраста, нередки случаи сочетанного инфицирования несколькими патогенами, что может изменять типичную клиническую картину гриппа.
В связи с этим требуется лабораторное подтверждение гриппа.
Современные методы лабораторной диагностики позволяют установить этиологический диагноз гриппа или другой инфекции дыхательных путей с различной скоростью – от 20 мин до нескольких дней.
С целью лабораторного подтверждения гриппа проводится обнаружение РНК вирусов гриппа методами амплификации нуклеиновых кислот (НК), выявление антигенов с использованием метода иммунохроматографии (ИХА), иммуноферментного анализа, иммунофлуоресценции, а также обнаружение специфических антител в парных сыворотках крови и выделение вирусов гриппа в культуре клеток.
Наиболее чувствительным и специфичным методом лабораторного подтверждения гриппа в настоящее время является полимеразная цепная реакция с детекцией в режиме реального времени (ПЦР-РВ), которая показывает высокие диагностические характеристики, сравнимые с выделением вирусов гриппа [12, 13]. При этом ПЦР-РВ лишена недостатков вирусологического исследования – продолжительности и трудоемкости, по причине которых выделение вирусов не проводится в рутинной практике.
Однако ПЦР-РВ занимает до 5 ч, поэтому экспресс-тесты, которые можно выполнять «у постели больного», особенно востребованы в клинической практике.
Целью настоящего исследования являлась оценка диагностической значимости обнаружения антигенов вирусов гриппа методом иммунохроматографии (ИХА) в сравнении с ПЦР-РВ, определение возможностей и ограничений при использовании тестов на основе ИХА и их места в алгоритме диагностики гриппа.
Материалы и методы
Обследованы 211 детей, поступивших с гриппоподобными симптомами в отделение неотложной педиатрии ФГАУ «Национальный медицинский исследовательский центр здоровья детей» Минздрава России (далее – НЦЗД) в феврале–марте 2015 г. (19 детей), в феврале–марте 2016 г. (5 детей) и с декабря 2016 г. по март 2017 г. (187 детей). При поступлении фиксировали дату начала заболевания (1–9-й день болезни, в среднем 2,48±1,74 день) и проводили сбор биологического материала для лабораторного исследования. Мазки из носоглотки (парные образцы из двух ноздрей) были собраны согласно инструкциям производителей использованных в работе наборов реагентов.
ИХА выполняли в НЦЗД сразу после сбора мазка согласно инструкции к набору реагентов «Influenza A+B» производства «Vegal Pharmaceutica» (Испания). Предел детекции составляет 4,7 нг/мл HA для Influenza virus A и 18,75 нг/мл HA для Influenza virus B; чувствительность и специфичность теста в сравнении с другими коммерческими быстрыми тестами составляет > 99%1.
Мазки для ПЦР-РВ замораживали и хранили при минус 18–20 °С до исследования. В носоглоточных мазках с использованием наборов «АмплиСенс®» производства ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора (Москва) выявляли НК вирусов гриппа В (Inf B) и А (Inf A) с идентификацией субтипов A (H3N2) и A(H1N1)pdm09, а также других респираторных вирусов, включая респираторно-синцитиальный вирус (hRSv), аденовирусы (hAdv), метапневмовирус (hMpv), бокавирус (hBov), вирусы парагриппа 1–4-го типов (hPiv), коронавирусы (hCov), риновирус (hRv), и атипичных бактерий Mycoplasma pneumoniae и Chlamydophila pneumoniae.
Статистическую обработку данных проводили с помощью программы IBM SPSS Statistics for Windows, версия 18.0 (IBM Corp, Armonk, NY) с использованием критерия согласия χ2 или точного критерия Фишера, ROC-анализа, t-теста для сравнения количественных параметров, а также программы статистического анализа результатов биомедицинских исследований StatsToDo2 с применением методов предсказательной статистики. Различия считали статистически значимыми при p < 0,05.
Результаты
По результатам ПЦР-РВ грипп был подтвержден у 132 (62,6%) из 211 детей, из них РНК вируса гриппа А обнаружена у 92 детей [у 88 – А(H3N2) и у 4 – А(H1N1)pdm09], вирус гриппа В – у 40 детей, из них в 1 случае – вирус гриппа В в ассоциации с аденовирусом.
Методом ИХА антигены вирусов гриппа А и В выявлены у 54 (25,6%) и 12 (5,7%) детей соответственно.
У 48 (22,8%) детей обнаружены НК других респираторных вирусов, у 1 ребенка (0,5%) – C. pneumoniae. В совокупности методом ПЦР искомые возбудители острой респираторной инфекции были определены у 181 (85,8%) детей, из них у 8 отмечена сочетанная инфекция (табл. 1).
Диагностические характеристики определения антигенов вирусов гриппа методом ИХА [диагностическую чувствительность (ДЧ), диагностическую специфичность (ДС), отношение правдоподобия положительного результата (ОП+), отношение правдоподобия отрицательного результата (ОП-), посттестовую вероятность (ПостТВ)] оценивали в сравнении с данными ПЦР-РВ. Результаты представлены в табл. 2.
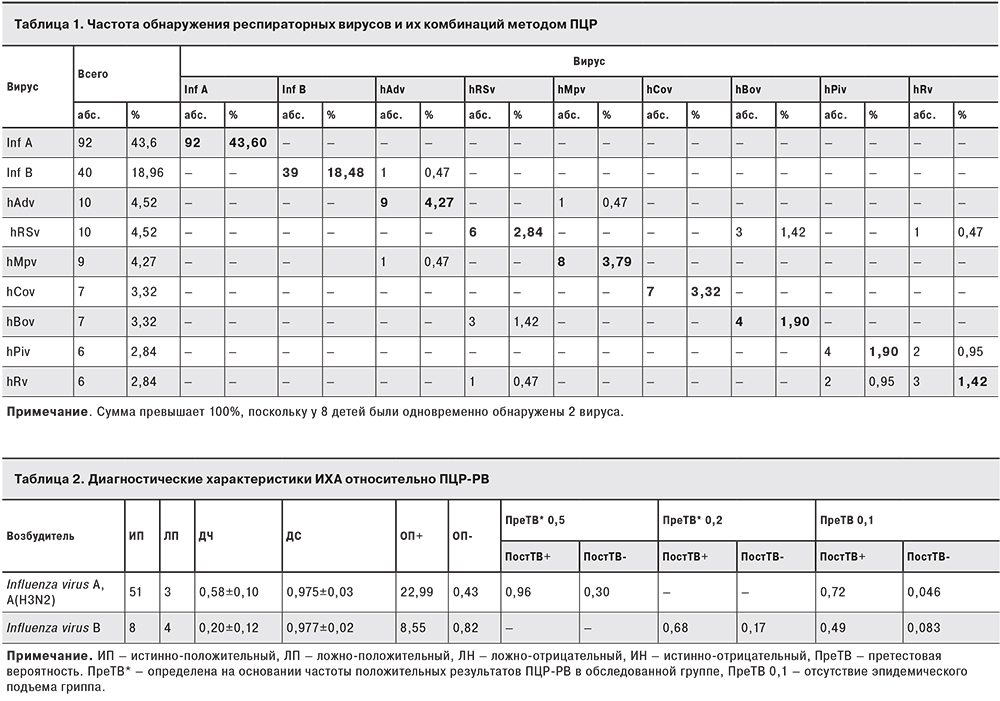
При проведении ПЦР-РВ дополнительно использовали условия, позволявшие оценить концентрацию РНК вирусов гриппа в исследуемых образцах (табл. 3). Уровень репликации вирусов гриппа (концентрация РНК), при инфекции вирусом гриппа A(H3N2) оказались выше, чем при гриппе В: средняя и максимальная концентрации РНК вируса гриппа А(H3N2) были выше, чем вирусов гриппа В на 0,7 lg и 2,3 lg, соответственно.
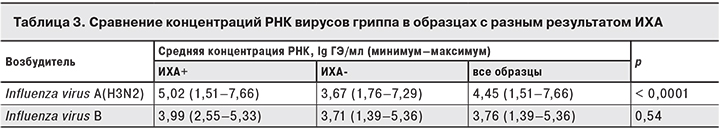
Результаты сравнения показывают, что образцы, положительные в ИХА на грипп A, в среднем имели достоверно большую нагрузку РНК вирусов гриппа, чем отрицательные в ИХА, но минимальная и максимальная концентрации РНК вируса гриппа A(H3N2) в ИХА-положительных и ИХА-отрицательных образцах были практически одинаковыми. Между ИХА-положительными и ИХА-отрицательными по гриппу В образцами различий в концентрации РНК вируса гриппа В не обнаружено.
Положительный результат ПЦР по гриппу А(H3N2) был получен у детей, поступивших с 1-го по 9-й день болезни (средний срок – 2,47±1,88 дня). Среди них положительный результат ИХА наблюдался у поступивших в 1–8-й день (средний срок – 2,0±1,4 дня), отрицательный результат – у болеющих от 1 до 9 дней, то есть в среднем на 1 день позже – 3,1±2,2 дня (p = 0,01). Анализ ROC-кривых показал наличие тенденции увеличения частоты положительных результатов ИХА (повышение ДЧ) по мере сокращения срока болезни на момент обследования, которая достигаля максимума (70%) при обследовании в 1–2-й день заболевания. При увеличении сроков болезни диагностическая чувствительность падала. В выборке детей, болевших гриппом А, подтвержденным данными ПЦР-РВ, обследованных после 2 дней заболевания, антигены гриппа А методом ИХА были обнаружены только в 42% случаев.
Положительный результат ПЦР по гриппу В наблюдался у детей, поступивших в 1–7-й день болезни (средний срок – 3,10±1,78 дня). Для детей с положительными и отрицательными результатами ИХА различий по продолжительности болезни на момент обследования обнаружено не было (3,5±1,38 и 3,03±1,85 дня соответственно; p = 0,5). Положительные результаты наблюдались во 2–5-й день болезни, отрицательные – в 1–7-й день.
Обсуждение
РНК гриппа А обнаружена у 92 детей, РНК гриппа В – у 40, тогда как антигены вируса гриппа А и В выявлены у 54 и 12 детей соответственно.
Таким образом, ДЧ ИХА по обнаружению антигенов вируса гриппа А(H3N2) оказалась довольно низкой (58%), а вируса гриппа В – еще ниже (20%) при довольно высокой ДС.
Наши данные согласуются с результатами других исследователей, сообщающих о высокой (> 90%) специфичности «быстрых тестов» и варьирующей от низкой (20%) до средней (70%) чувствительности [14–19].
Если тест обладает высокой специфичностью, можно доверять его положительным результатам. Если тест обладает высокой чувствительностью, можно доверять его отрицательным результатам. И наоборот: нельзя доверять отрицательным результатам теста, имеющего низкую чувствительность.
Определенный нами во время циркуляции вируса гриппа А(H3N2) показатель ОП+ = 22,99 говорит о том, что если получен положительный результат ИХА на грипп А, то с высокой вероятностью у пациента действительно грипп А. Об этом свидетельствует и высокая ПостТВ положительного результата – 96%.
Однако ИХА показал невысокую ценность для исключения диагноза «грипп А» (ОП- = 0,43), поскольку не позволял с высокой вероятностью исключать грипп, имея недостаточно высокую чувствительность. ПостТВ отрицательного результата также оказалась очень низкой (30%).
В случае вирусов гриппа В тест ИХА имел небольшую диагностическую (ОП+ = 8,55) и прогностическую (ПостТВ+ = 68%) ценность, и оказался бесполезным для исключения диагноза «грипп» (ОП- = 0,82, ПостТВ- = 17%), поскольку пропускал очень много истинно положительных образцов.
Следует учитывать, что позитивное предсказательное значение результатов ИХА будет ниже в периоды низкой активности вирусов гриппа [20]. Если в периоды высокой активности гриппа (при высокой распространенности вирусов среди людей в сообществе) положительная прогностическая ценность результатов теста высока (высока вероятность истинно положительного результата), то когда распространенность гриппа в сообществе низка, что обычно происходит в начале и конце сезона гриппа или периодов, когда вирусы гриппа не циркулируют, ложноположительные результаты будут возникать чаще, чем истинно положительные. В спокойные по гриппу периоды ПостТВ положительного результата ИХА будет менее 72% для вируса гриппа А и менее 49% – для вируса гриппа В (см. табл. 2). Таким образом, до начала эпидемического подъема гриппа для его подтверждения следует применять ПЦР-РВ, поскольку экспресс-тесты в этом случае имеют низкое прогностическое значение.
Во время набора образцов вирус пандемического гриппа A(H1N1)pdm09 был незначительно представлен в циркуляции, поэтому для оценки диагностических характеристик теста по обнаружению этого вируса данных недостаточно. Однако полученные результаты вызывают вопросы о специфичности анализа: для всех четырех образцов, содержащих РНК вируса гриппа A (H1N1pdm09), результат теста по выявлению антигенов вируса гриппа А был отрицательным, но оказался положительным на антигены вируса гриппа В. В этой связи необходимо продолжить изучение диагностической ценности ИХА для выявления вируса пандемического гриппа A(H1N1pdm09) с набором данного и других производителей.
Тот факт, что минимальная и максимальная концентрации РНК вирусов гриппа в ИХА-положительных и ИХА-отрицательных образцах были практически одинаковыми, говорит о том, что невысокая ДЧ ИХА связана не с низкой нагрузкой возбудителя, а с другими причинами.
Одной из них может быть плохая воспроизводимость качества хроматографических мембран и нанесения антител при производстве тест-полосок в связи со сложностью осуществления выходного контроля качества.
Кроме того, возможно несоответствие используемых при производстве антител антигенным эпитопам циркулирующих вирусов гриппа. Примером такого несоответствия явилась ситуация, возникшая в 2009 г., когда вирус пандемического гриппа A (H1N1)pdm09 слабо или совсем не обнаруживался имевшимися тогда «быстрыми тестами» [21].
Другой причиной может быть снижение ДЧ ИХА по мере увеличения сроков заболевания. Например, показано, что уровень антигенов hBov в назофарингеальных мазках, начиная с 3-го дня заболевания, падает до порога чувствительности теста иммунофлуоресценции [22].
Мы не обнаружили строгой зависимости результатов ИХА от сроков заболевания на момент обследования: ложноотрицательные результаты были получены в период от 1 до 9 дней болезни при гриппе А и от 1 до 7 дней – при гриппе В, однако выявлена тенденция повышения чувствительности диагностики гриппа А методом ИХА при обследовании детей в первые двое суток от момента появления симптомов инфекции.
Выводы
- Во время подъема заболеваемости гриппом, вызванным известным субтипом вируса гриппа А, можно применять экспресс-тесты, но при условии, что доказана их высокая специфичность, тогда положительный результат ИХА может с высокой вероятностью подтверждать клинический диагноз «грипп».
- Отрицательный результат ИХА на грипп не может служить исключением диагноза «грипп», поскольку чувствительность экспресс-тестов недостаточна. Поэтому во время эпидемии гриппа ИХА-отрицательные образцы, необходимо исследовать методом ПЦР-РВ. Независимо от эпидемической активности вирусов гриппа для исключения диагноза «грипп» необходимо применять ПЦР-РВ.
- Сбор клинического материала для ИХА нужно проводить как можно раньше – в первые 2 дня от появления симптомов заболевания и строго по инструкции производителя теста. В более поздние сроки обследования метод ИХА малоинформативен.
- Метод ПЦР-РВ позволяет обнаруживать РНК вирусов гриппа на более поздних сроках заболевания, однако в случае инфекции нижних дыхательных путей исследованию подлежат не мазки из носоглотки и ротоглотки, в которых содержание вирусов может быть ниже [2], а мокрота, эндотрахеальный аспират3 и лаважная жидкость [5].
- ИХА малоинформативен для диагностики гриппа В, поэтому во время циркуляции вируса гриппа В (как правило, с февраля до конца весны) для подтверждения диагноза целесообразно применять ПЦР-РВ.
- Помимо вирусов гриппа в сообществе циркулируют и другие возбудители инфекций дыхательных путей, зачастую вызывающие сходную с гриппом клиническую картину, этиология которых может быть уточнена с помощью ПЦР-РВ.



