1) Yekaterinburg Research Institute of Viral Infections, State Research Center of Virology and Biotechnology «Vector», Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Yekaterinburg, Russia;
2) «New Hospital» Medical Association, Yekaterinburg, Russia;
3) Ural State Medical University, Ministry of Health of Russia, Yekaterinburg, Russia
Objective. To identify the impact of tick-borne encephalitis-borreliosis co-infection (TBEBCI) on the incidence of severe forms of tick-borne viral encephalitis (TBVE) in patients with a history of different options for specific prevention, as well as in its absence.
Subjects and methods. Case histories were analyzed in patients with confirmed diagnoses of TBE (n = 246) and TBVEBCI (n = 208 cases).
Results. TBE was found to be associated with a mixed viral-bacterial infection of TBEBCI in 45.8% of cases. The incidence of severe focal forms of the disease was shown to be 1.5 times lower in the group of patients simultaneously infected with the two pathogens while the percentage of persons with mild febrile TBE was 1.4 times higher than in the group of patients with monoinfection, which suggests that the course of the disease associated with mixed infection is more favorable.
Conclusion. Ixodid TBEBCI reduces the risk of severe forms of TBE in patients with and with no history of different options for specific immunoprophylaxis against TBEV. The individuals vaccinated against TBE have the lowest risk of both TBE and TBVEBCI. At the same time, active immunization of the population most effectively protects the vaccinated against severe forms of the disease.
tick-borne viral encephalitis
Lyme borreliosis
mixed infection
clinical forms
immunoprophylaxis
Инфекции, передающиеся иксодовыми клещами, составляют как в России, так и на территории Европейского союза значительную часть всех случаев природно-очаговых инфекций – от 10 до 25% ежегодно [1–5]. Наибольшее распространение и актуальность имеют клещевой вирусный энцефалит (КВЭ) и иксодовый клещевой боррелиоз (ИКБ, болезнь Лайма), природные очаги которых ввиду общих переносчиков и резервуаров инфекции, как правило, являются сочетанными [6, 7].
Клинико-патогенетические аспекты моноинфекций КВЭ и ИКБ достаточно хорошо изучены, однако имеющиеся сведения об особенностях клинических проявлений сочетанной клещевой энцефалит-боррелиозной инфекции (СКЭБИ) противоречивы. Рядом авторов установлено, что микст-формы клещевых инфекций имеют относительно благоприятное течение и исход [8, 9]. В то же время имеются данные о том, что одновременное заражение вирусом клещевого энцефалита (ВКЭ) и Borrelia burgdorferi s.l. способствует развитию более тяжелых клинических форм КВЭ и ухудшает прогноз заболевания [10, 11].
Ранее было показано, что рост иммунной прослойки населения в период многолетнего проведения массовой вакцинопрофилактики сопровождался неуклонным снижением заболеваемости и существенным увеличением доли лихорадочной формы КВЭ при одновременном снижении процента менингеальной формы. При этом доля тяжелых очаговых форм не снижалась, достигая в отдельные годы 30–40% случаев КВЭ [12, 13]. В связи с этим возник вопрос о причинах такого явления и возможной роли вирусно-бактериальной коинфекции в развитии тяжелых форм КВЭ.
Учитывая тот факт, что среди больных КВЭ на территории Свердловской области около 15% составляли пациенты, ранее привитые против этой инфекции, а еще около 30% были из группы ранее не привитых, получивших экстренную иммунопрофилактику [14, 15], представляется целесообразным выяснить возможное влияние коинфекции ИКБ на возникновение тяжелых форм заболевания у лиц, имеющих и не имеющих в анамнезе различные варианты иммунопрофилактики против КВЭ (вакцинация/ревакцинация, серопрофилактика).
Цель исследования – выявить влияние СКЭБИ на частоту возникновения тяжелой очаговой формы КВЭ у пациентов с наличием в анамнезе различных вариантов специфической профилактики против КВЭ, а также при ее отсутствии.
Материалы и методы
В качестве источников информации использованы данные форм федерального статистического наблюдения № 1 и № 2 «Сведения об инфекционных и паразитарных заболеваниях», формы № 60 «Журнал учета инфекционных больных», и № 003/У «Медицинская карта стационарного больного». В частности, проанализированы истории болезни 454 пациентов, находившихся на лечении в Екатеринбургском городском центре природно-очаговых инфекций (МО «Новая больница») в период 2010–2017 гг., с подтвержденными диагнозами «КВЭ» (п = 246) и «КВЭ, болезнь Лайма» (п = 208). В каждой группе определяли частоту встречаемости очаговой, менингеальной и лихорадочной форм КВЭ и ИКБ у лиц с наличием в анамнезе специфической профилактики (вакцинация/ревакцинация, экстренная иммунопрофилактика), а также при ее отсутствии. Критерий исключения – моно- и микст-инфекции с моноцитарным эрлихиозом человека, гранулоцитарным анаплазмозом человека по результатам серологического скрининга. В исследование включали пациентов с фактом присасывания клеща или пребыванием в природном очаге (лесной фактор), наличием лихорадочной реакции, неврологической симптоматики, клещевой мигрирующей эритемы. На догоспитальном этапе в 55,5% случаев пациентам вводили специфический иммуноглобулин против клещевого энцефалита (1:160) в стандартной профилактической дозе, в 40% случаев пациенты принимали антибактериальные препараты тетрациклиновой группы. Диагноз КВЭ, болезнь Лайма был установлен после комплексного клинико-лабораторного исследования. Анализировали сыворотки крови и ликвор от пациентов при поступлении в стационар и через 10–14 сут. Специфические антитела IgG к ВКЭ и возбудителям ИКБ (болезни Лайма) выявляли методом ИФА с использованием коммерческих наборов тест-систем производства АО «Вектор-Бест» (Новосибирск).
При описании данных для качественных признаков находили абсолютные и относительные (%) частоты с 95% доверительными интервалами (ДИ), рассчитанными по методу Уилсона (Wilson CI for proportion) [14]. Сравнение независимых выборок по качественным номинальным показателям проводили в ходе анализа таблиц сопряженности с помощью критерия χ2 Пирсона. Для слабонасыщенных таблиц (с ячейками со значениями fij ≤ 5) оценку статистической значимости проводили рандомизационной техникой Монте-Карло (n = 9999). Для выявления ячеек таблицы, давших неслучайный вклад в статистику критерия, рассчитывали согласованные стандартизованные остатки Хабермана (Adjusted residuals – AR).
Анализ на наличие линейного тренда проводили с использованием теста Кохрана–Армитажа (тренд-теста) с одной степенью свободы (Cochran–Armitage test for trend). Различия считали статистически значимыми при p < 0,05.
Статистическая обработка результатов и их визуализация проведены с использованием программного пакета в PAST (v. 3.25, [15]).
Результаты
Данные о частоте встречаемости клинических форм КВЭ у пациентов с моно- и микст-инфекцией представлены в табл. 1.

Из представленных результатов следует, что частота встречаемости очаговой формы КВЭ статистически значимо выше в группе больных с моноинфекцией ВКЭ в сравнении с группой пациентов СКВЭБИ – 35,0и 23,1% соответственно. В то же время в группе больных с коинфекцией значимо выше оказался процент лиц с легкой лихорадочной формой КВЭ – 64,9и 46,7% соответственно).
Вакцинация и экстренная иммунопрофилактика КВЭ (в соответствии с СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней») ранее были проведены в группе больных КВЭ у 105 (42,7%) пациентов, а в группе больных СКЭБИ – у 102 (49,0%). Результаты сравнения частоты встречаемости клинических форм КВЭ у пациентов, не получавших и получавших специфическую иммунопрофилактику против КВЭ, представлены в табл. 2.
В табл. 3 представлены данные о частоте выявления очаговой, менингеальной и лихорадочной форм КВЭ и СКЭБИ у пациентов, имеющих в анамнезе разные виды иммунопрофилактики, и лиц, которым иммунопрофилактика не проводилась.
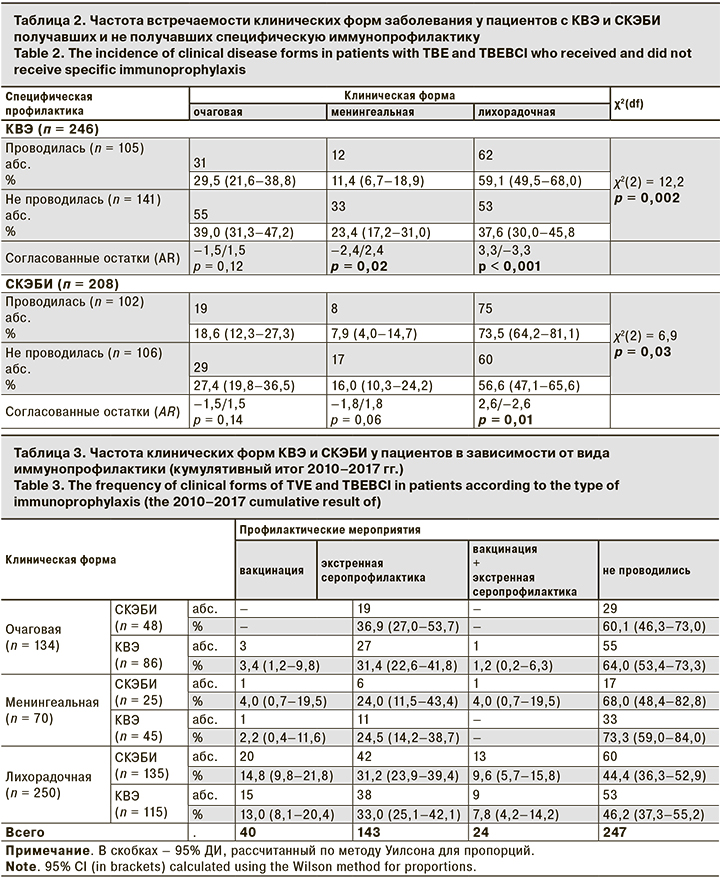
Доля вакцинированных пациентов и лиц, получивших только экстренную иммунопрофилактику, из числа пациентов с КВЭ составила 7,7% (19/246) и 30,9% (76/246) соответственно. В группе больных со смешанной инфекцией доля вакцинированных составила 10,1% (21/208), а получивших противоклещевой иммуноглобулин – 32,2% (67/208).
Обсуждение
В результате проведенных профилактических мероприятий отмечается увеличение доли лихорадочной формы КВЭ среди пациентов как с моно- (в 1,6 раза), так и с микст-инфекцией (в 1,3 раза). В сравниваемых группах не обнаружено статистически значимых различий в частоте возникновения тяжелых очаговых форм заболевания среди лиц, получавших и не получавших специфическую иммунопрофилактику.
Таким образом, существенное повышение доли лихорадочной формы КВЭ среди лиц, получивших тот или иной вид иммунопрофилактики в обеих группах не сопровождалось сокращением доли тяжелых очаговых форм КВЭ, а явилось следствием уменьшения частоты развития менингеальной формы заболевания.
Наибольшее число больных каждой из клинических форм КВЭ составляли лица, не получившие иммунопрофилактику – 54,4% (247/454). На втором месте по численности были непривитые пациенты, которым проводилась экстренная иммунопрофилактика – 31,5% (143/454).
Из 64 пациентов, входящих в группу вакцинированных, 24 37,5%) чел., имеющих дефекты в схеме вакцинации или нарушение временного интервала ревакцинации, дополнительно получили экстренную иммунопрофилактику. В целом доля вакцинированных среди больных КВЭ составила 7,7%, причем в этой группе подавляющее большинство пациентов (78,9%) перенесли лихорадочную форму заболевания.
Проведенные исследования показали, что 45,8% (208/454) случаев заболеваний КВЭ на территории Свердловской области ассоциированы со СКЭБИ. Установлено, что частота встречаемости тяжелых очаговых форм заболевания в группе больных, одновременно инфицированными 2 возбудителями, была в 1,5 раза ниже, а доля лиц с легкой лихорадочной формой КВЭ – в 1,4 раза выше), чем в группе пациентов с моноинфекцией ВКЭ, что свидетельствует о более благоприятном течении СКЭБИ.
Вовлечение нервной системы в патологический процесс как при КВЭ, так и при ИКБ усложняет диагностику и затрудняет лечение микст-инфекции. Некоторые антибактериальные препараты, применяемые при терапии сочетанной вирусно-бактериальной инфекции, способны вызывать иммунодепрессию и активацию персистентной инфекции. Установлено, что среди антибактериальных препаратов сильными активаторами персистентной инфекции являются стрептомицин (группа аминогликозидов), цефамезин (группа цефалоспоринов), ристомицин (полипептидный антибиотик). К группе препаратов, не вызывающих депрессии гуморального иммунитета, относятся гентамицин (аминогликозид), канамицин (аминогликозид), левомицетин (синтетический антибактериальный препарат), флоримицин (аминогликозид). Известно, что применение в лечении комбинации иммуноглобулина человека нормального с антибактериальными препаратами (аминогликозидами, пенициллинами, бета-лактамными антибиотиками) при крайне тяжелом течении КВЭ в сочетании с ИКБ на 25% снижало частоту развития остаточного неврологического дефицита [16, 17].
Клинический полиморфизм ИКБ и КВЭ, отмечаемый на разных эндемичных территориях, возможно, во многом обусловлен гетерогенностью возбудителей, существующей и реализуемой возможностью одновременного инфицирования человека как разными видами боррелий, так и генотипами вируса КВЭ с развитием смешанной инфекции. Анализ частоты, характера и динамики клинических симптомов у больных ИКБ в сочетании с КВЭ на эндемичной территории свидетельствует о нескольких вариантах манифестации инфекционного процесса [18].
Выводы
Коинфекция ИКБ снижает вероятность возникновения тяжелых форм КВЭ у лиц, как имеющих, так и не имеющих в анамнезе различные варианты иммунопрофилактики против ВКЭ.
Наименьший риск заболевания как КВЭ, так и СКЭБИ имеют лица, вакцинированные против ВКЭ. При этом активная иммунизация населения наиболее эффективно защищает вакцинированных от развития тяжелых форм заболевания.
Аргументы в пользу позитивной либо негативной направленности клинического вектора СКЭБИ нуждаются в дальнейшем накоплении информации по данному вопросу и всестороннем ее изучении.
1. Малеев В.В., Ситников И.Г., Алешковская Е.С. Современные эпидемиологические аспекты клещевых трансмиссивных инфекций в Ярославской области. Эпидемиология и инфекционные болезни. Актуальные вопросы 2015; (3): 4–10.
Maleev V.V., Sitnikov I.G., Aleshkovskaya E.S. [Tick-transmitted infections in the Yaroslavl region: current epidemiological aspects]. Epidemiology and infectious diseases. Current items 2015; (3): 4–10. (In Russ.).
2. Миноранская Н.С., Миноранская Е.И. Клинико-эпидемиологическая характеристика микст-инфекции клещевого боррелиоза и клещевого энцефалита в Красноярском крае. Казанский медицинский журнал 2013; 94(2): 211–15.
Minoranskaya N.S., Minoranskaya E.I. [Clinical and epidemiologic characteristics of lyme borreliosis and tick-borne encephalitis mixed infections in Krasnoyarsk kray]. Kazan medical journal 2013; 94(2): 211–15. (In Russ.).
3. Castro L.R., Gabrielli S., Iori A., Cancrini G. Molecular detection of Rickettsia, Borrelia, and Babesia species in Ixodes ricinus sampled in northeastern, central, and insular areas of Italy. Experimental and Applied Acarology 2015; 66(3): 443–52. https://doi.org/10.1007/s10493-015-9899-y
4. Diuk-Wasser M.A., Vannier E., Krause P.J. Coinfection by Ixodes Tick-Borne Pathogens: Ecological, Epidemiological, and Clinical Consequences. Trends in Parasitology 2016; 32(1): 30–42. https://doi.org/10.1016/j.pt.2015.09.008
5. Raileanu C., Moutailler S., Pavel I., Porea D., Mihalca A.D., Savuta G., Vayssier-Taussat M. Borrelia Diversity and Co-infection with Other Tick-Borne Pathogens in Ticks. Frontiers in Cellular and Infection Microbiology 2017; 7 (36): 1–12. https://doi.org/10.3389/fcimb.2017.00036
6. Бондаренко А.Л., Зыкова И.В., Аббасова С.В., Тихомолова Е.Г., Нехорошкина Е.Л. Микст-инфекция клещевого энцефалита и иксодовых клещевых боррелиозов. Инфекционные болезни 2011; 9(4): 54–63.
Bondarenko A.L., Zykova I.V., Abbasova S.V., Tikhomolova E.G., Nekhoroshkina E.L. [Mixed infection of tick-borne encephalitis and ixodes tick-borne borrelioses]. Infectious Diseases 2011; 9(4): 54–63. (In Russ.).
7. Коренберг Э.И., Помелова В.Г., Осин Н.С. Природноочаговые инфекции, передающиеся иксодовыми клещами. M.: ООО Комментарий, 2013. 464 с.
Korenberg E.I., Pomelova V.G., Osin N.S. [Infections with natural focality transmitted by ixodid ticks]. Moscow: OOO Kommentarii, 2013. 464 p. (In Russ.).
8 Иерусалимский А.П. Клещевые инфекции в начале XXI века. Неврологический журнал 2009; 14 (3): 16–20.
Ierusalimsky A.P. [Tick-borne infections early in the XXIth century]. The Neurological Journal 2009; 14 (3): 16–20. (In Russ.).
9. Усков А.Н., Лобзин Ю.В., Бургасова О.А. Клещевой энцефалит, эрлихиоз, бабезиоз и другие актуальные клещевые инфекции в России. Инфекционные болезни 2010; 8 (2): 83–8.
Uskov A.N., Lobzin Yu.V., Burgasova O.A. [Tick-borne encephalitis, ehrlichiosis, babesiosis and other topical tick-borne infections in Russia]. Infectious Diseases 2010; 8(2): 83–8. (In Russ.).
10. Образцова Р.Г., Волкова Л.И., ред. Патоморфоз острого клещевого энцефалита на Среднем Урале. Екатеринбург: Изд-во УрГСХА, Уральское издательство, 2008. 228 с.
Obraztsova R.G., Volkova L.I., ed. [Pathomorphosis of Tick-borne encephalitis in Middle Ural]. Ekaterinburg: UrGSKhA, Ural’skoe izdatel’stvo, 2008. 228 p. (In Russ.).
11. Субботин А.В., Семенов В.А., Этенко Д.А. Проблема современных смешанных нейроинфекций, передающихся иксодовыми клещами. Архивъ внутренней медицины 2012; 2(4): 35–9.
Subbotin A.V., Semenov V.A., Etenko D.A. [The problem of modern mixed neuroinfections transmitted by ixodid ticks]. The Russian Archives of Internal Medicine 2012; 2 (4): 35–9. (In Russ.).
12. Быков И.П., Сергеев А.Г., Топоркова М.Г., Мищенко В.А., Задорожная И.А., Шлыкова Г.И. Популяционный иммунитет и патоморфоз клещевого вирусного энцефалита в условиях мегаполиса. Эпидемиол. инфекц. болезни. Актуал. вопр. 2019; 9(4): 20–7. https://dx.doi.org/10.18565/epidem.2019.9.4.20–7
Bykov I.P., Sergeev A.G., Toporkova M.G., Mishchenko V.A., Zadorozhnaya I.A., Shlykova G.I. [Herd immunity and pathomorphism of tick-borne viral encephalitis under the conditions of a megalopolis]. Epidemiology and infectious diseases. Current items 2019; 9(4): 20–7 (In Russ.). https://dx.doi.org/10.18565/ epidem.2019.9.4.20–7
13. Любезнова О.Н., Бондаренко А.Л. Клинико-эпидемиологические аспекты клещевого энцефалита в эндемичном регионе Европейской части России. Журнал инфектологии 2016; 8 (15): 32–9.
Lyubeznova O.N., Bondarenko A.L. [The clinical and epideiological features of tick-borne encephalitis at the endemical region of Russia’s European part]. Journal Infectology 2016; 8 (15): 32–9. (In Russ.).
14. Sergeant E.S.G. Epitools epidemiological calculators (2019). Ausvet Pty Ltd. http://epitools.ausvet.com.au
15. Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica 2001; 4 (1): 9. http://palaeoelectronica.org/2001_1/past /issue1_01.htm
16. Громова О.А., Этенко Д.А., Семенов В.А., Субботин А.В. Диагностика смешанной инфекции клещевого энцефалита и клещевого боррелиоза на ранних этапах заболевания. Журнал неврологии и психиатрии им. C.C. Корсакова 2013; 113 (4): 9–12.
Gromova O.A., Etenko D.A., Semenov V.A., Subbotin A.V. [Diagnosis of mixed tick-borne encephalitis and tick-borne borreliosis in the early stages of the disease]. S.S. Korsakov Journal of Neurology and Psychiatry 2013; 113 (4): 9–12. (In Russ.).
17. Субботин А.В., Этенко Д.А., Семенов В.А., Щербинина М.С., Погодина В.В., Колясникова Н.М. и др. Случай заболевания смешанной клещевой инфекцией – клещевой энцефалит и боррелиоз (В. garinii, B. afzelii) в Кемеровской области. Медицина в Кузбассе 2017; 16 (4): 101–6.
Subbotin A.V., Etenco D.A., Semynov V.A., Shcherbinina M.S., Pogodina V.V., Kolyasnikova N.M. et al. [The case of mixed tick-borne infections – tick-borne encephalitis and lyme disease (B. garinii, B. afzelii) in the Kemerovo region]. Medicine in Kuzbass 2017; 16 (4): 101–6. (In Russ.).
18. Конькова-Рейдман А.Б., Злобин В.И. Сочетанная инфекция иксодового клещевого боррелиоза и клещевого энцефалита на Южном Урале. Челябинск: Тактик-Студио, 2016. 320 с.
Konkova-Reidman A.B., Zlobin V.I. [Co-infection of ixodic tick-borne borreliosis and tick-borne encephalitis in the Southern Urals]. Chelyabinsk: Taktik-Studio? 2016. 320 p. (In Russ.).
Ivan P. Bykov, Cand. Med. Sci., Senior Researcher, Laboratory of Transmissible Viral Infections and Tick-Borne Encephalitis, Yekaterinburg Research Institute of Viral Infections, State Research Center of Virology and Biotechnology «Vector», Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Yekaterinburg, Russia;
bykov_ip@eniivi.ru; https://orcid.org/0000-0002-5157-646X
Professor Aleksandr G. Sergeev, MD, Principal Researcher, Head, Department of Indication and Diagnosis of Viral Infections, Yekaterinburg Research Institute of Viral Infections, State Research Center of Virology and Biotechnology «Vector», Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Ural State Medical University, Yekaterinburg, Russia;
aldr131250@yandex.ru; https://orcid.org/0000-0002-5784-8673
Vladimir A. Mishchenko, Researcher, Laboratory of Transmissible Viral Infections and Tick-Borne Encephalitis, Yekaterinburg Research Institute of Viral Infections, State Research Center of Virology and Biotechnology «Vector», Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Yekaterinburg, Russia;
mischenko_va@eniivi.ru; https://orcid.org/0000-0003-4280-283X
Ivan V. Vyalykh, Cand. V. Sci., Leading Researcher, Head, Laboratory of Transmissible Viral Infections and Tick-Borne Encephalitis, Yekaterinburg Research Institute of Viral Infections, State Research Center of Virology and Biotechnology «Vector», Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Yekaterinburg, Russia;
vialykh_iv@eniivi.ru; https://orcid.org/0000-0002-3123-8359
Marina G. Toporkova, Cand. Med. Sci., Head, Department of Neurology, «New Hospital» Medical Association, Yekaterinburg, Russia;
m.toporkova@newhospital.ru
Lyudmila G. Vyatkina, Medical Statistician, Ural-Siberian Research Guidance Center for Prevention of Healthcare-Associated Infections, Yekaterinburg Research Institute of Viral Infections, State Research Center of Virology and Biotechnology «Vector», Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Yekaterinburg, Russia;
vyatkina_lg@eniivi.ru; https://orcid.org/0000-0002-1944-3827
Tatiana V. Makhorina, Researcher, Laboratory of Transmissible Viral Infections and Tick-Borne Encephalitis, Yekaterinburg Research Institute of Viral Infections, State Research Center of Virology and Biotechnology «Vector», Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Yekaterinburg, Russia;
mahorina_tv@eniivi.ru; https://orcid.org/0000-0001-6126-9706





