В процессе мониторинга за холерой на территории Российской Федерации холерные вибрионы неО1/неО139 серогрупп в подавляющем большинстве обнаруживают в водных объектах окружающей среды (ООС) [1, 2]. Штаммы V. choleraе nonO1/nonO139 занимают определенное место в этиологии острых кишечных инфекций (ОКИ), хотя и не имеющих тенденции к эпидемическому распространению, но представляющих потенциальную опасность возникновения множественных спорадических случаев и локальных вспышек. Реже встречаются внекишечные формы заболеваний, как правило, поражающие ослабленных людей, у которых может происходить угрожающая жизни генерализация инфекции [3–7]. Стоит отметить, что холерные вибрионы неО1/неО139 серогрупп приспособлены к персистенции в ООС, которые в свою очередь являются природными резервуарами генов факторов патогенности холерных вибрионов [8–10]. Ранее нами были изучены фено- и генотипические свойства 11 штаммов Vibrio cholerae nonO1/nonO139, выделенных от больных в Ростовской области в 2014 г. [11]. В связи с тем, что в период с 2014 по 2018 г. и в других субъектах РФ регистрировались заболевания, этиологическим фактором которых явились штаммы холерных вибрионов неО1/неО139 серогрупп, а также с новыми случаями ОКИ в Ростовской области (2015, 2016, 2018), представляло интерес изучение количественной динамики выделения данных штаммов и их биологических свойств, в том числе для установления возможного происхождения.
Целью настоящей работы явилось изучение динамики обнаружения, серологических и молекулярно-генетических особенностей клинических штаммов V. choleraе nonО1/nonО139, выделенных на территории субъектов РФ в 2014–2018 гг.
Материалы и методы
В работе были использованы 40 клинических культур V. choleraе nonO1/nonO139, поступивших в референс-центр по мониторингу холеры с 2014 по 2018 г., в том числе 11 изученных ранее штаммов, выделенных в Ростовской области в 2014 г. [11]. Идентификацию проводили в соответствии с МУК 4.2.2218-071, серотипирование – c помощью набора диагностических моноспецифических кроличьих сывороток против типовых штаммов холерных вибрионов О2–О84 серогрупп в реакции слайд-агглютинации. ПЦР-типирование осуществляли, как описано ранее [11], с использованием специфических праймеров для детекции 65 генов. Для родовой и видовой идентификации выделенных штаммов был использован метод MALDI-TOF масс-спектрометрии с помощью масс-спектрометра Autoflex-speed Bruker Daltonics (Германия) с программным обеспечением Biotyper [12].
Результаты
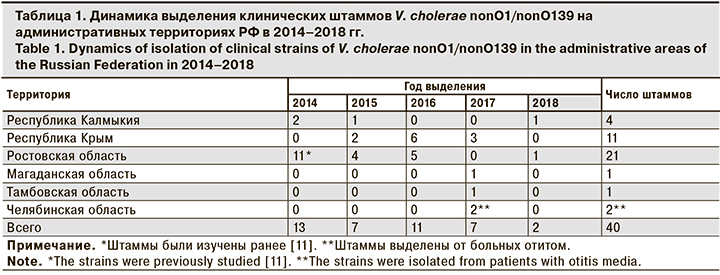
Распределение штаммов холерных вибрионов неО1/неО139 серогрупп, выделенных от 37 человек за пятилетний период, представлено в табл. 1.
Возраст заболевших в России варьировал от 2 до 79 лет, 54,05% составили дети до 9 лет.
Наибольшее число культур выделено от жителей Ростовской области, где от 19 больных с диагнозом ОКИ был изолирован 21 штамм V.cholerae nonO1/nonO139. Пик заболеваемости пришелся на 2014 г. Больные были выявлены в 7 населенных пунктах (города Таганрог и Азов, с. Беглица и Петрушино, п. Тольяти Неклиновский района, с. Кагальник и п. Дарьевка Азовского района). В Республике Крым (г. Керчь) случаи гастроэнтеритов, вызванных указанными микроорганизмами, регистрировали в 2015, 2016 и 2018 гг. В Республике Калмыкия заболевшие выявлено в г. Элиста (2015, 2018) и п. Кетченеры (2014). За изучаемый период отмечено снижение заболеваемости по сравнению с предыдущими годами2. Заболеваемость в Ростовской области, Республиках Крым и Калмыкия регистрировали с июля по сентябрь.
Случаи выделения V.cholerae nonO1/nonO139 от больных в 2017 г. в Тамбове (17.01), Магадане (31.03) и Челябинске (09.09) следует рассматривать отдельно, так как симптомы заболевания развивались у взрослых людей (у 1 пациента в возрасте 44 лет и двоих – 57 лет) после посещения соответственно Таиланда, Вьетнама и Туниса. Следует отметить, что у 2 больных из Челябинска наблюдалась внекишечная форма заболевания (отит).
 Все изученные культуры были типичны по культурально-морфологическим и биохимическим свойствам, а также по результатам MALDI-TOFF масс-спектрометрии; не агглютинировались холерными диагностическими сыворотками О1 и О139; лизировали эритроциты барана в пробе Грейга.
Все изученные культуры были типичны по культурально-морфологическим и биохимическим свойствам, а также по результатам MALDI-TOFF масс-спектрометрии; не агглютинировались холерными диагностическими сыворотками О1 и О139; лизировали эритроциты барана в пробе Грейга.
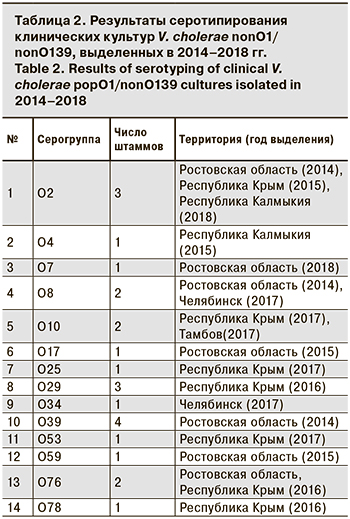
Серотипирование с помощью набора сывороток к 80 серогруппам позволило выявить представителей 14 серогрупп у 24 (60,0 %) культур, 16 (40,0 %) культур не типировались (табл. 2).
Представители О7, О17, О39, О59 серогрупп выявлены у больных только из Ростовской области; О25, О29, О53, О78 серогрупп – из Республики Крым; О4 – из Республики Калмыкия. Штаммы О2 серогруппы вызывали заболевания на территории Республик Крым, Калмыкия и Ростовской области.
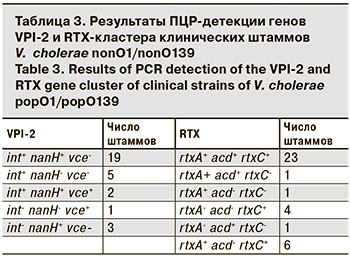
У всех культур методом ПЦР выявлены гены гемагглютинин/протеазы, протеазы PrtV, коллагеназы, цитотонического фактора Cef, белка наружной мембраны OmpW, системы секреции VI типа (T6SS), tol- и vps-кластеров, регуляторов toxR и hapR при отсутствии профагов CTX, pre-CTX и RS1; генов шигаподобного токсина, прямого термостабильного и родственного ему гемолизина (TDH и TRH). 4 штамма отличались от остальных наличием гена термостабильного токсина st, из них 1 штамм был выделен в Тамбовской области в 2017 г., 2 – в Республике Крым и 1 – в Ростовской области в 2016 г. Гены острова патогенности VPI-2 (int, nanH и vce) присутствовали в различных сочетаниях у 30 штаммов из 40, а гены кластера RTX – у 36 (табл. 3).
 Только 1 штамм от больного из Республики Крым (2017) содержал 1 из 6 использованных в качестве мишеней генов острова патогенности VPI I – ген tagA (в отсутствии tcpA, mop, acfB, toxT и aldA). Ген cholix-токсина выявлен у 2 штаммов из Республики Крым, гены маннозочувствительных пилей – у 5 штаммов, гены белка наружной мембраны OmpU – у 21. Отдельные гены островов пандемичности VSP-I и VSP-II были обнаружены у 13 культур.
Только 1 штамм от больного из Республики Крым (2017) содержал 1 из 6 использованных в качестве мишеней генов острова патогенности VPI I – ген tagA (в отсутствии tcpA, mop, acfB, toxT и aldA). Ген cholix-токсина выявлен у 2 штаммов из Республики Крым, гены маннозочувствительных пилей – у 5 штаммов, гены белка наружной мембраны OmpU – у 21. Отдельные гены островов пандемичности VSP-I и VSP-II были обнаружены у 13 культур.
Что касается контакт-зависимых систем секреции, 45,0% штаммов имели гены транслоконов системы секреции III типа (T3SS), что в 3 случаях не совпадало с обнаружением гена ее ключевого эффектора VopF. Гены структурных компонентов системы секреции VI типа (T6SS) выявлены у всех культур, а последовательности, кодирующие домены ее эффекторов (актин-связывающего acd-vgrG1 и пептидогликан-связывающего pbd-vgrG3), – у 20,0 и 42,0% соответственно.
При анализе антибиотикограмм клинических штаммов установлено, что за последние 5 лет выросла устойчивость к ампициллину (от 15,4% культур до 50,0% от общего количества клинических изолятов), а с 2015 г. появились культуры, резистентные к доксициклину и тетрациклину (18,4%), ципрофлоксацину (7,9%). Все культуры холерных вибрионов неО1/неО139 серогрупп были чувствительны к левомицетину.
Обсуждение
Немногочисленность представителей каждой серогруппы не позволяет говорить о доминировании на отдельной территории определенной серогруппы, но свидетельствует о циркуляции в каждом южном регионе большого числа различных клонов данного возбудителя, которые могут проявить патогенные свойства.
Несмотря на сходство клинической картины заболеваний (симптомы ОКИ у 94,6% людей), штаммы характеризовались генетической вариабельностью по наличию/отсутствию детерминант факторов патогенности/персистенции, выявляемых методом ПЦР. Вместе с тем отрицательный результат ПЦР не обязательно свидетельствует об отсутствии того или иного гена, поскольку некоторые детерминанты могут быть изменены настолько, что не узнаются «стандартными» праймерами. Так, ранее с помощью биоинформационного анализа нами было показано, что у ряда штаммов токсин RtxA утратил характерные активные домены, но приобрел новые, в том числе не свойственные данному токсину [13]; что продукты измененного гена nanH, не поддающегося ПЦР-детекции, обладают нейраминидазной активностью3 и что большинство изученных штаммов неО1/нео139 серогрупп содержат измененные гены пилей адгезии MSHA, продукты которых сохраняют адгезивную активность, причем реакция не ингибируется маннозой. Возможно, что такие манноза-нечувствительные пили (в отличие от типичных MSHA) могут продуцироваться in vivo и служить факторами колонизации кишечника в отсутствие ключевого фактора TCP [14].
Ген термостабильного токсина stn встречается у холерных вибрионов, циркулирующих в разных регионах мира [15], в частности, в странах Юго-Восточной Азии [3, 16]. Учитывая тот факт, что у штаммов V. cholerae nonО1/nonО139, выделенных на территории России до 2016 г. от больных и из водных экосистем, ген термостабильного токсина выявлен не был [11, 13], мы полагаем, что его обнаружение у 4 клинических штаммов может быть связано с завозным происхождением данных культур, тем более что 1 из них выделен от больного, прибывшего из Таиланда (Тамбов, 2017). Относительно остальных 3 штаммов [2 из Крыма и 1 из Ростовской области (2016)] это предположение пока основано лишь на том факте, что ген stn ранее на этих территориях не выявляли. Не исключено, что содержащие его штаммы вызвали заболевания у пациентов, прибывших из других регионов либо употреблявших морепродукты, в том числе импортные. Также не исключено инфицирование при купании в водоемах, куда они могли быть занесены и в течение некоторого времени там сохраняться. О такой возможности косвенно свидетельствуют данные зарубежных авторов, обнаруживших штаммы с аналогичной генетической характеристикой в водных ООС Италии [15] и США [17].
Заключение
Анализ динамики выделения клинических штаммов V. сholerae nonO1/nonO139 в 2014–2018 гг. показал спорадичность заболеваемости ОКИ, вызванными этими микроорганизмами, на территории южных регионов РФ (Республики Крым и Калмыкия, Ростовская область) в летние месяцы, а также в течение 2017 г. при возвращении отдыхающих из стран Юго-Восточной Азии. Выявлено серологическое разнообразие клинических культур V. сholerae nonO1/nonO139: 24 из 40 изученных штаммов принадлежали к 14 серогруппам.
Генетическая характеристика штаммов подтверждает возможность реализации ими патогенетического потенциала. Детекция гена термостабильного токсина stn предположительно указывает на завозное происхождение 4 культур, выделенных от больных в 2016 и 2017 г., так как, по данным литературы, ген stn ранее не встречался на территории России ни у водных, ни и у клинических штаммов V. сholerae nonO1/nonO139 [2, 11].
Выявление антибиотикорезистентных культур холерных вибрионов неО1/неО139 серогрупп указывает на необходимость мониторинга антибиотикограмм изолированных штаммов для адекватного этиотропного лечения.
Таким образом, выделенные на территории нашей страны в 2014–2018 гг. клинические штаммы характеризовались вариабельностью биологических свойств, при этом заболевания вызывали культуры с разным набором генетических детерминант факторов патогенности. Регистрация заболеваний с внекишечной локализацией возбудителя свидетельствует о необходимости проведения исследований на наличие холерных вибрионов в материале от больных отитом.



