Арутюнов Григорий Павлович
член-корреспондент РАН, доктор медицинских наук, профессор, заслуженный врач РФ, заведующий кафедрой пропедевтики внутренних болезней ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный специалист терапевт Департамента здравоохранения города Москвы
Ершов Феликс Иванович
академик РАН, доктор медицинских наук, профессор, руководитель отдела интерферонов и лаборатории интерфероногенеза ФГБУ «Федеральный научно-исследовательский центр эпидемиологии и микробиологии имени почётного академика Н.Ф. Гамалеи»
Карпова Людмила Серафимовна
доктор медицинских наук, заведующая лабораторией эпидемиологии гриппа и ОРЗ ФГБУ «НИИ гриппа» Минздрава России
Малеев Виктор Васильевич
академик РАН, доктор медицинских наук, профессор, заместитель директора по научной и клинической работе ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора
Мартынов Владимир Александрович
доктор медицинских наук, профессор, заведующий кафедрой инфекционных болезней с курсом инфектологии ФГБОУ ВО «Рязанский государственный медицинский университет имени академика И.П. Павлова» Минздрава России
Мидикари Александр Сергеевич
ассистент кафедры инфекционных болезней Медицинской академии им. С.И.Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И.Вернадского»
Сологуб Тамара Васильевна
доктор медицинских наук, профессор, заслуженный врач РФ, советник директора ФГБУ «НИИ гриппа» Минздрава России
Соминина Анна Адольфовна
доктор медицинских наук, профессор, руководитель отдела биотехнологии ФГБУ «НИИ гриппа» Минздрава России
Селькова Евгения Петровна
доктор медицинских наук, профессор, заместитель директора по клинико-эпидемиологической работе ФГУН «МНИИЭМ им. Г.Н. Габричевского» Роспотребнадзора
Тихонова Елена Петровна
доктор медицинских наук, профессор, заведующая кафедрой инфекционных болезней ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Минздрава России; главный внештатный специалист по инфекционным болезням Сибирского федерального округа и Министерства здравоохранения Красноярского края
Токин Иван Иванович
кандидат медицинских наук, ведущий научный сотрудник ФГБУ «НИИ гриппа» Минздрава России
Фазылов Вильдан Хайрулаевич
доктор медицинских наук, заведующий кафедрой инфекционных болезней ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России
Цветков Валерий Владимирович
кандидат медицинских наук, старший научный сотрудник ФГБУ «НИИ гриппа» Минздрава России
Цыбалова Людмила Марковна
доктор медицинских наук, заместитель директора по научной работе ФГБУ «НИИ гриппа» Минздрава России
Представлено краткое изложение проекта разделов клинических рекомендаций, посвященных терапии, реабилитации и профилактике гриппа у взрослых, разработанных специалистами ведущих учреждений РФ: ФГБУ «НИИ гриппа» Минздрава России, ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, ФГБУ «Федеральный научно-исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи», ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России, ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Минздрава России, ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, ФГБОУ ВО «Рязанский государственный медицинский университет имени академика И.П. Павлова» Минздрава России, Медицинской академии им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И.Вернадского». Рекомендации разработаны с позиций доказательной медицины в соответствии с требованиями к составлению рекомендаций Минздрава России.
Данные рекомендации были утверждены Общероссийской общественной организацией «Российское научное медицинское общество терапевтов» (РНМОТ, 10.11.2016), Евразийской Ассоциацией Терапевтов (ЕАТ, 10.11.2016), Национальным научным обществом инфекционистов (ННОИ, 28.03.2017) и доводятся до сведения профессионального сообщества для ознакомления и публичного обсуждения. Клинические рекомендации будут полезны как врачам общей практики и терапевтам, так и специалистам, прежде всего врачам-инфекционистам, эпидемиологам, пульмонологам, анестезиологам-реаниматологам, неврологам, клиническим фармакологам, специалистам по клинической лабораторной диагностике, профилактике, реабилитации и студентам медицинских вузов, ординаторам, аспирантам.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Грипп (франц. grippe), инфлуэнца – острая высококонтагиозная респираторная вирусная инфекция с воздушно-капельным механизмом передачи, вызываемая вирусами гриппа типа А, В и С (семейство Orthomyxoviridae, род Influenzavirus). Данная инфекция имеет склонность к эпидемическому распространению, поражает все возрастные группы населения в различных географических условиях. Заболевание характеризуется коротким инкубационным периодом, быстрым циклическим течением, наличием интоксикационного и катарального синдромов с преимущественным поражением эпителия слизистой оболочки верхних дыхательных путей. Тяжелое течение гриппа сопровождается поражением нижних дыхательных путей с признаками дыхательной недостаточности, отека легких, сосудистого коллапса, отека мозга, геморрагического синдрома и присоединением вторичных бактериальных осложнений.
Неосложненный грипп – заболевание сопровождается лихорадкой, катаральными проявлениями (кашель, заложенность носа, насморк), симптомами общей интоксикации (головная боль, слабость, миалгии, артралгии), иногда желудочно-кишечными расстройствами [1–4].
Осложненный грипп – заболевание сопровождается развитием вирус-ассоциированных и/или бактериальных осложнений с поражением нижних отделов дыхательных путей (одышка, гипоксемия с акроцианозом, потливость, тахикардия, нарушение ритма дыхания) вплоть до развития острого респираторного дистресс-синдрома (ОРДС), ЦНС (менингоэнцефалиты, энцефалиты, невриты) и/или обострением сопутствующих хронических заболеваний и/или других состояний, требующих проведения стационарного лечения [1–4].
Клинические рекомендации – нормативный документ системы стандартизации в здравоохранении, определяющий требования к выполнению медицинской помощи больному при определенном заболевании, с определенным синдромом или при определенной клинической ситуации.
Противовирусные препараты — средства этиотропного действия, оказывающие прямое ингибирующее действие на вирусную репродукцию, то есть действие этих препаратов направлено на определенную вирусспецифическую мишень в цикле размножения вируса.
Сопутствующее заболевание – заболевание, которое не имеет причинно-следственной связи с основным заболеванием, уступает ему в степени необходимости оказания медицинской помощи, влияния на работоспособность, опасности для жизни и здоровья и не является причиной смерти.
Тяжесть заболевания или состояния — критерий, определяющий степень поражения органов и/или систем организма человека либо нарушения их функций, обусловленные заболеванием или состоянием, либо их осложнением.
Уровень достоверности доказательств отражает степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным.
Уровень убедительности рекомендаций отражает степень уверенности не только в достоверности эффекта вмешательства, но и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации.
ЭПИДЕМИОЛОГИЯ
Источником инфекции является больной человек в остром периоде заболевания (первые 5–7 дней болезни), в том числе с легкой или бессимптомной формой, реже – реконвалесцент, выделяющий вирус в течение двух недель от начала заболевания [5]. Дети могут оставаться источником инфекции до трех недель после появления первых симптомов заболевания [6]. Раннее (в первые 48 ч после появления первых признаков болезни) назначение противовирусных препаратов способствует существенному снижению длительности периода, в течение которого пациент является источником инфекции [7].
До 1997 г. считалось, что вирусы гриппа птиц при контакте человека с птицами не опасны для людей. Однако во время эпизоотий в Гонконге (1997), Таиланде и Вьетнаме (2003–2004), во Вьетнаме (2005) были зарегистрированы заболевания людей, вызванные вирусами гриппа птиц, которые протекали с развитием тяжелых форм пневмоний и характеризовались высокой летальностью. Зафиксированы заболевания людей, вызванные подтипами H5N1, H7N7 и H7N9, а мировое сообщество находится в ожидании возможного появления нового вируса гриппа, чрезвычайно опасного для человека, против которого вакцинных препаратов пока не создано.
Заболеваемость гриппом, вне редких пандемий, характеризуется ежегодными эпидемическими подъемами с выраженным сезонным характером. В странах Северного полушария эпидемии гриппа происходят, как правило, в зимний период. Однако спорадические случаи заболевания гриппом регистрируются и в другие сезоны года. По данным Всемирной организации здравоохранения (ВОЗ), во всем мире ежегодные эпидемии гриппа приводят примерно к 3–5 млн случаев тяжелых форм заболевания и примерно к 250 000– 500 000 случаев смерти. Большинство случаев смерти, связанных с гриппом, в промышленно развитых странах происходит среди людей 65 лет и старше. В некоторых тропических странах вирусы гриппа циркулируют круглый год, достигая одного или двух пиков во время дождливых сезонов.
По данным ФГБУ «НИИ гриппа» Минздрава России, с 1969 по 2014 г. произошли значительные изменения в динамике заболеваемости гриппом и ОРВИ во всех городах России: снизилась заболеваемость в мегаполисах, особенно в Москве, сократилась разница в уровне заболеваемости гриппом и ОРВИ в мегаполисах и городах с меньшей численностью населения [8].
Во время эпидемии 2016 г. число летальных исходов в 59 наблюдаемых городах было меньше, чем во время пандемии 2009 г. (309 против 622 соответственно), но больше, чем в предшествующие сезонные эпидемии. Как показал анализ последних 7 эпидемий, летальные исходы наблюдались чаще при гриппе A(H1N1)pdm09 [9]. Летальность от лабораторно подтвержденного гриппа и других ОРВИ в эпидемию 2016 г. составила среди населения в целом 0,006%, в том числе среди детей до 14 лет – 0,0003%, среди лиц 15–64 лет – 0,01%, а среди лиц старше 65 лет – 0,035%. По сравнению с пандемией 2009 г. в 2016 г. показатель летальности был в 1,7 раза ниже во всех возрастных группах до 65 лет. У лиц старше 65 лет показатель летальности в 2016 г., напротив, был в 2,3 раза выше, чем в 2009 г. Таким образом, во время последней эпидемии 2016 г. по сравнению с пандемией 2009 г. в возрастной структуре умерших в 4,2 раза снизилась доля лиц в возрасте от 18 лет до 31 года, но увеличилась доля лиц в возрасте 54–64 лет и лиц старше 65 лет. Абсолютное большинство умерших от гриппа в последние годы имели различные хронические сопутствующие заболевания [9]. Так, среди умерших во время эпидемии 2016 г. по сравнению с пандемией 2009 г. существенно повысился удельный вес лиц с:
- сердечно-сосудистой патологией (до 49,2%);
- болезнями обмена веществ (до 41,1%), в том числе с ожирением (до 33,9%) и диабетом (до 17,8%);
- болезнями печени и почек (до 31,1%).
Реже у пациентов, умерших от гриппа, регистрировали такие заболевания, как хронические болезни легких – 11,0% случаев, иммунодефицитные состояния – 9,4% и болезни ЦНС (энцефалопатии, ДЦП, алкогольная энцефалопатия, эпилепсия) – 7,8%.
Эпидемии гриппа оказывают неблагоприятное влияние на смертность населения. Тяжесть эпидемий всегда коррелирует с увеличением смертности населения от соматических болезней. Оценку влияния эпидемий гриппа на смертность населения принято проводить по показателю «дополнительной» смертности. В разные годы показатели «дополнительной» смертности по отдельным нозологиям различались, что, вероятно, можно объяснить этиологическими и патогенетическими особенностями вирусов гриппа, циркулирующих в тот или иной период. Среди всех классов заболеваний основное место в структуре «дополнительной» смертности от гриппа занимают болезни органов кровообращения (ИБС, гипертоническая болезнь, гнойный миокардит, перикардит, септический эндокардит), затем следуют болезни органов дыхания (внебольничная пневмония, хронический бронхит, эмфизема, бронхиальная астма). Наиболее часто смерть от гриппа и его осложнений регистрируется у лиц старших возрастных групп, страдающих одновременно хроническими заболеваниями сердечно-сосудистой и дыхательной систем. Наличие других хронических соматических заболеваний еще более увеличивает возможность смертельного исхода [10].
«Дополнительная» смертность от соматических и инфекционных заболеваний среди населения в сезон 2014–2015 гг. была статистически достоверно выше, чем во время предшествующих «сезонных» эпидемий (40,8 против 11,7) и сопоставима с показателями в период пандемии (40,8 против 52,3) [11]. В 2014–2015 гг. основными группами риска «дополнительной» смертности были лица в возрасте старше 70 лет, у которых «дополнительная» смертность от соматических и инфекционных заболеваний была достоверно выше, чем во время пандемии гриппа 2009 г.
На основании эпидемиологических данных за последние несколько лет можно выделить следующие группы риска развития осложненных форм гриппа, ассоциированных с высокой летальностью и показателем «дополнительной» смертности: лица в возрасте до 2 и старше 65 лет; беременные; взрослые и дети с наличием в анамнезе бронхиальной астмы, неврологических заболеваний, хронических заболеваний легких, заболеваний сердечно-сосудистой системы, заболеваний крови, эндокринных нарушений (сахарный диабет), заболеваний почек, печени и метаболического синдрома; лица с иммунодефицитным состоянием; лица младше 19 лет, длительно употребляющие аспирин.
Высокий риск тяжелого течения заболевания и возникновения осложнений отмечен в трех группах: беременные, особенно в III триместре беременности; дети до 2 лет; пациенты, имеющие хронические заболевания дыхательной системы.
КЛАССИФИКАЦИЯ
По типу вирусов (возбудителя заболевания):
- грипп А (А/H1N1), (А/H3N2) и др.;
- грипп В (Ямагатская и Викторианская линии);
- грипп С.
По форме (степени) тяжести заболевания:
- легкая;
- среднетяжелая;
- тяжелая.
По характеру течения:
- гладкое (неосложненное);
- негладкое (осложненное).
По наличию симптомов:
- типичный;
- атипичный (бессимптомный).
По локализации поражения (топическим признакам):
- острый ринит;
- острый фарингит;
- острый трахеит;
- острый ларингит;
- острый бронхит;
- сочетания анатомических локализаций.
Комментарии: критерии степени тяжести гриппа и ОРВИ (оцениваются по выраженности симптомов интоксикации):
- легкая степень – повышение температуры тела не более 38°С; умеренная головная боль; пульс – менее 90 уд/мин; систолическое артериальное давление – 115–120 мм рт. ст; частота дыхания – менее 24 в 1 мин.;
- средняя степень – температура тела в пределах 38,1–40 °С; выраженная головная боль; гиперестезия; пульс – 90–120 уд/мин; систолическое артериальное давление – менее 110 мм рт.ст.; частота дыхания – более 24 в 1 мин.;
- тяжелая степень – острейшее начало, высокая (более 40 °С) температура с резко выраженными симптомами интоксикации (сильной головной болью, ломотой во всем теле, бессонницей, бредом, анорексией, тошнотой, рвотой, менингеальными симптомами, иногда энцефалитическим синдромом); пульс – более 120 уд/мин, слабого наполнения, нередко аритмия; систолическое артериальное давление – менее 90 мм рт.ст.; тоны сердца глухие; частота дыхания – более 28 в 1 мин.;
- очень тяжелая степень – молниеносное течение с бурно развивающимися симптомами интоксикации, с возможным развитием ДВС-синдрома.
ЛЕЧЕНИЕ
При первичном посещении пациента участковый врач решает вопрос о необходимости госпитализации его в стационар. Для этого, прежде всего, необходимо оценить тяжесть состояния пациента, которая определяется степенью интоксикации, наличием осложнений и обострением сопутствующих заболеваний.
Показания для госпитализации [12, 13]:
- тяжелое состояние больного, обусловленное интоксикацией (гипертермия, геморрагический синдром, спутанность сознания, менингизм, бред, гипоксия, нарушение ритма сердечных сокращений, бледность кожи, уменьшение диуреза, тошнота, рвота);
- осложненные формы гриппа (наличие симптомов дыхательной недостаточности и/или отека легких, кровохарканье, бронхообструктивный синдром, острый отечный ларингит, пневмония, острое воспаление придаточных пазух носа);
- больные из группы риска неблагоприятного развития болезни:
- беременные на любом сроке беременности и в послеродовой период;
- лица с хроническими заболеваниями легких (бронхиальная астма, ХОБЛ);
- лица с хроническими заболеваниями сердечно-сосудистой системы (пороки, ИБС с признаками сердечной недостаточности);
- лица с нарушениями обмена веществ (сахарный диабет, ожирение 2–3-й степени);
- лица с хронической болезнью почек, хронической болезнью печени, определенными неврологическими состояниями (включая нейромускулярные, нейрокогнитивные нарушения, эпилепсию), гемоглобинопатиями или угнетенным иммунным состоянием либо по причине первичных иммуносупрессивных состояний, таких как ВИЧ-инфекция, либо в связи с вторичными иммунодефицитными состояниями вследствие приема иммуносупрессивных медикаментов или злокачественных новообразований;
- лица в возрасте 65 лет и старше;
- пациенты из географически удаленных районов.
Признаки и симптомы прогрессирующего течения гриппа, требующего срочного пересмотра схемы ведения больного:
- признаки и симптомы, свидетельствующие об ухудшении снабжения организма кислородом или сердечно-легочной недостаточности: одышка (при движении или в состоянии покоя), затрудненное дыхание, синюшность, кровянистая или окрашенная мокрота, боль в груди и пониженное кровяное давление; гипоксия, определяемая по показаниям пульсоксиметра;
- признаки и симптомы, свидетельствующие об осложнениях со стороны ЦНС (измененное психическое состояние, бессознательное состояние, сонливость или трудности с пробуждением и периодические или постоянные конвульсии (судороги), спутанность сознания, сильная слабость или паралич;
- подтверждение наличия устойчивой репликации вируса или вторичной бактериальной инфекции, основанное на результатах лабораторных исследований или клинических признаках (например, сохранение постоянной высокой температуры тела и других симптомов более 3 дней);
- тяжелое обезвоживание, проявляющееся пониженной активностью, головокружением, снижением диуреза и вялостью.
Информация, касающаяся доз, показаний к применению и способов применения лекарственных средств, содержащаяся в данных рекомендациях, может отличаться от информации, указанной в инструкции по их медицинскому применению. Для получения полной информации о применении того или иного препарата следует внимательно ознакомиться с вложенной в упаковку аннотацией, составленной производителем. Персональная ответственность за интерпретацию и использование настоящих рекомендаций лежит на лечащем враче.
Консервативное лечение
1. Лечение легких и среднетяжелых неосложненных форм гриппа в амбулаторных условиях
• Рекомендовано использование ингибиторов нейраминидазы вирусов гриппа типа A и B – препаратов осельтамивир**1 или занамивир [14–31].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1a).
Комментарии: ингибиторы нейраминидазы высокоэффективны при назначении их в первые 36 ч заболевания [14]. Осельтамивир** применяется перорально по 75 мг 2 раза в сутки (суточная доза – 150 мг) в течение 5 дней. Занамивир применяется ингаляционно через дискхалер по 2 ингаляции 2 раза в сутки в течение 5 дней. Данный препарат требует осторожного применения у пациентов с бронхоспазмом. Известно, что устойчивость вирусов гриппа к ингибиторам нейраминидазы возникает в результате одноступенчатых мутаций. Появление устойчивых к осельтамивиру штаммов связано с наличием иммунодефицита у хозяев, вследствие этого у таких больных отсутствует адекватный вирусологический ответ и заболевание протекает очень быстро [15, 16]. В 2007–2008 гг. было установлено, что устойчивость к осельтамивиру связана с конкретной мутацией в гене нейраминидазы H274Y. Вирусы гриппа А(H1N1) с данной мутацией регистрировались во многих странах мира [17–26]. Распространение этих устойчивых штаммов никак не было связано с использованием осельтамивира или наличием у пациентов ассоциированных с гриппом инфекций. В мире были зарегистрированы летальные исходы у пациентов, заразившихся устойчивым мутантным штаммом [27]. Весьма важно, что этот устойчивый к осельтамивиру вариант был чувствителен к занамивиру и к римантадину. Циркулирующие в России с 2007 по 2009 г. штаммы вируса гриппа А были менее устойчивы к занамивиру, нежели к осельтамивиру [28]. Штаммы вируса гриппа A(H1N1), вызвавшие пандемию гриппа в 2009 г. и циркулирующие до настоящего времени, демонстрируют высокую чувствительность к ингибиторам нейраминидазы (занамивиру и осельтамивиру) [28].
• Рекомендовано использование ингибиторов слияния (фузии), в частности, препарата умифеновир** [14, 32–41].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1b).
Комментарии: умифеновир** обладает широким спектром противовирусного действия, в том числе в отношении штаммов вируса гриппа, устойчивых к осельтамивиру. Умифеновир** применяется перорально по 200 мг каждые 6 ч (4 раза в сутки, суточная доза – 800 мг) в течение 5 дней.
• Рекомендовано использование препарата из группы азолоазинов – метилтионитрооксодигидротриазолотриазинида натрия [42, 43].
Уровень убедительности рекомендаций B (уровень достоверности доказательств –3).
Комментарии: метилтионитрооксодигидротриазолотриазинид натрия применяется перорально по 1 капсуле (250 мг) 3 раза в сутки (суточная доза – 750 мг) в течение 5 дней.
• Рекомендовано использование имидазолилэтанамида пентандиовой кислоты** [44–52].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2а).
Комментарии: имидазолилэтанамид пентандиовой кислоты** эффективен в отношении вирусов гриппа типа А: А(H1N1), в том числе A(H1N1)pdm09, A(H3N2), A(H5N1), и типа В. Противопоказан при повышенной чувствительности к любому компоненту препарата, дефиците лактазы, непереносимости лактозы, глюкозо-галактозной мальабсорбции, беременности и в период грудного вскармливания. Имидазолилэтанамид пентандиовой кислоты** применяется перорально по 90 мг 1 раз в сутки в течение 5 дней.
• Рекомендовано использование препаратов интерферона альфа и гамма [53–61].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: рекомбинантный интерферон гамма применяется интраназально по 2 капли в каждый носовой ход 5 раз в день (разовая доза –4000 ME, суточная – 20 000 ME) до 3-го дня болезни или в течение 5–7 дней в период реконвалесценции. Рекомбинантный интерферон альфа-2b применяется интраназально по 3 капли в каждый носовой ход 5–6 раз в день (разовая доза – 3000 ME, суточная – 15 000–18 000 ME) отдельно или в комбинации с рекомбинантным интерфероном гамма интраназально по 2 капли в каждый носовой ход 5 раз в день (разовая доза – 4000 ME, суточная – 20 000 ME) до 3-го дня болезни или в течение 5–7 дней в период реконвалесценции.
• Рекомендовано использование индукторов интерферона – препаратов меглюмина акридонацетат**, тилорон и кагоцел** [62–82].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: меглюмина акридонацетат** применяется перорально по 450–600 мг (3–4 таблетки) 1 раз в сутки за 30 мин до еды в 1-е и на 2-е, 4-е, 6-е и 8-е сутки (курс лечения – 20 таблеток). Тилорон применяется перорально по 125 мг 1 раз в сутки в первые 2 дня, затем по 125 мг в сутки через день (курсовая доза – 750 мг). Препарат Кагоцел** применяется перорально по 24 мг (2 таблетки) 3 раза в сутки в первые 2 дня, затем по 12 мг (1 таблетка) 3 раза в сутки в течение 2 дней (курсовая доза – 216 мг или 18 таблеток). Индукторы интерферона целесообразно назначать до 3-го дня болезни или в течение 5–7 дней в период реконвалесценции.
• При отсутствии эффекта от приема препаратов интерферона и индукторов интерферона в течение 24 ч рекомендовано назначение ингибиторов нейраминидазы или ингибиторов слияния (фузии).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
• Рекомендуется проведение пероральной дезинтоксикационной терапии [83].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: дезинтоксикационная терапия направлена на купирование синдрома интоксикации, ее объем зависит от степени тяжести состояния пациента.
• Рекомендовано назначение нестероидных противовоспалительных препаратов [67–69].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарии: из группы НПВП рекомендуется назначение лекарственных форм, обладающих выраженным как жаропонижающим, так и противовоспалительным действием. Ибупрофен** применяется перорально по 200–400 мг 3–4 раза в сутки в течение 3–10 дней (максимальная суточная доза – 1200 мг). Целекоксиб применяется перорально по 100–200 мг 2 раза в сутки в течение 3–10 дней (максимальная рекомендованная суточная доза при длительном приеме – 400 мг). Напроксен применяется перорально по 250–500 мг 2 раза в сутки в течение 3–10 дней (максимальная разовая доза – 500 мг, максимальная суточная – 1750 мг).
• В качестве дополнительных жаропонижающих средств рекомендовано использование препарата парацетамол** [67–69].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарии: показаниями для использования дополнительных жаропонижающих средств являются абсолютные цифры термометрии (выше 38–38,5 °С), выраженные мозговые и сердечно-сосудистые нарушения. Парацетамол** применяется перорально по 500–1000 мг до 4 раз в сутки (максимальная суточная – 4000 мг).
• Рекомендовано назначение антигистаминных препаратов [70–72].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: хлоропирамин** применяется перорально во время еды по 25 мг 3–4 раза в сутки (до 150 мг/сут), внутримышечно или внутривенно – 1–2 мл 2% раствора. Дифенгидрамин** применяется перорально во время еды по 30–50 мг 1–3 раза в сутки, внутримышечно – 1–2 мл 1% раствора до 15 мл в сутки. Дезлоратадин** применяется перорально, независимо от приема пищи, по 5 мг в сутки.
• Рекомендовано назначение отхаркивающих средств [83, 84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: отхаркивающие средства рекомендуются пациентам с влажным кашлем для разжижения и улучшения отхождения мокроты. Ацетилцистеин** применяется перорально по 200 мг 2–3 раза в сутки после еды. Гвайфенезин применяется перорально по 200–400 мг (10–20 мл) 3–4 раза в сутки после еды. Бромгексин применяется перорально по 8 мг (1–2 таблетки) 3–4 раза в сутки. Амброксол** применяется перорально по 30 мг 3 раза в сутки.
• Рекомендовано назначение противокашлевых средств [83, 84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: противокашлевые средства рекомендуются пациентам с сухим непродуктивным надсадным кашлем, значительно ухудшающим качество жизни пациента. Декстрометорфан входит в состав многокомпонентных препаратов. Бутамират применяется перорально по 15 мл 4 раза в сутки (сироп).
• Не рекомендовано одновременное применение отхаркивающих и противокашлевых средств.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: одновременное применение отхаркивающих и противокашлевых средств за счет подавления кашлевого рефлекса может способствовать застою мокроты.
• Рекомендуется местное применение сосудосуживающих средств [83, 84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: показаниями для назначения сосудосуживающих препаратов являются острый ринит, профилактика и лечение синуситов, евстахиитов, отитов. Нафазолин применяется интраназально (в каждый носовой ход) по 1–3 капли 0,05–0,1% раствора 3–4 раза в сутки. Ксилометазолин** применяется интраназально (в каждый носовой ход), по 2–3 капли 0,1% раствора или 1 впрыскивание из распылителя в каждую ноздрю 4 раза в день. Оксиметазолин применяется интраназально (в каждый носовой ход), по 1–2 капли 0,025–0,05% раствора 2–3 раза в сутки или по 2–3 впрыскивания 0,05% спрея.
2. Лечение тяжелых/осложненных форм гриппа в стационарных условиях
• Рекомендовано использование ингибиторов нейраминидазы вирусов гриппа типов A и B – препаратов осельтамивир** или занамивир [14–31].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1a).
Комментарии: ингибиторы нейраминидазы высокоэффективны при назначении их в первые 36 ч заболевания [14]. Осельтамивир** применяется перорально по 150 мг 2 раза в сутки (суточная доза – 300 мг) в течение 5–10 дней. Занамивир применяется ингаляционно через дискхалер по 2 ингаляции 2 раза в сутки в течение 5 дней. Данный препарат требует осторожного применения у пациентов с бронхоспазмом.
• Рекомендовано использование комбинаций противовирусных препаратов [14–31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: осельтамивир** применяется перорально по 75 мг 2 раза в сутки (суточная доза –150 мг) в комбинации с умифеновиром** – перорально по 200 мг каждые 6 ч (4 раза в сутки, суточная доза – 800 мг) в течение 5–10 дней. Осельтамивир** применяется перорально по 75–150 мг 2 раза в сутки (суточная доза – 150 мг) в комбинации с имидазолилэтанамидом пентандиовой кислоты** – перорально по 90–180 мг 1 раз в сутки в течение 5–10 дней.
• Рекомендовано использование препарата из группы азолоазинов – метилтионитрооксодигидротриазолотриазинида натрия [42, 43].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарии: метилтионитрооксодигидротриазолотриазинид натрия применяется перорально по 1 капсуле (250 мг) 3 раза в день (суточная доза – 750 мг) в течение 5–7 дней.
• Рекомендуется проведение дезинтоксикационной терапии [83, 84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: дезинтоксикационная терапия направлена на купирование синдрома интоксикации, ее объем зависит от степени тяжести состояния пациента.
• Рекомендовано назначение нестероидных противовоспалительных препаратов [67–69].
Уровень убедительности рекомендаций B (уровень достоверности доказательств –3).
Комментарии: из группы НПВП рекомендуется назначение лекарственных форм, обладающих выраженным как жаропонижающим, так и противовоспалительным действием. Ибупрофен** применяется перорально по 200–400 мг 3–4 раза в сутки в течение 3–10 дней (максимальная суточная доза – 1200 мг). Целекоксиб применяется перорально по 100–200 мг 2 раза в сутки в течение 3–10 дней (максимальная рекомендованная суточная доза при длительном приеме – 400 мг). Напроксен применяется перорально по 250–500 мг 2 раза в сутки в течение 3–10 дней (максимальная разовая доза – 500 мг, максимальная суточная – 1750 мг).
• В качестве дополнительного жаропонижающего средства рекомендовано использование препарата парацетамол** [67–69].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарии: показаниями для использования дополнительных жаропонижающих средств являются абсолютные цифры термометрии (выше 38–38,5 °С), выраженные мозговые и сердечно-сосудистые нарушения. Парацетамол** применяется перорально по 500–1000 мг до 4 раз в сутки (максимальная суточная – 4000 мг).
• Рекомендовано назначение антигистаминных препаратов [70–72].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: хлоропирамин** применяется перорально во время еды по 25 мг 3–4 раза в сутки (до 150 мг в сутки); внутримышечно, внутривенно – 1–2 мл 2% раствора. Дифенгидрамин** применяется перорально во время еды по 30–50 мг 1–3 раза в сутки, внутримышечно – 1–2 мл 1% раствора до 15 мл в сутки. Дезлоратадин** применяется перорально, независимо от приема пищи, по 5 мг в сутки.
• Рекомендовано назначение отхаркивающих средств [83, 84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: отхаркивающие средства рекомендуются пациентам с влажным кашлем для разжижения и улучшения отхождения мокроты. Ацетилцистеин** применяется перорально по 200 мг 2–3 раза в сутки после еды. Гвайфенезин применяется перорально по 200–400 мг (10–20 мл) 3–4 раза в сутки после еды. Бромгексин применяется перорально по 8 мг (1–2 таблетки) 3–4 раза в сутки. Амброксол** применяется перорально по 30 мг 3 раза в сутки.
Рекомендовано назначение противокашлевых средств [83, 84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: противокашлевые средства рекомендуются пациентам с сухим непродуктивным надсадным кашлем, значительно ухудшающим качество жизни пациента. Декстрометорфан входит в состав многокомпонентных препаратов. Бутамират применяется перорально по 15 мл 4 раза в сутки (сироп).
• Не рекомендовано одновременное применение отхаркивающих и противокашлевых средств.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: одновременное применение отхаркивающих и противокашлевых средств за счет подавления кашлевого рефлекса может способствовать застою мокроты.
• Рекомендуется местное применение сосудосуживающих средств [83, 84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: показаниями для назначения сосудосуживающих препаратов являются острый ринит, профилактика и лечение синуситов, евстахиитов, отитов. Нафазолин применяется интраназально (в каждый носовой ход) по 1–3 капли 0,05–0,1% раствора 3–4 раза в сутки. Ксилометазолин** применяется интраназально (в каждый носовой ход), по 2–3 капли 0,1% раствора или 1 впрыскивание из распылителя в каждую ноздрю 4 раза в день. Оксиметазолин применяется интраназально (в каждый носовой ход), по 1–2 капли 0,025–0,05% раствора 2–3 раза в сутки или по 2–3 впрыскивания 0,05% спрея.
• При подозрении на развитие вирусно-бактериальной пневмонии рекомендовано проведение антибактериальной терапии в соответствии с принятыми рекомендациями по ведению больных с внебольничной пневмонией [85–93].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3a).
Комментарии: сезонный грипп и пандемии гриппа демонстрируют высокий риск развития бактериальных инфекций, вызванных Staphylococcus aureus, которые могут протекать в тяжелой форме и носить быстро прогрессирующий характер. Главной причиной госпитализации больных, инфицированных вирусом A(H1N1)pdm2009, является развитие диффузного вирусного поражения легких с последующим развитием острой дыхательной недостаточности [86–91]. Вторичные бактериальные пневмонии, вызванные Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, наблюдаются у 20–38% больных гриппом A(H1N1)pdm2009, умерших или тех, кому требовалось проведение интенсивной терапии [85, 88, 90–93]. Так, в США у 40% госпитализированных больных гриппом регистрировали пневмониию [94]. У 20% больных с гриппом H1N1, помещенных в отделения интенсивной терапии в Новой Зеландии и Австралии, также диагностировали вторичную бактериальную пневмонию [91]. При подозрении на сопутствующую бактериальную инфекцию у пациентов с гриппом в случае использования антибиотиков необходимо, по возможности, руководствоваться результатами микробиологических исследований.
РЕАБИЛИТАЦИЯ
• Рекомендовано применение иммуномодуляторов в период реконвалесцении.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: рекомбинантный интерферон гамма применяется интраназально по 2 капли в каждый носовой ход 5 раз в день (разовая доза – 4000 ME, суточная – 20 000 ME) в течение 5–7 дней в период реконвалесценции. Рекомбинантный интерферон альфа-2b применяется интраназально по 3 капли в каждый носовой ход 5–6 раз в день (разовая доза – 3000 ME, суточная – 15 000–18 000 ME) отдельно или в комбинации с рекомбинантным интерфероном гамма – интраназально по 2 капли в каждый носовой ход 5 раз в день (разовая доза – 4000 ME, суточная – 20 000 ME) в течение 5–7 дней в период реконвалесценции. Меглюмина акридонацетат** применяется перорально по 450–600 мг (3–4 таблетки) 1 раз в сутки за 30 минут до еды в 1-е, на 2-е, 4-е, 6-е и 8-е сутки (курс лечения – 20 таблеток). Тилорон применяется перорально по 125 мг 1 раз в сутки в первые 2 дня, затем по 125 мг в сутки через день (курсовая доза – 750 мг). Препарат Кагоцел** применяется перорально по 24 мг (2 таблетки) 3 раза в сутки в первые 2 дня, затем по 12 мг (1 таблетки) 3 раза в сутки в течение 2 дней (курсовая доза – 216 мг, 18 таблеток). Индукторы интерферона назначают в течение 5–7 дней в период реконвалесценции.
ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
1. Специфическая профилактика
• Рекомендовано проведение вакцинации [95–110].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1а).
Комментарий: вакцинации против гриппа в предэпидемический период в первую очередь подлежат лица, относящиеся к категории высокого риска заболевания гриппом и неблагоприятных осложнений при заболевании, к которым относятся:
- лица старше 60 лет, прежде всего проживающие в учреждениях социального обеспечения;
- лица, страдающие заболеваниями эндокринной системы (диабет), нарушениями обмена веществ (ожирение), болезнями системы кровообращения (ГБ, ИБС), хроническими заболеваниями дыхательной системы (хронический бронхит, бронхиальная астма), хроническими заболеваниями печени и почек;
- беременные (только инактивированными вакцинами);
- лица, часто болеющие острыми респираторными вирусными заболеваниями;
- медицинские работники;
- работники сферы обслуживания, транспорта, учебных заведений.
2. Неспецифическая профилактика
• Рекомендована экстренная профилактика, проводимая в начале эпидемического подъема заболеваемости или в эпидемическом очаге (внутриочаговая профилактика) с применением противовирусных химиопрепаратов (умифеновир**), интерферонов и индукторов эндогенного интерферона [95–99].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: экстренная профилактика дает возможность защитить определенные группы населения в условиях начавшейся эпидемии или вспышки. Умифеновир** при непосредственном контакте с больным гриппом и ОРВИ другой этиологии применяется перорально по 200 мг в сутки в течение 10–14 дней. Препараты рекомбинантного интерферона альфа применяются перорально по 500 000 ME (1 капсула) в сутки 2 раза в неделю в течение месяца. Рекомбинантный интерферон гамма применятеся интраназально по 2–3 капли в каждый носовой ход через день в течение 10 дней (суточная доза – 4000–5000 ME). Меглюмина акридонацетат** применятся перорально по 450–600 мг (3–4 таблетки) в сутки за 30 минут до еды в 1-е, на 2-е, 4-е, 6-е и 8–е сутки. Далее делают перерыв на 72 ч (3 суток) и продолжают курс на 11-е, 14-е, 17-е, 20-е и 23-и сутки. Общий курс составляет от 5 до 10 приемов. Тилорон применяется перорально по 125 мг 1 раз в неделю в течение 6 недель (курсовая доза – 750 мг, 6 таблеток). Препарат Кагоцел** в качестве средства профилактики гриппа и ОРВИ другой этиологии назначают 7-дневными циклами: 2 дня перорально по 24 мг (2 таблетки) 1 раз в сутки, затем 5 дней перерыва, и цикл повторяется снова.
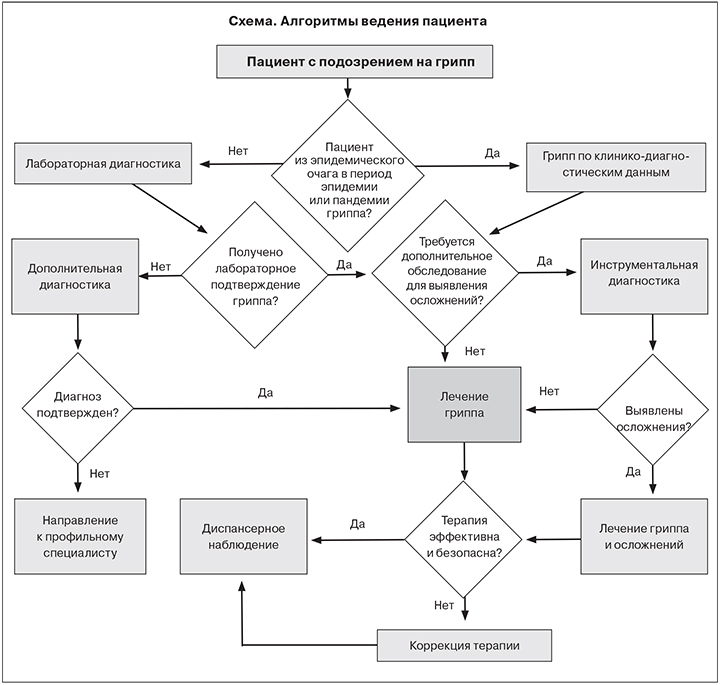
• Рекомендована сезонная профилактика, проводимая в предэпидемический период, с применением иммунокоррегирующих препаратов курсами разной продолжительности [98–99].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: проведение сезонной профилактики предусматривает повышение резистентности организма к респираторным вирусам. Меглюмина акридонацетат** применятся перорально по 450–600 мг (3–4 таблетки) в сутки за 30 минут до еды в 1-е, на 2-е, 4-е, 6-е и 8-е сутки. Далее делают перерыв на 72 ч (3 суток) и продолжают курс на 11-е, 14-е, 17-е, 20-е и 23–и сутки. Общий курс составляет от 5 до 10 приемов. Тилорон применяется перорально по 125 мг 1 раз в неделю в течение 6 недель (курсовая доза – 750 мг, 6 таблеток). Препарат Кагоцел** назначают 7-дневными циклами: 2 дня перорально по 24 мг (2 таблетки) 1 раз в сутки, затем 5 дней перерыва, и цикл повторяется снова. Лизаты бактерий механические применяются сублингвально по 7 мг (1 таблетка) в сутки в течение 10 дней, 20 дней перерыва, затем еще 10 дней приема по 1 таблетке в сутки.
• Рекомендованы санитарно-гигиенические и оздоровительные мероприятия.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Связанные документы
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
- Федеральный закон от 21 ноября 2011 г. № 323- ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011, № 48, ст. 6724).
- Федеральный закон Российской Федерации от 29 ноября 2010 г. № 326-ФЗ «Об обязательном медицинском страховании в Российской Федерации».
- Приказ Минздравсоцразвития России от 31 января 2012 года № 69н «Об утверждении Порядка оказания медицинской помощи взрослым больным с инфекционными заболеваниями» (зарегистрирован в Минюсте РФ 4 апреля 2012 г., регистрационный № 23726).
- Приказ Минздравсоцразвития России № 1664н от 27 декабря 2011 г. «Об утверждении номенклатуры медицинских услуг» (зарегистрирован в Минюсте 24 января 2012, регистрационный № 23010).
- Приказ Минздравсоцразвития России от 23 июля 2010 г. № 541н «Об утверждении Единого квалификационного справочника должностей руководителей, специалистов и служащих», раздел «Квалификационные характеристики должностей работников в сфере здравоохранения» (зарегистрирован в Минюсте РФ 25 августа 2010 г., регистрационный № 18247).
- Приказ Минздрава России от 12 августа 2013 г. № 565 «Об утверждении перечня видов высокотехнологичной медицинской помощи».
- Приказ Минздрава России от 09 ноября 2012 г. № 724н «Об утверждении стандарта специализированной медицинской помощи при гриппе средней степени тяжести» (зарегистрировано в Минюсте РФ 04 июня2013, регистрационный № 28644).
- Приказ Минздрава России от 09 ноября 2012 г. № 842н «Об утверждении стандарта специализированной медицинской помощи при гриппе тяжелой степени тяжести» (зарегистрировано в Минюсте РФ 21 марта 2013 г., регистрационный № 27827).
- Санитарно-эпидемиологические правила «Профилактика гриппа и других острых респираторных вирусных инфекций» СП 3.1.2.3117-13. Постановление от 18 ноября 2013 г. № 63



