Во многих медицинских центрах как в России, так и за рубежом возбудителями инфекций, связанных с оказанием медицинской помощи (ИСМП), все чаще становятся грамотрицательные бактерии Pseudomonas aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii, Stenotrophomonas maltophilia [1–4]. Этому способствует селекция антибиотикоустойчивых изолятов данных бактерий, обладающих различными механизмами резистентности, которые более эффективно формируются у грамотрицательных бактерий, чем у грамположительных. В связи с этим актуальны меры по сдерживанию распространения Pseudomonas aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii, Stenotrophomonas maltophilia как в целом, так и на локальном уровне в каждой медицинской организации и определению стратегий борьбы с ними. Основой реализации таких мер является всесторонний микробиологический мониторинг этих микроорганизмов, способствующий выявлению особенностей распределения их во внутрибольничной среде и колонизации ими пациентов.
Материалы и методы
Объектами бактериологического мониторинга являлись 633 изолята грамотрицательных бактерий P. aeruginosa (n = 193), K. pneumoniae (n = 180), A. baumannii (n = 177), S. maltophilia (n = 83), выделенных от пациентов одного из стационаров Пензы за период с марта 2012 г. по март 2015 г.
Отбор проб биологического материала осуществляли в соответствии с правилами, изложенными в методических указаниях МУ 4.2.2039-051. Бактерии выделяли традиционными методами с определением морфологических и культуральных характеристик.
Для биохимической идентификации использовали тест-системы к анализатору VITEK 2 Compact (bioMerieux, Франция)2. Подтверждение их видовой принадлежности проводили методом времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (MALDI-ToF)..
Чувствительность бактерий к антибиотикам определяли методом диффузии в агар антибактериальных препаратов, содержащихся в определенном количестве (в мкг) в коммерческих дисках и в градиентной концентрации (в мкг/мл) на специальных полосках, так называемых Е-тестах, комбинирующих метод серийных разведений и принципы диффузии в плотную среду (Oxoid, Великобритания; bioMerieux, Франция). Результаты интерпретировали в соответствии с рекомендациями European Committee on Antimicrobial Susceptibility Testing (EUCAST) и Clinical and Laboratory Standards Institute (CLSI) для каждого вида бактерий3,4.
Фенотипы бактерий, несущих детерминанты резистентности β-лактамазы расширенного спектра (ESBL) и металло-β-лактамазы (MBL) выявляли методом синергизма двойных дисков c ингибиторами ферментов клавулановой кислотой и этилендиаминтетрауксусной кислотой (ЭДТА) соответственно5. Гены резистентности VIM, IMP, NDM, OXA-48, OXA-23, OXA-40, OXA-58, KPC определяли методом ПЦР в реальном времени.
Анализ непараметрических переменных выполняли путем сравнения наблюдаемых и ожидаемых частот в двух группах с помощью критерия χ2, результат анализа представляли в виде критерия р, различия считали достоверными при р < 0,05. Обработку результатов исследования проводили с помощью программы Statistica [5].
Результаты
Проведено исследование по выявлению доминирующих патогенов в стационаре из 1401 выделенных изолятов бактерий за период с марта 2012 г. по март 2015 г. Было установлено преобладание грамотрицательных бактерий (ГОБ) над грамположительными (ГПБ) в 1,74 раза – 889 (63,5%) и 512 (36,5%) изолятов соответственно (p < 0,001). Основная часть ГОБ выявлена в отделениях реанимации (602 изолятов или 67,7%), меньшая – в хирургических отделениях (287 изолятов или 32,3%) (p < 0,001). 788 (88,6% ) изолятов относились к 6 видам ГОБ: P. aeruginosa, K. pneumoniae, A. baumannii, E. coli, S. maltophilia и E. cloacae; остальные 12 (1,3%) не влияли на грамотрицательный профиль стационара. Ситуация в отделениях реанимации в большей степени повлияла на общую тенденцию распределения ведущих патогенов в стационаре, показав преобладание в них P. aeruginosa (p < 0,02), K. pneumoniae (p < 0,001), A. baumannii (p < 0,001) и S. maltophilia (p < 0,001) по сравнению с хирургическими отделениями, что и определило ход дальнейшего анализа (рис. 1).

Несмотря на незначительное преобладание E. coli над S. maltophilia, последний был отобран как экзогенный патоген с высоким уровнем естественной устойчивости к антимикробным препаратам и потенциалом возбудителя ИСМП, в отличие от E. coli – комменсала организма человека.
Распределение P. aeruginosa, K. pneumoniae, A. baumannii и S. maltophilia по источникам выделения из клинического материала характеризовалось отсутствием специфичности, преимущественной принадлежностью нижним дыхательным путям (НДП) (p < 0,001), за исключением хирургического отделения для взрослых, где эти же бактерии чаще выделяли с раневой поверхности – основного клинического материала в этом отделении (рис. 2).
Частота выделения P. aeruginosa, K. pneumoniae и A. baumannii в разные месяцы была неодинакова (рис. 3): максимальные значения для P. aeruginosa были определены в августе и сентябре (p < 0,001), для K. pneumoniae – в августе, октябре и ноябре (p < 0,001), для A. baumannii – в мае, апреле и октябре (p < 0,001). Для изолятов S. maltophilia четкой сезонности выделения не установлено (p < 0,48).

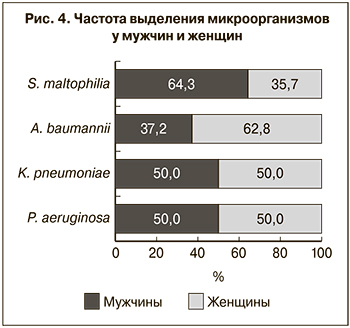 При сравнении частоты встречаемости данной группы микроорганизмов у 166 мужчин и 177 женщин было установлено, что изоляты P. aeruginosa и K. pneumoniae выделялись у мужчин и у женщин в равных количествах, A. baumannii в 1,7 раза чаще встречался у женщин (p < 0,01), а S. maltophilia – в 1,9 раза чаще у мужчин (p < 0,03) (рис. 4).
При сравнении частоты встречаемости данной группы микроорганизмов у 166 мужчин и 177 женщин было установлено, что изоляты P. aeruginosa и K. pneumoniae выделялись у мужчин и у женщин в равных количествах, A. baumannii в 1,7 раза чаще встречался у женщин (p < 0,01), а S. maltophilia – в 1,9 раза чаще у мужчин (p < 0,03) (рис. 4).
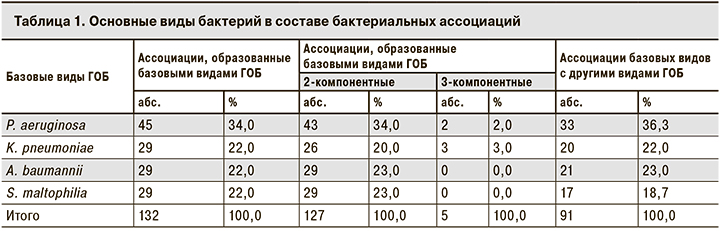
Исследование состава ассоциаций и монокультур, образованных P. aeruginosa, K. pneumoniae, A. baumannii и S. maltophilia, показало, что P. aeruginosa, в отличие от остальных, выделялся из биоматериалов совместно с другими бактериями чаще, но различия были незначимы (p < 0,12) (табл. 1).
Наиболее распространенными были 2-компонентные ассоциации бактерий (96,2%), на долю 3-компонентных пришлось всего 3,8%. Чаще других (в 69,0 % случаев) встречались их сочетания с ГОБ, в том числе друг с другом, что и определило характер преобладающих ассоциаций бактерий (p < 0,001): P. aeruginosa + S. maltophilia (10), P. aeruginosa + A. baumannii (9), K. pneumoniae + S. maltophilia (7), A. baumannii + S. maltophilia (6), P. aeruginosa + K. pneumoniae (4). Среди ГПБ S. pneumonia в 7,6%, а E. faecflis в 6,0% случаев обнаруживали в паре с ГОБ: P. aeruginosa + S. pneumoniae (4) и P. aeruginosa + E. faecflis (3), K. pneumoniae + S. pneumoniae (3) и K. pneumoniae + E. faecflis (4), S. maltophilia + S. pneumonia (1), A. baumannii + S. pneumonia (1), A. baumannii + E. faecflis (1). Основная часть изолятов P. aeruginosa, K. pneumoniae, A. baumannii и S. maltophilia находилась в биоматериалах в виде монокультур, что является показателем самостоятельности этих бактерий как патогенных агентов.
Анализ чувствительности бактерий к антибиотикам выявил высокую резистентность к карбапенемам, цефалоспоринам III и IV поколений, фторхинолонам. Карбапенемы (меропенем, имипенем) сохраняли низкую активность против A. baumannii в течение всего периода изучения в результате формирования популяции с приобретенной устойчивостью, обусловленной ферментом OXA-40, гены которого локализованы на плазмидах и легко распространяются в популяции. Другие типы ферментов OXA-23, OXA-58 и MBL IMP и NDM не были обнаружены. В динамике от начала к концу периода выросла устойчивость A. baumannii к цефалоспоринам: цефтазидиму и цефепиму с 64,3 до 89,0% (p < 0,04), цефоперазону/сульбактаму – с 50,0 до 94,0% (p < 0,001), нетилмицину – с 35,7 до 80,5 % (p < 0,001), гентамицину – с 60,7 до 85,4% (p < 0,04). Устойчивость K. pneumoniae к амоксициллину/клавуланату возросла с 55,6 до 92,8% (p < 0,001), эртапенему – с 0,0 до 29,0% (p < 0,001), тигециклину – с 12,7 до 52,2% (p < 0,001). Также возросла резистентность P. aeruginosa к цефтазидиму с 38,2 до 61,3% (p < 0,02), цефепиму – с 34,6 до 68,7% (p < 0,001), имипенему – с 41,8 до 63,7% (p < 0,03). Триметоприм/сульфаметоксазол сохранял активность более 50,0% в отношении S. maltophilia в течение всего периода. Этот микроорганизм показал 100%-ую устойчивость к меропенему и имипенему как проявление видоспецифического признака.
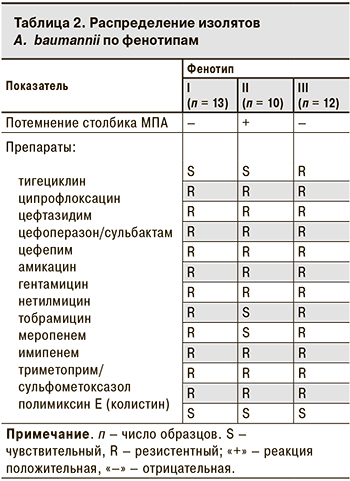 Наиболее часто ассоциированную устойчивость к 4 группам антибиотиков (карбапенемам, цефалоспоринам, аминогликозидам, фторхинолонам) выявлляли у A. baumannii – в 74 (41,8%) случаях. Кроме того, фенотипирование A. baumannii в 35 (19,8%) случаев выявило присутствие 3 морфотипов с различиями в способности вызывать потемнение столбика мясопептонного агара (МПА) до коричневого оттенка и минимальные изменения в антибиотикограмме, касающиеся 3 антибиотиков – нетилмицина, тобрамицина, тигециклина (табл. 2).
Наиболее часто ассоциированную устойчивость к 4 группам антибиотиков (карбапенемам, цефалоспоринам, аминогликозидам, фторхинолонам) выявлляли у A. baumannii – в 74 (41,8%) случаях. Кроме того, фенотипирование A. baumannii в 35 (19,8%) случаев выявило присутствие 3 морфотипов с различиями в способности вызывать потемнение столбика мясопептонного агара (МПА) до коричневого оттенка и минимальные изменения в антибиотикограмме, касающиеся 3 антибиотиков – нетилмицина, тобрамицина, тигециклина (табл. 2).
Присутствие β-лактамаз расширенного спектра (ESBL) выявлено у K. pneumoniae в 142 (78,9%) случаях. Полирезистентные изоляты K. pneumoniae, характеризующиеся ассоциированной устойчивостью к 7 группам антибиотиков (цефалоспоринам, аминогликозидам, фторхинолонам, ингибиторзащищенным и незащищенным аминопенициллинам, карбапенемам и глицилциклинам), были выявлены в 21 (11,7%) случае, к 5 группам (тот же набор, но без карбапенемов и глицилциклинов) – в 63 (35,0%).
Полирезистентность P. aeruginosa в 46 (23,8%) случаях определялась устойчивостью к основным группам антибиотиков, включая пенициллины с антисинегнойной активностью (пиперациллин, пиперациллин/тазобактам, тикарциллин, тикарциллин/клавуланат), цефалоспорины, карбапенемы, аминогликозиды, фторхинолоны, которые составили набор из 12 антимикробных препаратов. Стабильный морфотип P. aeruginosa характеризовался присутствием MBL VIM у 38 (19,7%) изолятов, которое сопровождалось резистентностью ко всем известным группам антибактериальных препаратов, за исключением колистина, и значениями МПК карбапенемов ≥ 32 мкг/мл. При этом продуценты MBL не обладали способностью синтезировать пигмент пиоцианин.
Обсуждение
Результаты проведенного мониторинга свидетельствуют о том, что P. aeruginosa, K. pneumoniae, A. baumannii и S. maltophilia в стационаре являются ведущими микроорганизмами, колонизирующими различные локусы организма пациентов, что в первую очередь важно для отделений реанимации, где грамотрицательная бактериальная нагрузка особенно велика. Эти микроорганизмы неспецифично колонизировали ткани и системы органов человека, в связи с чем они преобладали в НДП пациентов отделений реанимации, в которых основной биоматериал был получен из НДП, и в ранах пациентов хирургических отделений, в которых основным биоматериалом было отделяемое из ран. Очевидно, что распространение этих бактерий в стационаре не может ограничиваться специализацией отделений.
Преобладание P. aeruginosa, K. pneumoniae, A. baumannii и S. maltophilia в монокультурах, а не в ассоциациях характеризует их как самостоятельных патогенных агентов, способных колонизировать пациентов со сниженной способностью к аутостабилизации.
Рост устойчивости к основным группам современных антибиотиков (цефалоспоринам III и IV поколений, аминогликозидам, фторхинолонам, карбапенемам), выявленный у изученных нами видов бактерий, и их полирезистентность отражают прессинг применяемых антибиотиков в стационаре, способствующий формированию антибиотикорезистентных внутрибольничных штаммов, что согласуется с данными других авторов [6–9]. Распространение таких штаммов в стационаре повышает удельный вес выявляемых антибиотикорезистентных изолятов бактерий и затрудняет их фенотипирование. Возможным решением этой проблемы стало определение морфологических типов A. baumannii и P. aeruginosa по совокупности фенотипических признаков и антибиотикорезистентности.
Выявляемая в рамках мониторинга колонизация пациентов основными возбудителями ИСМП, распределение их по полу и локусам организма пациентов, изменения популяций этих бактерий в сезонной динамике и изменения чувствительности бактерий к антибиотикам оптимизируют надзор за основными возбудителями ИСМП в рамках медицинского учреждения.
Заключение
Таким образом, локальный бактериологический мониторинг, являясь частью региональных усилий по сдерживанию антибиотикорезистентности и распространения P. aeruginosa, K. pneumoniae, A. baumannii, S. maltophilia, способствует своевременному принятию адекватных профилактических, терапевтических и противоэпидемических мероприятий, а также поддержанию клинической эффективности применяемых в медицинской практике антимикробных агентов и разработке новых стратегий преодоления антибиотикорезистентности.



