В настоящее время инфекции, связанные с оказанием медицинской помощи (ИСМП), вызывают все большую озабоченность практических врачей. Одно из лидирующих положений среди возбудителей ИСМП занимает P. aeruginosa, и ее роль в развитии заболеваний неуклонно возрастает [1–4].
Антибиотикорезистентные штаммы (АБРШ) P. аeruginosa являются доказанной оппортунистической инфекцией у тяжелых пациентов, причиной поздних вентиляционных пневмоний, инфекций мочевых путей, ожоговых ран, раневых, катетер-ассоциированных инфекций и др. [5–9]. Результаты многоцентровых европейских исследований свидетельствуют о том, что до 30% случаев ИСМП в ОРИТ вызваны синегнойной палочкой [10–12]. Группу риска составляют пациенты с иммунодефицитными состояниями; пациенты, нуждающиеся в длительной респираторной поддержке; пациенты с различными имплантируемыми устройствами, травмами, ожогами и тяжелой соматической патологией [5, 9, 13–15].
Цель исследования – представить клиническую характеристику пациентов с синегнойной инфекцией с учетом антибиотикорезистентности выделенных штаммов P. aeruginosa.
Материалы и методы
Объектом исследования явились 79 пациентов, проходивших лечение в учреждениях здравоохранения (УЗ) стационарного типа г. Гродно (Беларусь) в 2019 г., у которых из образцов биологического материала при микробиологическом исследовании была выделена P. aeruginosa. Выполнен ретроспективный анализ медицинской документации включенных в исследование пациентов (истории болезни, выписные эпикризы, антибиотикограммы). Микробиологический мониторинг клинических изолятов P. аeruginosa осуществлялся на базе бактериологической лаборатории УЗ «Гродненская областная инфекционная клиническая больница» (центр коллективного пользования), куда поступал материал на исследование из стационаров г. Гродно: УЗ «Гродненская областная клиническая больница медицинской реабилитации», УЗ «Городская клиническая больница № 1», УЗ «Городская клиническая больница № 3», УЗ «Городская клиническая больница № 4», УЗ «Гродненская областная инфекционная клиническая больница». Материалом для микробиологического исследования в зависимости от локализации патологического процесса служили отделяемое из ран, мокрота, кал, моча и др.
Забор биологического материала проводили по классическим микробиологическим методикам. Культивацию микроорганизмов проводили на питательных средах российского производства. Рост P. Aeruginosa определяли по характерному сине-зеленому пигменту на мясо-пептонном агаре. Окончательную идентификацию выделенных микроорганизмов и определение антибиотикочувствительности проводили на микробиологическом анализаторе Vitek 2 Compact (bioMérieux, Франция). Чувствительность к антибиотикам части исследуемых культур проводили диско-диффузионным методом (ДДМ) на агаре Мюллера–Хинтона с использованием дисков фирмы Himedia (Индия). Для учета результатов производили измерение диаметра (принимая во внимание диаметр диска) задержки роста. Данные антибиотикограмм микроорганизмов оценивали с помощью аналитической компьютерной программы WHONET (США).
К АБРШ относились штаммы (MDR – multidrug resistance) с нечувствительностью как минимум к 1антибиотику в 3и более категориях антимикробных препаратов. Выделение АБРШ у пациентов с синегнойной инфекцией принималось за один из критериев наличия ИСМП.
С учетом полученных лабораторных данных по антибиотикочувствительности выделенных изолятов пациенты были разделены на 2 группы: в 1-ювошли 62 (78,5%) чел., инфицированных АБРШ P. aeruginosa, во 2-ю – 17 (21,5%) чел., инфицированных «дикими» штаммами (ДШ), чувствительными к широкому спектру тестируемых антибиотиков.
Статистическую обработку данных производили с использованием программ Statistica 10.0, Excel 2010. В качестве уровня статистической значимости принято значение p < 0,05.
Результаты
Из биологического материала пациентов, проходивших лечение в стационарах г. Гродно в 2019 г., были выделены 79 штаммов P. aeruginosa.
Характеристика пациентов представлена в табл.1.
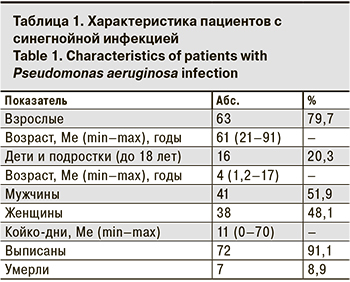
Как видно из табл. 1, среди пациентов с синегнойной инфекцией преобладали взрослые, их доля достоверно превышала долю детей – 79,7 и 20,3% соответственно (p < 0,05). Однако следует отметить, что госпитализация лиц до 18 лет осуществлялась лишь в Гродненскую областную инфекционную клиническую больницу (стационар смешанного типа), в остальные стационары госпитализировали лишь взрослых. Синегнойная инфекция встречается одинаково часто у мужчин и женщин (p > 0,05). В 7 случаях наступили летальные исходы, причиной которых служила основная патология (пневмония, онкопатология, перитонит, гангрена и др.), осложненная синегнойной инфекцией, что усугубило тяжесть течения заболевания.
Структура биологического материала, из которого в 2019 г. была изолирована P. aeruginosa, представлена на рис. 1 (см. на цветной вклейке).
Из общего количества клинических изолятов P. aeruginosa 22 (27,8%) штамма были получены из биологического материала, забор которого осуществлен до 48 ч госпитализации, 57 (72,2%) – из материала, забранного позже 48 ч госпитализации, что является одним из критериев определения госпитальных штаммов.
Результаты антибиотикорезистентности клинических изолятов P. aeruginosa представлены на рис. 2.
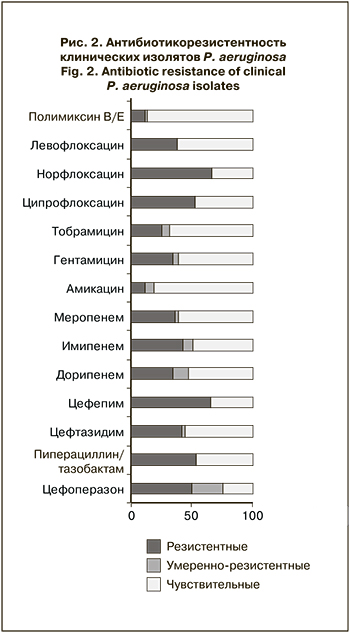
Наибольшая активность в отношении P. aeruginosa отмечена у полимиксинов, к которым оказались чувствительны 86,1% (95% ДИ 77,9–91,5) выделенных штаммов, что достоверно превышало частоту штаммов с резистентностью (11,4%) и промежуточной резистентностью (2,5%; p < 0,05). В отношении P. aeruginosa высокую активность in vitro по сравнению с другими антибиотиками демонстрировал амикацин, к которому оказались чувствительны 81,0% (95% ДИ 72,2–97,5) выделенных штаммов, что достоверно превышало долю умеренно резистентных (7,6%) и резистентных (11,4%) штаммов (p < 0,05). К другим аминогликозидам – гентамицину и тобрамицину – были чувствительны 60,6% (95% ДИ 51,2–70,0) и 68,2% (95% ДИ 58,3–76,3) исследуемых штаммов соответственно. Отмечена достаточно высокая резистентность P. aeruginosa к цефалоспоринам: резистентными оказались от 41,8 до 65,8%штаммов, карбапенемрезистентными были от 34,8 до 36,7%. При этом наиболее высока была чувствительность изолятов к меропенему – 60,8% (95% ДИ 51,2–70,0). Среди фторхинолонов наибольшая частота чувствительных штаммов установлена к левофлоксацину – 61,5% (95% ДИ 52,2–70,9). К ципрофлоксацину были чувствительны 47,5% (95% ДИ 38,5–57,7) выделенных образцов, к норфлоксацину – лишь 33,3% (95% ДИ 24,6–42,7), резистентными оказались 52,5 и 66,7% клинических изолятов P. aeruginosa соответственно. 78,5% (95% ДИ 68,2–86,1) пациентов оказались инфицированы АБРШ. Сравнительная характеристика клинических данных пациентов, инфицированных АБРШ и ДШ P. aeruginosa, представлена в табл. 2.
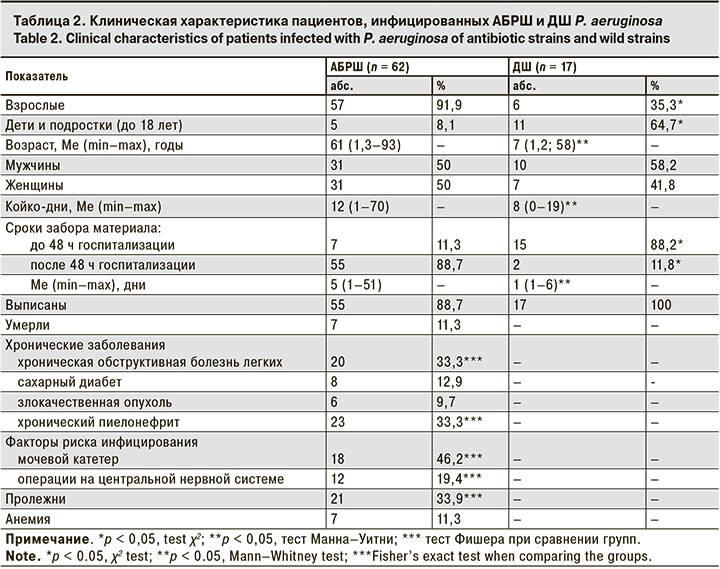
Как видно из табл. 2, среди пациентов, инфицированных АБРШ, взрослых было значительно больше, чем детей, пациенты этой группы были значительно старше и дольше находились на стационарном лечении. Кроме того, в данной группе присутствовали фоновые хронические заболевания, а также анемия, пролежни, наличие мочевых катетеров, которые являются факторами риска инфицирования АБРШ P. aeruginosa.
Обсуждение
P. aeruginosa распространяется повсеместно, длительно сохраняясь в водной среде, в том числе во многих растворах, применяемых в медицине (антисептики, жидкость для хранения контактных линз, растворы для мытья рук). Она встречается на слизистых оболочках и коже у большей части населения, представляя собой компонент симбионтной для человека микрофлоры [1, 2, 12]. Часто синегнойную палочку обнаруживают на объектах окружающей среды стационаров, особенно во влажных местах [6, 10]. Инфекции, вызванные этим микроорганизмом, характеризуются тяжелым течением и высокой летальностью из-за сложности выбора адекватного стартового режима антибактериальной терапии. P. aeruginosa – один из наиболее «проблемных» микроорганизмов в отношении рационального подбора этиотропной терапии как продуцент металло-бета-лактамаз, обладающий множественной антибиотикорезистентностью, передаваемой R-плазмидами, поэтому нозокомиальные штаммы P. аeruginosa обычно характеризуются устойчивостью ко многим потенциально эффективным антибиотикам [1, 6–8]. Наличие резистентности у многих штаммов P. аeruginosa к антибиотикам может отрицательно повлиять на течение эпидемического процесса в стационаре, а также создать проблемы при проведении антибактериальной терапии, что диктует необходимость проведения динамического мониторинга за возбудителем, циркулирующим в стационарах [16–18].
Среди исследуемых штаммов P. аeruginosa 7 клинических изолятов (8,9% всех выделенных штаммов) демонстрировали резистентность, близкую к панрезистентности, и оказались устойчивыми ко всем тестируемым антибиотикам. Однако необходимо учитывать, что антибиотикорезистентность указанных штаммов к колистину определялась ДДМ, что не исключает получения результата ложной резистентности из-за плохой диффузии в агар этого антибиотика с поверхности дисков. Тем не менее ДДМ используется в реальной клинической практике при определении антибиотикорезистентности к колистину, однако интерпретация полученных результатов должна проводиться с учетом указанных данных.
Результаты проведенного исследования подчеркивают важность учета факторов риска инфицирования антибиотикорезистентными возбудителями у пациентов при поступлении в стационар, фактов предыдущих госпитализаций и курсов антибактериальной терапии. Обращает на себя внимание, что у 11,3% (95% ДИ 5,6–21,5) пациентов, инфицированных АБРШ P. aeruginosa, забор биологического материала для бактериологического исследования был выполнен до 48 ч госпитализации в стационар, что формально исключает наличие внутрибольничной инфекции. Однако анализ медицинской документации пациентов показывает, что они имели хронические заболевания, получали курсы антибактериальной терапии, накануне были выписаны из других стационаров. Это позволяет считать причиной выделения АБРШ P. aeruginosa наличие у них ИСМП. Высокую частоту выделения АБРШ, полученных из биологического материала, забор которого у пациентов произведен в течение 48 ч после госпитализации в стационары, отмечают и другие авторы [8].
Полученные данные по антибиотикорезистентности указывают на снижение чувствительности АБРШ P. aeruginosa к антисинегнойным цефалоспоринам (цефоперазону и цефепиму), которые длительное время считались золотым стандартом лечения внутрибольничной синегнойной инфекции [17].
Обращает на себя внимание достаточновысокая чувствительность к аминогликозидам, в частности к амикацину и фторхинолону. Хотя по результатам ранее проведенных исследований в Беларуси (2011–2012 гг.), а также в Российской Федерации была показана низкая чувствительность АБРШ P. aeruginosa к этим препаратам, что может быть связано с изменением фенотипов антибиотикорезистентности P. aeruginosa с течением времени [17, 18].
Препаратом выбора в терапии тяжелых инвазивных инфекций, вызванных АБРШ P. aeruginosa, по результатам проведенного мониторинга, остается полимиксин, к которому отмечена и выделенные штаммы P. aeruginosa. наиболее чувствительны. Выбор антибиотиков для этиотропной терапии должен базироваться на данных антибиотикорезистентности выделенных у пациента возбудителей с учетом имеющихся у него факторов риска инфицирования АБРШ возбудителя.
Заключение
Синегнойная инфекция регистрируется в стационарах различного профиля и вызывает как локализованные, так и генерализованные воспалительные заболевания.
Она одинаково часто встречается как у мужчин, так и у женщин, и как у детей, так и у взрослых. Однако у госпитализированных взрослых пациентов достоверно чаще, чем у детей, отмечалось выделение АБРШ P. aeruginosa Среди выделенных изолятов P. aeruginosa превалировали АБРШ, составившие 78,5% (95% ДИ 68,2–86,1).
Синегнойная инфекция, вызванная АБРШ P. aeruginosa, наиболее часто встречается у взрослых с наличием фоновой хронической патологии, такой как сахарный диабет, хроническая обструктивная болезнь легких, хронический пиелонефрит, анемия, злокачественные опухоли; при наличии пролежней, длительно используемых мочевых катетеров; лиц, получавших курсы антибактериальной терапии; ранее госпитализированных.
У 11,3% (95%ДИ 5,6–21,5) пациентов АБРШ P. aeruginosa были выделены из биологического материала, забор которого произведен в течение 48 ч госпитализации, что может свидетельствовать о наличии у них ИСМП до госпитализации в стационар.
При анализе антибиотикорезистентности наибольшая активность в отношении клинических изолятов P. aeruginosa установлена у полимиксинов. Высокая антибиотикочувствительность P. aeruginosa отмечена также к аминогликозидам и левофлоксацину. Среди тестируемых карбапенемов антисинегнойная активность более выражена у меропенема. В группе цефалоспоринов наибольшей активностью среди тестируемых антибиотиков в отношении клинических изолятов P. aeruginosa обладал цефтазидим.
Для проведения рациональной этиотропной терапии необходим динамический мониторинг за фенотипами антибиотикорезистентности штаммов P. aeruginosa, циркулирующих в стационарах различного профиля. Выбор антибиотиков для этиотропной терапии должен базироваться на локальных данных по антибиотикорезистентности, с учетом имеющихся у пациента факторов риска инфицирования АБРШ возбудителя.



