Проблема антибиотикорезистентности в последнее время стала особенно актуальной. Для ВОЗ решение ее является одним из главных приоритетов [1]. Основным методом борьбы с инфекциями, вызванными полирезистентными бактериями, является не создание новых антимикробных препаратов, а разработка и внедрение эффективных мер по сдерживанию антибиотикорезистентности. Так, с 2012 г. существуют Российские национальные рекомендации «Стратегия и тактика применения антимикробных средств в лечебных учреждениях России» [2]. Этот документ в версии 2018 г. переименован в «Стратегию контроля антимикробной терапии при оказании стационарной медицинской помощи». В нем прописана роль каждого участника лечебного процесса, включая административное звено, клинического фармаколога, врача-эпидемиолога, а также микробиологической лаборатории. Одним из ключевых моментов в формирования стратегии и тактики применения антибиотиков в конкретном лечебном учреждении является анализ результатов идентификации и оценки антибиотикочувствительности возбудителей инфекций, выделенных в учреждении за определенный временной период [3].
Адекватная и своевременная эмпирическая антимикробная терапия нозокомиальных инфекций является обязательным условием снижения летальности, сокращения длительности лечения, а также затрат, непосредственно связанных с лечением [4]. Существующие на данный момент схемы эмпирической антимикробной терапии носят рекомендательный характер и требуют учитывать локальные данные об этиологической структуре заболевания и приобретенной резистентности микрофлоры [2–4]. Следует отметить, что на данный момент отсутствуют полноценные данные о распространенности полирезистентных штаммов нозокомиальных возбудителей, в том числе продуцентов карбапенемаз, как в Российской Федерации в целом и в отдельных ее регионах [3].
Целью данного исследования было выявление особенностей микробного спектра наиболее частых инфекций и чувствительности возбудителей к антимикробным препаратам в ведущем многопрофильном учреждении Республики Карелия – ГБУЗ «Республиканская больница им. В.А. Баранова» (Петрозаводск).
Материалы и методы
Проведен анализ результатов микробиологических исследований, выполненных в стационаре за 7 мес. – с апреля по ноябрь 2015 г.
Исследования выполняли в бактериологической лаборатории ГБУЗ «Республиканская инфекционная больница» в течение 4 мес., где получена микрофлора у 298 пациентов (данных о количестве отрицательных результатов нет), и в лаборатории «Ситилаб» (Санкт-Петербург) в течение 3 мес. За 3 мес. выполнено 552 исследования, из них в 367 (66,48%) выявлена микрофлора. В ряде случаев выявлено несколько возбудителей одновременно: по 2 возбудителя – у 74 пациентов, по 3 – у 15, в 4 случаях получено 4 возбудителя (при исследовании мочи, отделяемого из раны и мокроты). Использовали диско-диффузионный метод.
Использованы такие статистические методы обработки, как сводка данных, статистическая группировка с последующим табличным и графическим представлением полученной информации.
 Результаты
Результаты
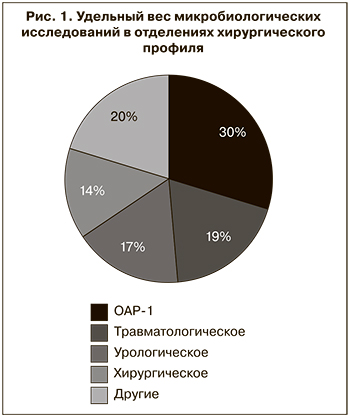
Большая часть исследований была проведена в отделениях стационара хирургического профиля (57,74%), среди которых основное место занимают отделение анестезиологии и реанимации № 1 (ОАР-1), травматологическое, урологическое и хирургическое (рис. 1).
Данные по другим отделениям (кардиохирургическому, нейрохирургическому, ЛОР, офтальмологическому, гинекологическому) не учитывали из-за небольшого числа исследований.
Наибольшее количество посевов выполнено в ОАР- 1, где за 7 мес. в 115 случаях выделена микрофлора, преимущественно в пробах мокроты (68,69%). Во всех случаях титр – диагностически значимый (более 105 КОЕ/мл), в качестве возбудителя чаще всего выделяли Acinetobacter baumanii (41,77%) и Klebsiella pneumoniae (27,84%). Выделенная микрофлора отличалась резистентностью к большинству антибиотиков. Так, лишь 23,07% штаммов Acinetobacter baumanii были чувствительны к ципрофлоксацину, еще – к цефепиму, амикацину, цефтазидиму и меропенему. Klebsiella pneumoniae в 63,64% случаев сохраняла чувствительность к амикацину и лишь в 31,82% – к меропенему (рис. 2). Во всех случаях микрофлора носила нозокомиальный характер, то есть посевы выполняли более чем через 48 ч. пребывания больных в стационаре, поводом для исследования служила ИВЛ-ассоциированная пневмония или гнойный эндобронхит с системной воспалительной реакцией.

В травматологическом отделении за 7 мес. микрофлора выделена у 72 пациентов, преобладали посевы раневого отделяемого (91,30%). Чаще всего выделялся Staphylococcus aureus (76,19%), у 3 пациентов – в сочетании с другими возбудителями (Klebsiella pneumoniae, Acinetobacter baumanii). Чувствительность к оксациллину документирована у 36,11% штаммов, при этом среди пациентов, у которых выделен метициллин-чувствительный золотистый стафилококк (MSSA), преобладали больные, обследованные до 48 ч от поступления в стационар (66,67%). Среди обследованных были пациенты с обострением хронического остеомиелита, посттравматическими и послеоперационными инфекциями мягких тканей, костей и суставов.
 В урологическом отделении микрофлора получена у 62 пациентов, чаще всего исследовали мочу (83,57%), и во всех случаях диагностировали осложненная инфекция мочевыводящих путей. Среди возбудителей наиболее часто выявляли Enterococcus spp. и Klebsiella pneumoniae, несколько реже – E. coli и Proteus mirabilis, а также Acinetobacter baumanii, Pseudomonas aeruginosa, Staphylococcus spp. (рис. 3). В ряде случаев выявлялась микробная ассоциация из 2 возбудителей, наиболее часто встречаемых в этом отделении. Среди полученных штаммов Enterococcus spp. половина была резистентна к гентамицину при наличии чувствительности к ванкомицину. Klebsiella pneumoniae в 83,33% случаев была чувствительна к амикацину, в 41,67% – к цефотаксиму, в 16,67% – к ципрофлоксацину. E. coli во всех случаях сохраняла чувствительность к амикацину, в 50% – к цефотаксиму и ципрофлоксацину. Proteus mirabilis в половине случаев был чувствителен к ципрофлоксацину, амикацину и цефотаксиму. Следует отметить, что в случае исследования чувствительности к карбапенемам и фосфомицину все возбудители инфекций мочевыводящих путей были восприимчивы, однако такие тесты выполнялись не всегда. Не изучалась чувствительность к цефоперазону/сульбактаму, пиперациллину/тазобактаму, левофлоксацину.
В урологическом отделении микрофлора получена у 62 пациентов, чаще всего исследовали мочу (83,57%), и во всех случаях диагностировали осложненная инфекция мочевыводящих путей. Среди возбудителей наиболее часто выявляли Enterococcus spp. и Klebsiella pneumoniae, несколько реже – E. coli и Proteus mirabilis, а также Acinetobacter baumanii, Pseudomonas aeruginosa, Staphylococcus spp. (рис. 3). В ряде случаев выявлялась микробная ассоциация из 2 возбудителей, наиболее часто встречаемых в этом отделении. Среди полученных штаммов Enterococcus spp. половина была резистентна к гентамицину при наличии чувствительности к ванкомицину. Klebsiella pneumoniae в 83,33% случаев была чувствительна к амикацину, в 41,67% – к цефотаксиму, в 16,67% – к ципрофлоксацину. E. coli во всех случаях сохраняла чувствительность к амикацину, в 50% – к цефотаксиму и ципрофлоксацину. Proteus mirabilis в половине случаев был чувствителен к ципрофлоксацину, амикацину и цефотаксиму. Следует отметить, что в случае исследования чувствительности к карбапенемам и фосфомицину все возбудители инфекций мочевыводящих путей были восприимчивы, однако такие тесты выполнялись не всегда. Не изучалась чувствительность к цефоперазону/сульбактаму, пиперациллину/тазобактаму, левофлоксацину.
В хирургическом отделении микрофлора выделена у 55 пациентов, преобладали больные с интраабдоминальной патологией. Наиболее часто исследовали раневое отделяемое (80%). В качестве возбудителя чаще всего выступал Staphylococcus aureus (27,5%), реже – другие возбудители (Klebsiella pneumoniae – 15,0%, E. coli, Acinetobacter baumannii, Enterococcus spp. – по 12,5%). В 60% случаев золотистый стафилококк был чувствителен к оксациллину. E. coli во всех исследованиях сохраняла чувствительность к амикацину и меропенему, в 60% исследований – к ципрофлоксацину и лишь в 20% – к цефотаксиму. Acinetobacter baumanii во всех случаях были чувствительны только к амикацину и меропенему, у половины больных – к ампициллину/сульбактаму. Klebsiella pneumoniae в 30% была чувствительна к ципрофлоксацину и цефотаксиму, и во всех случаях – к амикацину и меропенему. Все представители Enterococcus spp. были резистентны к гентамицину, сохраняя чувствительность к ванкомицину.
Таким образом, на основании проведенного анализа было установлено:
- наиболее часто микрофлора исследуется в хирургическом, травматологическом, урологическом отделениях и отделении ОАР-1, куда госпитализируют преимущественно пациентов хирургического профиля;
- в ОАР-1 чаще всего исследуется мокрота, в которой в основном выявляют Klebsiella pneumoniae и Acinetobacter baumanii, обладающие наибольшей резистентностью к антимикробным препаратам, включая карбапенемы, в сравнении со штаммами, полученными в других отделениях. При этом Klebsiella pneumoniae в большинстве случаев чувствительна к амикацину;
- в урологическом и хирургическом отделениях грамотрицательные возбудители в 100% случаев чувствительны к карбапенемам;
- в травматологическом отделении в качестве возбудителя превалирует золотистый стафилококк, при этом метициллин-чувствительные штаммы в большинстве случаев получены у пациентов с внебольничной микрофлорой.
Обсуждение
Учитывая особенности микрофлоры в ОАР-1, целесообразно более широко использовать амикацин при проведении эмпирической терапии нозокомиальной инфекций респираторного тракта, при возможности – ингаляционно [1]. Относительно большей чувствительности выделенной микрофлоры к цефалоспоринам, фторхинолонам in vitro, чем к антисинегнойным карбапенемам, отметим, что, согласно литературным данным [1, 3], карбапенемазопродуцирующие штаммы грамотрицательных возбудителей обычно устойчивы к карбапенемам и остальным бета-лактамам резистентны к большинству антибиотиков других классов (аминогликозидам, фторхинолонам) и при этом сохраняют чувствительность к полимиксину, тигециклину и фосфомицину [3, 4]. Для преодоления резистентности в некоторых случаях (с учетом вида карбапенемаз и значения минимальной подавляющей концентрации) достаточно применения продленной инфузии меропенема, в других случаях требуется повышение дозы до максимальной, комбинация с другими препаратами (полимиксином, тигециклином, фосфомицином, аминогликозидами). Для решения вопроса о том, какой метод в каждом конкретном случае является предпочтительным, желательно иметь информацию о минимальной подавляющей концентрации и наличии у выделенного штамма карбапенемаз. Возможность выполнения таких исследований необходимо согласовать с возможностями микробиологической лаборатории.
В качестве возможной причины отсутствия резистентности к карбапенемам у микроорганизмов, выделенных от пациентов урологического и хирургического отделений, можно представить более редкое использование данной группы антимикробных препаратов в этих отделениях. Следует указать, что карбапенемы являются здесь антибиотиками резерва, и их назначение требует согласования с клиническим фармакологом. Соответственно клинический фармаколог оценивает показания к назначению, а также мониторирует адекватность дозировки, длительность терапии. В то же время в отделениях реанимации, куда госпитализируют пациентов в критическом состоянии, а карбапенемы нередко назначают в качестве стартовой терапии, используется режим деэскалации. К сожалению, не всегда возможен перевод больного на этиотропную терапию из-за большого количества «отрицательных» результатов микробиологических исследований, что закономерно продлевает срок лечения карбапенемами и провоцирует большую резистентность, нежели в других отделениях стационара. Кроме того, в условиях ОРИТ бактерии в большей степени, нежели в других отделениях, подвергаются практически постоянному и наиболее интенсивному воздействию высоких концентраций антибактериальных препаратов, что приводит к большему риску формирования генетических линий множественно устойчивых бактерий [3]. Доступной на данный момент тактикой сдерживания резистентности к карбапенемам представляется активный мониторинг качественного выполнения микробиологических исследований и своевременный перевод пациентов на этиотропную терапию.
Кроме того, имеет смысл более полноценно (более длительно, с включением препаратов локального антимикробного формуляра в перечень исследований) изучить микробную чувствительность в отделении и в соответствии с полученными результатами провести ротацию антимикробных препаратов [5].
Особенно важным представляется согласование с выполняющей микробиологические исследования лабораторией перечня антимикробных препаратов, присутствующих в антимикробном формуляре стационара, чувствительность к которым нужно исследовать для конкретных возбудителей, учитывая, несомненно, регламентирующий документ по методике выполнения посевов [1]; при этом, как указывалось ранее, следует обговорить возможность указания минимальной подавляющей концентрации препаратов, особенно в случаях выявления полирезистентной микрофлоры, а также детекцию карбапенемаз с использованием ПЦР-диагностики [4].
Еще одним необходимым фактором для грамотной микробиологической диагностики является обучение медицинского персонала методике забора, транспортировки и хранения биоматериалов для посева, которое должно происходить с определенной периодичностью, что увеличит долю «положительных» посевов и позволит в большей доле случаев адекватно проводить этиотропную терапию.
Заключение
В нашей работе представлен анализ результатов микробиологических исследований, полученных в стационаре за 7 мес. Результаты исследования имеют практическое значение для обоснования рационального выбора стартовой терапии в конкретном лечебном учреждении. Полученная информация важна и для формирования представления об антибиотикорезистентности нозокомиальных штаммов в Северо-Западном федеральном округе в целом.
Помимо мониторинга антибиотикорезистентности, применение методов, ограничивающих нерациональное назначение антимикробных препаратов, назначение их без показаний («профилактическое»), контроль за длительностью терапии и дозами применяемых препаратов, учет нежелательных эффектов применяемых средств позволят снизить темп нарастания устойчивости возбудителей к антибиотикам.
В свою очередь, продуманная с учетом локального микробного пейзажа эмпирическая антимикробная терапия, своевременная и адекватная микробиологическая диагностика с последующим переводом больных на рациональную этиотропную терапию позволят улучшить прогноз у пациентов отделений реанимации, уменьшить количество полирезистентных штаммов возбудителей в стационаре и, соответственно, расходы на лечение инфекций, ими вызванных.



