Пандемия COVID-19 продолжает вызывать огромный глобальный кризис в области здравоохранения, унесший более 6 млн жизней. Общий уровень летальности от COVID-19 составляет ~1%, и около 3–20% людей с COVID-19 нуждаются в госпитализации, из которых значительная часть (10–30%) требуют интенсивной терапии, создавая большую нагрузку на систему здравоохранения [1–3].
Традиционно COVID-19 обсуждается в контексте поражения легких, однако у многих пациентов также развиваются различные сердечные осложнения [4]. Диапазон симптомов может варьировать от незначительных, таких как боль в груди, слабость и одышка, до более выраженной недостаточности левого и правого желудочков, аритмий, кардиогенного шока и внезапной сердечной смерти. Приблизительно у 20–30% госпитализированных пациентов с COVID-19 в остром периоде регистрируются биохимические признаки поражения миокарда, о чем свидетельствует повышенный уровень тропонина [5]. Поражение сердца при COVID-19 в первую очередь связывают с прямой инвазией вируса в кардиомиоциты и последующей их гибелью, поражением эндотелиальных клеток с развитием эндотелиита, изменением транскрипции нескольких типов клеток в ткани сердца, активацией комплемента, комплемент-опосредованной коагулопатией и микроангиопатией, снижением экспрессии ангиотензинпревращающего фермента 2 типа (ACE2) и нарушением регуляции ренин-ангиотензин-альдостероновой системы, вегетативной дисфункцией. Системный воспалительный ответ вследствие пролиферации и гиперактивности Т-лимфоцитов и макрофагов, помимо повышения уровня цитокинов и хемокинов, связывают с последующим фиброзом и рубцеванием сердечной ткани вследствие гиперпродукции TGF-β [6–8]. Интеграция генома SARS-CoV-2 в ДНК инфицированных клеток человека, которые затем могут экспрессироваться в виде химерных транскриптов, сливающихся с клеточными последовательностями, при сохраняющейся активации иммуновоспалительно-прокоагулянтного каскада в сочетании с аномальным персистирующим гиперактивным иммунным ответом и выработкой аутоантител, рассматривается как патогенетический механизм ряда сердечно-сосудистых осложнений COVID-19 [9]. Также важное значение имеют воспаление и/или повреждение коронарной бляшки либо ее разрыв, что ведет к острой ишемии миокарда [8].
Клинические наблюдения свидетельствуют о корреляции тяжести заболевания с коморбидностью пациентов, включая диабет, гипертонию, ожирение/метаболический синдром и иммунодефицитное состояние [4]. Чем тяжелее заболевание, тем выше вероятность повреждения сердца и, следовательно, более серьезных сердечных осложнений, начиная от аритмий и заканчивая миокардитом, впервые возникшей кардиомиопатией, инфарктом миокарда и тромбоэмболией. Сообщается, что эти сердечные проявления имеют кумулятивную заболеваемость 20–40%, что приводит к значительному увеличению заболеваемости и смертности, когда они связаны с COVID-19 [5].
Доказано, что худший прогноз течения COVID-19 имеют пациенты с сердечно-сосудистыми заболеваниями, что влечет за собой увеличение смертности в 5–10 раз [10]. Однако развитие кардиальной патологии и сердечно-сосудистых осложнений, таких как сердечная недостаточность, миокардит, перикардит, васкулит и сердечные аритмии, на фоне инфекции COVID-19 возможно и у пациентов, не имеющих кардиальной патологии в анамнезе [11]. На это указывает повышение уровней тропонина I и мозгового натрийуретического пептида (NTproBNP) у 8–28% пациентов с COVID-19 [12, 13].
При инфекции COVID-19 наряду с изменением уровней тропонина I и NTproBNP отмечается повышение уровней ИЛ-6 и D-димера, что указывает на усиление системного воспаления и реакции коагуляции. Повышение значений 2 последних показателей обуславливает развитие острого коронарного синдрома и его осложнений [14]. Своевременное их определение позволяет оценить вероятность развития сердечно-сосудистых осложнений у пациентов с COVID-19 [6–8].
Также требуют изучения вопросы последствий воздействия COVID-19 на сердечно-сосудистую систему и формирование хронической кардиальной патологии.
Цель исследования – изучение патогенетических особенностей формирования и прогрессирования поражения сердца при COVID-19 с оценкой предтестовой вероятности возникновения ишемической болезни сердца в исходе заболевания.
Материалы и методы
Выполнено простое описательное исследование, основанное на анализе клинико-лабораторных параметров обследования 180 пациентов, проходивших стационарное лечение в ГБУЗ «Пензенский областной клинический центр специализированных видов медицинской помощи» и ГБУЗ «Пензенская районная больница» в 2020–2021 гг. с диагнозом «новая коронавирусная инфекция COVID-19 (подтвержденная), среднетяжелая форма». Критерии включения: возраст от 18 до 90 лет, подтвержденный лабораторно COVID-19 у пациента, наличие информированного согласия. Критерии исключения: возраст моложе 18 и старше 90 лет, беременность, отсутствие лабораторно подтвержденного диагноза COVID-19 у пациента и отсутствие информированного добровольного согласия.
Диагноз новой коронавирусной инфекции был установлен на основании выявления РНК SARS-COV-2 методом ПЦР в мазках из носо- и ротоглотки (100%). Для оценки состояния пациентов в периоде стационарного лечения проводились физикальное обследование, оценка жизненных показателей, пульсоксиметрия с измерением SpО2. Лабораторное обследование пациентов включало общий анализ крови, общий анализ мочи, биохимический анализ крови. Дополнительно определяли уровни биохимических, иммунологических и кардиомаркеров: ИФН-α, ИЛ-6, ИЛ-17, макрофагального белка воспаления (MIP-1β), NTproBNP, тропонина I (Tr I), белка, связывающего жирные кислоты (БСЖК), C-реактивного белка (СРБ).
Всем пациентам была выполнена компьютерная томография (КТ), позволившая оценить объем и характер поражения легких – КТ-2 (25–50%), что соответствовало средней степени тяжести заболевания. Дополнительное инструментальное исследование включало электрокардиографию (ЭКГ), эхо-кардиографию (ЭхоКГ). Динамику данных показателей наблюдали в определенные временные интервалы: первые 72 ч госпитализации, через 2 нед. (14 ± 3 сут.), спустя 3 мес. (90 ± 3 сут.).
Для оценки рисков возникновения кардиальной патологии после перенесенной инфекции COVID-19 использовали шкалу предтестовой вероятности (ПТВ) развития хронической ишемической болезни сердца (ИБС) согласно Клиническим рекомендациям по стабильной ИБС (2020) [15].
Типичная стенокардия в данной таблице соответствовала 3 характеристикам:
а) дискомфорт за грудиной или в шее, челюсти, плече или руке;
б) провоцируется физической нагрузкой;
в) проходит в покое или после приема нитратов в течение 5 мин. Атипичная стенокардия в данном случае должна соответствовать 2 из 3 вышеуказанных характеристик. Боль некоронарного характера соответствовала лишь одной из этих характеристик или не соответствовала им вообще.
Если по результатам первичных исследований априорная вероятность хронической ИБС превышает 85%, дальнейшие исследования для уточнения диагноза можно не проводить, а приступать к стратификации риска осложнений и назначению лечения. Если по результатам первичных исследований априорная вероятность хронической ИБС не превышает 15%, следует заподозрить функциональное заболевание сердца или некардиальные причины симптомов. Пациентов с промежуточной априорной вероятностью ИБС (15–85%) направляют на дополнительные неинвазивные визуализирующие исследования, к которым относятся нагрузочная ЭКГ, стресс-ЭхоКГ, стресс-магнитно-резонансная томография (стресс-МРТ) и т. д.
Статистическую обработку полученных данных проводили с использованием программного обеспечения Microsoft Office (Microsoft Excel), а также статистического пакета STATISTICA 9.0. Оценивали относительные и абсолютные показатели: процентное выражение ряда данных (%), расчет среднего арифметического (M), стандартного отклонения (SD), медианы (Me), максимального и минимального значений. Для анализа качественных переменных применяли критерии непараметрической статистики, количественных – критерии параметрической или непараметрической статистики после проверки распределений на соответствие нормальности распределения. Для оценки различий между показателями использовался t-критерий Уэлча. Различия считались достоверными при р ≤ 0,05, недостоверными – при р ≥ 0,05.
Результаты
Средний возраст пациентов составил 48,5 года [35; 65]: мужчин – 46,7 года [45;65], женщин – 48,3 года [35;63]; мужчин было 84 (46,6%), женщин – 96 (53,4%) человек.
Для пациентов с инфекцией COVID-19, имеющих риски развития кардиальной патологии, свойственно наличие факторов риска, список которых формировался на основании Клинических рекомендаций по диагностике и лечению стабильной ИБС (2020). Среди немодифицируемых факторов риска учитывались возраст, пол, отягощенный семейный анамнез (подтвержденный диагноз инфаркта миокарда или ишемического инсульта у родственников 1-й линии, у женщин – до 65 лет, у мужчин – до 55 лет).
Больные COVID-19 мужчины попадали в группу с повышенным риском ИБС в 100% случаев, женщины – в 81,3% случаев (78 чел.). Отягощенный семейный анамнез имели 27 (32,1%) мужчин и 21 (21,9%) женщина. Наиболее частыми модифицируемыми факторами риска ИБС, выявленными у больных COVID- 19, являлись избыточная масса тела (у 75% мужчин и 43,8% женщин), курение (42,9 и 15,6% соответственно), артериальная гипертензия (32,1 и 50%), сахарный диабет (28,6 и 18,8%), дислипопротеинемия (57,1 и 34,4%). Ни в одном случае не выявлено наличие до заболевания COVID-19 аритмии и ИБС/стенокардии.
Ожирение 2-й степени с ИМТ ≥ 35 имели 6 (7,1%) мужчин, ожирение 1-й степени с 30 ≤ ИМТ ≤ 35 – 27 больных [15 (17,9%) мужчин и 12 (9,4%) женщин], избыточную массу тела с 25 ≤ ИМТ ≤ 30 – 72 больных [42 (50%) мужчины и 30 (34,4%) женщин].
Артериальная гипертензия (АГ) до заболевания инфекцией SARS-CoV-2 была зарегистрирована у 32,1% мужчин и 50% женщин. При этом 3-я степень АГ наблюдалась у 6 (7,1%) мужчин и 12 (12,5%) женщин, 2-я степень – у 9 (10,7%) мужчин и 15 (15,6%) женщин, 1-я степень – у 12 (14,3%) мужчин и 21 (21,9%) женщины. У 17,9% мужчин и 9,4% женщин выявлено сочетание сахарного диабета и АГ. Во всех случаях регистрировали сахарный диабет 2-го типа.
Дислипопротеинемия у 39,3% мужчин и 28,1% женщин регистрировалась на фоне избыточной массой тела или ожирения. Среди мужчин частота ожирения 1-й и 2-й степени составила 25%, а у 14,3% отмечена избыточная масса тела. Среди женщин, напротив, чаще регистрировали избыточную массу тела с 25 ≤ ИМТ ≤ 30 – 25%, а число пациенток с 1-й степенью ожирения и дислипопротеинемией составило 9,4%.
Исходя из приведенных выше данных, определено, что комбинация модифицируемых факторов риска, являющихся ключевыми компонентами метаболического синдрома, у пациентов с инфекцией COVID-19 явилась определяющим фактором риска поражения как у мужчин, так и у женщин в возрасте 35–65 лет.
Среди сопутствующей некардиальной патологии у больных с инфекцией COVID-19 встречались хронический бронхит (у 10,7% мужчин и 6,3% женщин), хронический тонзиллит (у 7,1 и 6,3% соответственно), хронический фарингит (у 7,1 и 12,5%), хронический панкреатит (у 7,1 и 9,4%), язвенная болезнь желудка и двенадцатиперстной кишки (у 3,6 и 9,4%), хроническая болезнь почек (у 3,6 и 6,3%), хронический пиелонефрит (у 7,1 и 6,3%), остеохондроз шейного отдела позвоночника (у 7,1 и 12,%), хроническая ишемия головного мозга (у 7,1 и 9,4%), тревожно-депрессивное расстройство (у 6,3% женщин).
Вся сопутствующая некардиальная патология имела изолированный вариант. Общее число больных инфекцией COVID-19, имеющих сопутствующую патологию, составило 135 (75%). Распределение по гендерным признакам показало, что сопутствующую некардиальную патологию имели 64,3% мужчин и 84,4% женщин.
Для первичной оценки состояния сердечно-сосудистой системы использовали метод опроса с выявлением кардиальных жалоб, а также рутинные методы обследования, включающие измерение пульса и артериального давления. Среди жалоб, которые предъявляли пациенты с новой коронавирусной инфекцией, боли в области сердца наблюдались у 36 пациентов и имели как стенокардитический (типичный, атипичный), так и некоронарный характер. В отношении сердечно-сосудистой системы необходимо отметить головную боль и боль в области сердца. Головная боль, выявленная у 30 пациентов при сборе жалоб и анамнеза, имела характер давящей и сжимающей в затылочной области и в 100% случаев встречалась у пациентов с АГ. В остром периоде заболевания 33 пациента имели нарушения ритма сердца – блокаду правой ножки пучка Гиса, фибрилляцию предсердий и ускоренный синусовый ритм. У 6 пациентов нарушения ритма носили жизнеугрожающий характер и сопровождались значимым удлинением интервала Q–T.
Для оценки поражения сердца у всех пациентов осуществляли контроль маркеров миокардиального повреждения – БСЖК и Тr I и маркера миокардиальной дисфункции – NTproBNP. Показателей оценивали при госпитализации и спустя 2 нед. после нее. Динамическая оценка маркеров повреждения сердца представлена в табл. 1.
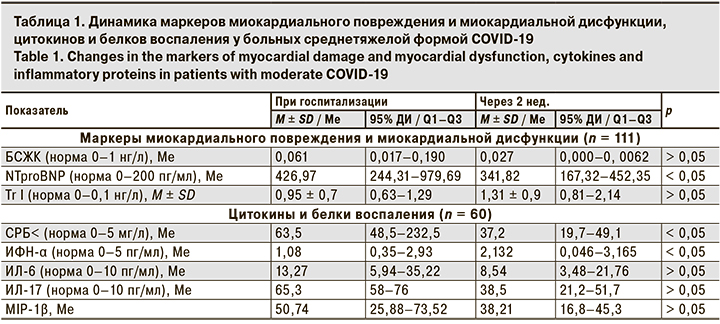
Анализ уровней маркеров миокардиального повреждения в начале заболевания выявил достоверное повышение среднего уровня Tr I (у 53,3% больных – более чем в 3 раза) и уровня БСЖК (у 8,8% больных), что может говорить о раннем поражении кардиомиоцитов у больных COVID-19, не имевших в анамнезе заболеваний сердца. Одновременно у 45% больных регистрировалось достоверное повышение уровня NTproBNP, свидетельствовавшее о развитии сердечной недостаточности острого периода COVID-19.
Увеличение числа пациентов с повышенным уровнем Тr I ко 2-й неделе госпитализации (68,3% больных COVID-19) свидетельствует о нарастании острого миокардиального повреждения. Мониторинг уровня NTproBNP выявил снижение числа пациентов с его повышенным уровнем с 45% при госпитализации до 26,7% ко 2-й неделе стационарного лечения, что можно объяснить активацией адаптационных процессов в сердце на фоне снижения влияния цитокинового шторма на его функцию.
Проведен анализ динамики уровней цитокинов – ИФН-α, ИЛ-6, ИЛ-17, MIP-1B, а также уровня СРБ. У пациентов со среднетяжелой формой COVID-19 при госпитализации отмечено достоверное повышение уровней ИЛ-17, MIP-1β и СРБ. Анализ корреляции уровней маркеров поражения сердца, хемокинов и белков воспаления в начальном периоде COVID-19 у пациентов, не имевших ранее кардиальной патологии, выявил ряд особенностей. Так, сывороточный ИЛ-17 положительно коррелировал с уровнем NTproBNP (r = 0,51; p < 0,01) и Tr I (r = 0,31; p < 0,01) и обратно коррелировал с сывороточным уровнем ИЛ-6 (r = -0,42; p = 0,02), а также ИФН-α (r = -0,72; p = 0,03). Уровень MIP-1β в начале заболевания положительно связан с уровнем NTproBNP (r = 0,61; p < 0,01) и Tr I (r = 0,46; p < 0,01) и обратно коррелировал с уровнем ИФН-α (r = -0,31; p = 0,04), а также СРБ (r = -0,31; p = 0,04). Кроме того, мы обнаружили, что существуют положительные корреляции между сывороточным ИФН-α и ИЛ-6 (r = 0,13; p = 0,03) и отрицательная – с концентрацией тропонина (r = – 0,35; p = 0,02) у больных COVID-19.
Для определения структуры впервые возникшей кардиальной патологии у больных COVID-19 дополнительно оценивали результаты ЭКГ и ЭхоКГ. По данным ЭКГ были выявлены признаки стенокардии и инфаркта миокарда, гипертрофии и перегрузки отделов сердца, аритмии. Результаты исследования представлены в табл. 2.
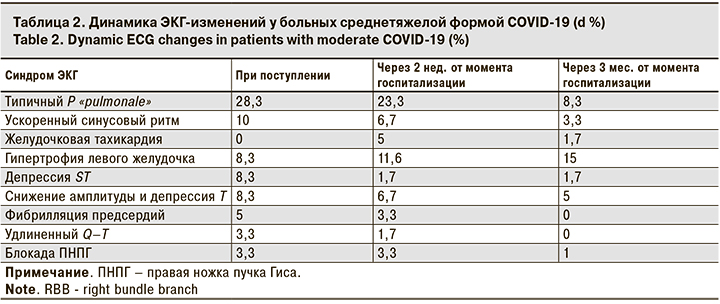
Наиболее часто в остром периоде COVID-19 регистрировали зубец P «pulmonale» (у 28,3% пациентов), свидетельствовавший о наличии легочной гипертензии с выраженной правопредсердной фазой. При этом амплитуда (≥ 2,5 мм) зубца Р во всех случаях не укладывалась в значения нормы. Наряду с изменениями зубца Р в 3,3% случаев наблюдалась диастолическая перегрузка, проявляющаяся полным нарушением проводимости по правой ножке пучка Гиса. Ускоренный синусовый ритм, наряду с тахипноэ, является также отражением дыхательной недостаточности. Запуск аритмогенеза в виде желудочковой тахикардии и фибрилляции предсердий (5% случаев) является отражением прямого кардиотоксического действия вируса наряду с проводимой терапией. Удлиненный Q–T на фоне желудочковой тахикардии отягощает прогноз кардиальной патологии, тем самым повышая риск внезапной сердечной смерти. Депрессия сегмента ST в 3 случаях явилась отражением развивающегося инфаркта миокарда, подтвержденного результатами определения уровня Tr I, а в остальных 12 случаях – признаком впервые возникшей стенокардии, классифицированной в дальнейшем в стенокардию напряжения. Снижение амплитуды и депрессия Т также могут выступать признаками стенокардии, при этом являясь, наряду с изменением сегмента ST, начальным неспецифическим признаком острого миокардиального повреждения. Гипертрофия левого желудочка имеет место быть у пациентов с неконтролируемой АГ в случае повышения значений систолического артериального давления выше 160 мм рт. ст.
При сравнении показателей ЭхоКГ обследованные пациенты были распределены в 2 группы – не имевшие признаков кардиальной патологии в остром периоде COVID-19 и имевшие повышение лабораторных маркеров некроза миокарда и миокардиальной дисфункции в сочетании с ЭКГ-изменениями. Полученные результаты представлены в табл. 3.
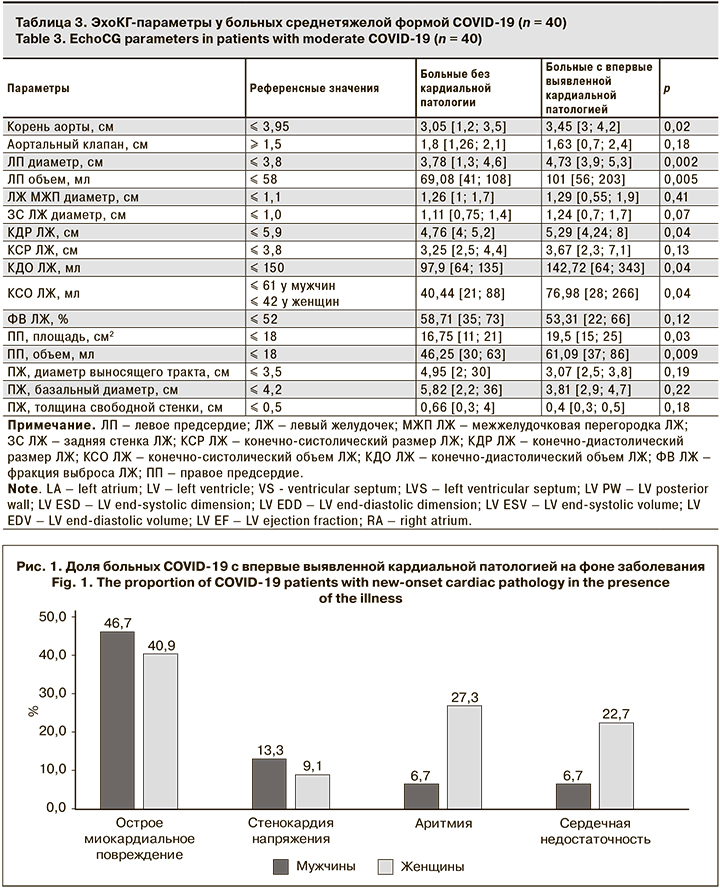
Как видно из представленных данных, в остром периоде у больных COVID-19 с повышением маркеров миокардиального повреждения и миокардиальной дисфункции, а также ЭКГ-изменениями выявляли достоверное увеличение объема и площади правого предсердия, увеличение диаметра левого предсердия и 2-кратное увеличение его объема, а также возрастание конечного систолического объема левого желудочка, что свидетельствовало о перегрузке правых и левых отделов сердца с развитием различной клинической симптоматики в будущем и повышением рисков развития декомпенсированной патологии сердца.
Таким образом, на основании комплексной оценки полученных результатов клинико-лабораторных и инструментальных исследований у пациентов, не имевших в анамнезе указаний на заболевание сердца, больных COVID-19, за период заболевания диагностировано развитие острого миокардиального повреждения в 43,8% случаев, стенокардии напряжения – в 11,2%, аритмии – в 27%, сердечной недостаточности – в 14,7%.
Структура впервые диагностированной кардиальной патологии у больных COVID-19 имела гендерные различия (рис. 1). Так, острое миокардиальное повреждение достоверно чаще регистрировалось у мужчин (p = 0,03), а нарушения ритма сердца и сердечная недостаточность – у женщин (p < 0,01). В трети случаев данные нарушения имели сочетанный характер.
Среди пациентов с жалобами на боли в области сердца (20%) была проведена оценка ПТВ развития ИБС. Распределение пациентов по характеру впервые возникшей боли в области сердца представлено на рис. 2. Наиболее часто у реконвалесцентов COVID-19 наблюдались некоронарная боль (66,6% предъявлявших жалобы), типичная и атипичная стенокардическая боль (17%). В остром периоде COVID-19 стенокардитические боли отмечены главным образом у пациентов с острым миокардиальным повреждением (66,7%) и аритмией (33,3%).
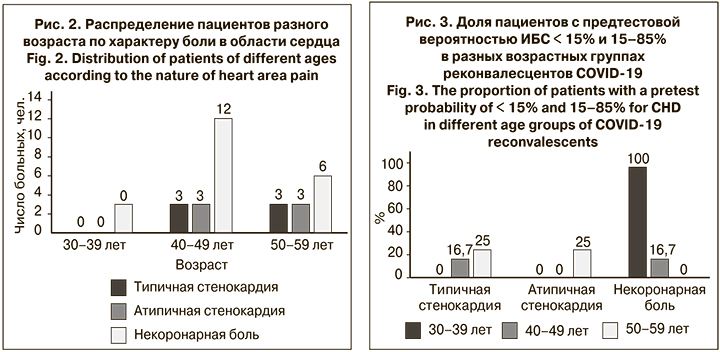
Пациенты с НКИ и типичными стенокардитическими болями в 75% случаев (6 мужчин и 3 женщины) имели ПТВ в пределах 15–85%, а в 25% случаев (3 женщины) – в пределах <15%. Пациенты с болью некоронарного характера в группе с НКИ в 37,5% случаев (9 мужчин) имели ПТВ в пределах 15–85%, а в 62,5% (15 женщин) – в пределах < 15%. Следовательно, всем мужчинам с COVID-19 и болями в области сердца как типичного стенокардитического, так и некоронарного характера необходимо проходить дополнительное обследование.
Обсуждение
Воздействие SARS-CoV‑2 на состояние сердца и сердечно-сосудистую систему не является точечным с изолированным поражением кардиомиоцитов [4]. Проведенное нами исследование показало высокую частоту развития миокардиального повреждения уже в начальном периоде заболевания, о чем свидетельствовали достоверное повышение Тr I, ЭКГ-признаки ишемии в сочетании с сердечной недостаточностью, проявлявшейся Эхо-КГ-признаками перегрузки правого и левого предсердия, возрастанием конечного систолического объема левого желудочка, а также повышением уровня NTproBNP в остром периоде заболевания. Аналогичные данные были получены в других исследованиях, однако кардиологический анамнез пациентов не учитывался [10–13]. В нашей работе все больные до заболевания COVID-19 не имели установленных диагнозов аритмии/ИБС.
Рассматривая патогенетические механизмы поражения сердца, нами была выявлена корреляция активности провоспалительного иммунного ответа (повышение уровня ИЛ-17 и хемокина MIP-1β) с уровнями маркера миокардиального повреждения – Tr I и миокардиальной дисфункции – NTproBNP, что дополняет ранее описанные механизмы поражения сердца при COVID- 19 [7, 9, 13]. Одновременно именно в когорте больных, у которых развилось поражение сердца в остром периоде COVID-19, выявлен дефицит продукции ИФН-α, вероятно, обуславливающий возможность более выраженной вирусной инвазии кардиомиоцитов c последующими некрозом и развитием сердечной недостаточности и аритмии, в конечном итоге повышающими риск кардиальных катастроф (инфаркт, острая сердечная недостаточность).
Последующее повышение Тr I подтверждает факт пролонгации некроза кардиомиоцитов по причине прямого воздействия вируса на сердце, тем самым усугубляя клиническую ситуацию. Следовательно, Тr I и NTproBNP могут выступать маркерами повреждения миокарда в острый период, а Тr I – в период ранней реконвалесценции, что, в свою очередь, позволит оценить эффективность проводимой кардиотропной терапии.
Заключение
На основании комплексного анализа клинических жалоб, биохимических и иммунологических показателей, данных ЭКГ и Эхо-КГ при COVID-19 среднетяжелого течения диагностировано развитие острого миокардиального повреждения у 43,8% больных, стенокардии напряжения – у 11,2%, аритмии – у 27%, сердечной недостаточности – у 14,7%. У 38,3% пациентов, перенесших COVID-19, выявлена впервые дебютировавшая патология сердца, в том числе у 5,4% – в остром периоде, а у 35,1% – к концу 2-й недели госпитализации. Спустя 3 мес. после выздоровления 20% больных жаловались на боли в области сердца, что с учетом их характера и возраста пациентов соответствует умеренному риску развития ИБС. В периоде реконвалесценции 58,3% больных, имеющих указанные жалобы, а также повышение уровней ИЛ-17 и хемокина MIP-1β в остром периоде заболевания, требуют проведения КТ и коронарографии для своевременной оценки риска внезапного возникновения острого миокардиального повреждения.



