1 Academician V.I. Shumakov Federal Research Center of Transplantology and Artificial Organs, Ministry of Health of Russia, Moscow, Russia;
2 G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia
Objective. To investigate the antimycotic activity of the probiotic strain Bacillus subtilis 534 in the in vitro cultivation conditions.
Materials and methods. The taxonomic identification of the isolated pathogenic fungi and their antimycotic sensitivity/resistance determined on an automated MicroScan WalkAway-96 plus System. The strain B. subtilis 534 was grown under submerged cultivation conditions. The antimycotic activity of the culture liquid was determined by the agar diffusion assay. Thirty-six clinical isolates of the pathogenic fungi Candida albicans, C. catenulata, C. glabrata, C. krusei, C. lusitaniae, C. parapsilosis, С. tropicalis, Cryptococcus neoformans, and Trichosporon spp. and the algae Prototheca spp. were used as tests for the determination of their antimycotic activity.
Results. The clinical isolates differ in resistance/sensitivity to the antimycotics amphotericin, miconazole, ketoconazole, itraconazole, and fluconazole, whereas 10 isolates are resistant to all five of these drugs. Thirty-four out of the 36 clinical isolates are sensitive to the culture liquid of the strain B. subtilis 534 and to its isolated active components. Presumably, strain 534 in the human intestine also forms antimicrobial compounds that are active against pathogenic fungi, which is responsible for its antimycotic efficacy.
Conclusion. The long-term medical application of the probiotic sporobacterin that is B. subtilis 534 spore suspension suggests that the latter is effective and free of side effects.
probiotic sporobacterin
Bacillus subtilis 534
resistance
antimycotic activity
Открытие и внедрение в медицинскую практику антибиотиков было одним из самых важных достижений медицины ХХ века, однако постепенно ответной реакцией патогенных микроорганизмов стала выработка механизмов устойчивости к применяемым препаратам. В настоящее время распространение патогенных штаммов с множественной устойчивостью к антибиотикам достигло критического уровня, в связи с чем возникла потребность в разработке новых антибиотиков, а также иных антимикробных препаратов, сочетающих эффективность и отсутствие токсичности [1–3]. К их числу относят пробиотики – лекарственные препараты на основе живых микроорганизмов, воздействующие на патогенную микрофлору человека или нормализующие баланс нормальной кишечной микрофлоры.
К микроорганизмам-пробиотикам относят как естественных обитателей кишечника (кишечная палочка, лактобациллы и бифидобактерии), так и транзиторных (самоэлиминирующихся) бактерий. В России и других странах в последние десятилетия активно изучают бацилл в качестве транзиторных пробиотиков, в частности, штаммы вида Bacillus subtilis, чему посвящен ряд обзорных статей [4–8]. Данный вид бактерий широко распространен в природе и попадает в организм человека разными путями: с воздухом, водой, пищевыми продуктами, поэтому некоторые авторы рассматривают его в качестве одного из естественных компонентов микрофлоры кишечника [8, 9].
В России более четверти века применяют препарат споробактерин, основой которого является штамм-пробиотик B. subtilis 534 [10]. Ранее нами было показано, что штамм 534 в условиях культивирования in vitro образует несколько антимикробных веществ, активных в отношении ряда коллекционных тест-штаммов и клинических изолятов бактерий Acinetobacter baumannii, Bacillus spp., Micrococcus luteus, Klebsiella рneumoniae, Staphylococcus aureus (включая MRSA), S. epidermidis, S. haemolyticus, S. hominis, а также грибков Aspergillus niger, Candida spp., Saccharomyces cerevisiae [11–13].
Целью данного исследования было с помощью клинических изолятов патогенных грибов с различной устойчивостью/чувствительностью к противогрибковым антибиотикам (антимикотикам) определить в опытах in vitro антимикотическую активность пробиотического штамма Bacillus subtilis 534.
Материалы и методы
Объектом исследования служил штамм Bacillus subtilis 534 – основа лекарственного препарата «споробактерин жидкий».
Условия культивирования
Глубинное культивирование штамма 534 осуществляли с использованием модифицированной среды № 2 Гаузе следующего состава: глюкоза – 1%, пептон – 0,5%, триптон – 0,3%, NaCl – 0,5%, вода водопроводная (рН 7,2–7,4). В колбы Эрленмейера объемом 750 мл со 150 мл среды вносили суспензию спор штамма 534 в количестве 106/мл, после чего засеянные колбы помещали на роторную качалку со скоростью вращения 220 об/мин при температуре 28 ºС. Антимикотическую активность культуральной жидкости (КЖ) определяли на 2-е, 4-е и 7-е сутки культивирования. Для поверхностного культивирования штамма 534 и клинических изолятов грибов использовали агаризованный вариант модифицированной среды № 2 Гаузе с добавлением 2% агара. Культивирование осуществляли при 37 ºС.
 Определение антимикотической активности
Определение антимикотической активности
Антимикотическую активность КЖ штамма 534 и отдельных выделенных из нее ранее компонентов [12] определяли методом диффузии в агар. Для этого на поверхность агаровой среды с высеянным газоном исследуемого штамма клинического изолята помещали бумажные диски диаметром 6 мм с нанесенными сырцами отдельных компонентов КЖ в количестве 10 мкл или по 100 мкл КЖ штамма 534 закапывали в лунки диаметром 9 мм. Через сутки инкубирования при 37 ºС определяли диаметры зон задержки роста грибков вокруг дисков или лунок, являющиеся показателем антимикотической активности.
Характеристика изолятов патогенных грибков
Видовую идентификацию клинических изолятов грибков и их отношение к антимикотикам проводили на автоматическом бактериологическом анализаторе для идентификации микроорганизмов MicroScan WalkAway-96 рlus System (Siemens, Германия). Определяли чувствительность/устойчивость изолятов патогенных грибков к следующим антимикотикам медицинского назначения: амфотерицину B, миконазолу, кетоконазолу, итраконазолу и флуконазолу.
Результаты
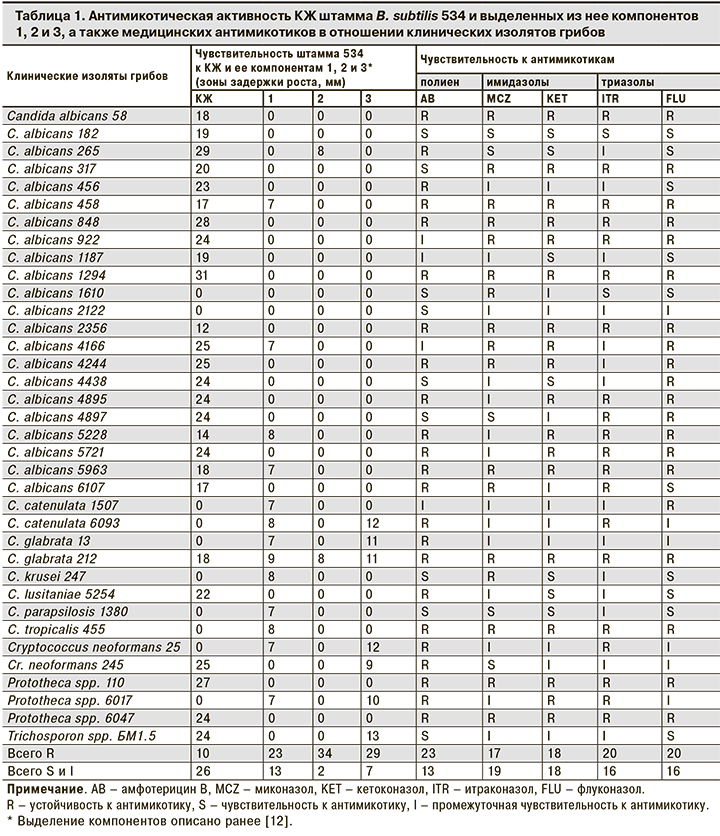
Антимикотическую активность КЖ штамма B. subtilis 534 и выделенных из нее 3 компонентов определяли в отношении 33 штаммов патогенных грибков и 3 штаммов патогенной водоросли Prototheca spр., инфекции которой также лечат противогрибковыми антибиотиками. Из табл. 1 следует, что КЖ штамма 534 подавляет рост 26 штаммов из 36, причем рост 8 штаммов, а именно Candida catenulata 1507 и 6093, C. glabrata 13, C. krusei 247, C. parapsilosis 1380, С. tropicalis 455, Cr. neoformans 25 и Prototheca spp. 6017, подавляется не КЖ, а отдельными выделенными из нее компонентами. Это объясняется тем, что при выделении и очистке сырцов отдельных компонентов КЖ, их упаривании и последующем растворении в небольшом объеме воды концентрация активных веществ возрастает примерно в 500 раз, и с учетом описанных выше различий в методе определения антимикотической активности КЖ и ее компонентов в наносимом на диск образце содержание антимикотиков примерно в 50 раз выше, чем в образце КЖ, внесенном в лунку.
Нами установлено, что 10 из 36 клинических изолятов устойчивы ко всем 5 представителям медицинских антимикотиков 3 исследуемых групп (полиены, имидазолы и триазолы), но рост этих штаммов подавляет КЖ штамма B. subtilis 534 или ее компоненты. Только 2 штамма С. albicans (1610 и 2122) устойчивы и к КЖ, и к сконцентрированным сырцам отдельных компонентов КЖ штамма 534. Поскольку эти 2 штамма чувствительны к исследованным медицинским антимикотикам, можно предположить иную химическую природу антимикотиков штамма B. subtilis 534.
Наряду с такими свойствами, как усиление неспецифического и специфического иммунитета, стимуляция роста нормальной микрофлоры кишечника и выделение пищеварительных ферментов, действие пробиотиков может быть связано с синтезом антибиотических веществ различной химической природы. Пребывание B. subtilis в кишечнике теплокровных животных сохраняется от 10 до 30 суток, причем бактерии присутствуют в форме вегетативных клеток и спор, и до выведения из организма с калом неоднократно повторяется процесс прорастания спор и респоруляции [14, 15]. Можно предположить, что в кишечнике и в питательной среде в колбах процессы развития B. subtilis схожи, и возможно выделение антибиотических веществ in vivo, что можно рассматривать как один из механизмов действия споробактерина.
Методом дисков нами была определена чувствительность/устойчивость штамма B. subtilis 534 к применяемым в медицине антибиотикам. Штамм B. subtilis 534 устойчив к линкомицину и оксациллину, поэтому возможно назначение споробактерина одновременно с ними. Рост штамма B. subtilis 534 подавляют антибиотики: амикацин, амоксициллин/клавулановая кислота, ампициллин, ампициллин/сульбактам, азитромицин, ванкомицин, доксициклин, клиндамицин, левомицетин, фосфомицин, гентамицин, канамицин, левофлоксацин, метронидазол, налидиксовая кислота, неомицин, новобиоцин, норфлоксацин, окситетрациклин, офлоксацин, пенициллин, спектиномицин, тетрациклин, тобрамицин, триметоприм, цефазолин, цефалотин, цефотаксим, цефотаксим/клавулановая кислота, цефтриаксон, ципрофлоксацин, эритромицин, поэтому целесообразно применять их для профилактики кишечных инфекций или за несколько суток до начала курса антибиотикотерапии.
Заключение
Штамм B. subtilis 534 при росте на питательной среде in vitro образует антимикробные соединения, в том числе эффективные в отношении патогенных грибков разных видов, устойчивых к современным антимикотикам. Предположительно в кишечнике человека он также образует антимикробные соединения, активные в отношении патогенных грибков, что обусловливает его лекарственную антимикотическую эффективность. Длительное эффективное применение в медицинской практике препарата споробактерин, представляющего суспензию спор штамма B. subtilis 534, свидетельствует об отсутствии побочных эффектов.
- World Health Organization. Antimicrobial resistance. 2016. URL: http://www.who.int/mediacentre/factsheets/fs194/en/
- Butler M.S., Blaskovich M.A., Cooper M.A. Antibiotics in the clinical pipeline in 2013. J.Antibiot. 2013; 66(10): 571–91.
- Butler M.S., Blaskovich M.A., Cooper M.A. Antibiotics in the clinical pipeline at the end of 2015. J. Antibiot. 2017; 70(1): 3–24.
- Pohilenko V.D., Perelygin V.V. [Probiotics based on spore-forming bacteria and their safety]. Himicheskaya i biologicheskaya bezopasnost’ 2007; 32–33(2–3): 20–41. (In Russ.).
- Skrypnik I.N., Maslova A.S. [Modern spore-forming probiotics in clinical practice]. Suchasna gastroenterologiya 2009; 3(47): 81–90. (In Russ.).
- Savust’yanenko A.V. [Mechanisms of action of probiotics based on Bacillus subtilis]. Aktual’naya infektologiya 2016; 2(11): 35–44. (In Russ.).
- Sanders M.E., Morelli L., Tompkins T.A. Sporeformers as Human Probiotics: Bacillus, Sporolactobacillus, and Brevibacillus. Comprehensive reviews in food science and food safety 2003; 2(3): 101–10. DOI: 10.1111/j.1541-4337.2003.tb00017.x
- Cutting S.M. Bacillus probiotics. Food Microbiol. 2011; 28: 214e220. DOI:10.1016/j.fm.2010.03.007.
- Sorokulova I. Modern Status and Perspectives of Bacillus Bacteria as Probiotics J. Prob. Health. 2013; 1(4): e106.
- Nikitenko V.I., Polyakova B.C., Nikitenko M.V. [The drug is sporobacterin. New data on the mechanism of action of this and other living bacterial preparations]. Nauchnyj vestnik Tyumenskoj medicinskoj akademii 2001; (2): 70–2. (In Russ.).
- Gabriehlyan N.I., Davydov D.S., Gorskaya E.M. [Use of sporobacterin in the postoperative period in patients of the cardiosurgical profile. Antagonism in vitro of sporobacterin against nosocomial strains of bacteria]. Vestnik transplantologii i iskusstvennykh organov 2008; (6): 12–8. (In Russ.).
- Gabriehlyan N.I., Gorskaya E.M., Krupenio T.V., Zenkova V.A., Efimenko T.A., Malanicheva I.A., Sumarukova I.G., Efremenkova O.V., Evlashkina V.F., Davydov D.S. [Evaluation of the antimicrobial activity of the bacillary probiotic Bacillus subtilis (strain 534). Èpidemiologiâ i infekcionnye bolezni. Аktual’nye voprosy 2016; (1): 41–7. (In Russ.).
- Efremenkova O.V., Gabriehlyan N.I., Malanicheva I.A., Efimenko T.A., Terekhova L.P., Udalova V.V., Gluhova A.A., Rogozhin E.A., Alferova V.A., Korshun V.A., Kubanova M.H., Drabkina I.V., Krupenio T.V. [Antibiotic activity of the probiotic strain Bacillus subtilis 534 for clinical isolates of Acinetobacter baumannii. Antibiotiki i himioterapiya 2016; 61(9–10): 3–7. (In Russ.).
- Osipova I.G., Sorokulova I.B., Vasil’eva E.A., Budanova E.V. [Preclinical trials of new spore probiotics]. Vestnik Rossiyskoy Akademii meditsinskikh nauk 2005; (12): 36–40. (In Russ.).
- Leser T.D., Knarreborg A., Worm J. Germination and outgrowth of Bacillus subtilis and Bacillus licheniformis spores in the gastrointestinal tract of pigs. J. Appl. Microbiol. 2008; 104(4): 1025–33.
For citations: Габриэлян Н.И., Драбкина И.В., Крупенио Т.В., Демьянкова М.В., Маланичева И.А., Васильева Б.Ф., Ефименко Т.А., Сумарукова И.Г., Глухова А.А., Бойкова Ю.В., Малкина Н.Д., Удалова В.В., Алферова В.А., Коршун В.А., Ефременкова О.В. Антимикотическая активность штамма Bacillus subtilis 534 – основы пробиотика споробактерина. Èpidemiologiâ i infekcionnye bolezni. Аktual’nye voprosy 2018; (3):51–6
For correspondence:
Olga V. Efremenkova, Cand. Biol. Sci., Head, Sector for Searching for Natural Compounds that Overcome Bacterial Resistance, Department of Microbiology, G.F. Gauze Research Institute for Search for New Antibiotics
Address: 11, Bolshaya Pirogovskaya St., Build. 1, Moscow119021, Russia
Telephone: +7(499) 255-77-31
E-mail:
ovefr@yandex.ru
ORCID: http://orcid.org/0000-0003-3131-1031
Information about the authors:
Nina I. Gabrielyan, MD, Head, Department of Endotoxicosis and Pyoseptic Complications, Academician V.I. Shumakov Federal Research Center of Transplantology and Artificial Organs, Ministry of Health of Russia, Moscow, Russia; е-mail:
labgso@mail.ru; ORCID: http://orcid.org/0000-0003-1941-8311
Irina V. Drabkina, Bacteriologist, Academician V.I. Shumakov Federal Research Center of Transplantology and Artificial Organs, Ministry of Health of Russia, Moscow, Russia; е-mail:
drabkina58@mail.ru; ORCID: http://orcid.org/0000-0002-9528-3490
Tatiana V. Кrupenio, Laboratory Researcher, Academician V.I. Shumakov Federal Research Center of Transplantology and Artificial Organs, Ministry of Health of Russia, Moscow, Russia; e-mail:
ypsa89@mail.ru laboratorian; ORCID http://orcid.org/0000-0002-7903-534X
Maria V. Demyankova, Laboratory Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
mary_bunny@mail.ru; ORCID: http://orcid.org/0000-0003-0085-1668
Irina A. Malanicheva, Cand. Biol. Sci., Senior Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
malanicheva.irina@yandex.ru; ORCID: http://orcid.org/0000-0002-7623-6146
Byazilya F. Vasilyeva, Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; е-mail:
bfvas@yandex.ru; ORCID: http://orcid.org/0000-0001-9077-1965
Tatiana A. Еfimenko, Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
efimen@inbox.ru; ORCID: http://orcid.org/0000-0001-9632-6854
Irina G. Sumarukova, Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
noks59@yandex.ru; ORCID: http://orcid.org/0000-0001-7750-7983
Alla A. Glukhova, Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
alglukhova@yandex.ru; ORCID: http://orcid.org/0000-0003-0561-4709
Yulia V. Boykova, Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
boykowa.yulya@yandex.ru; ORCID: http://orcid.org/0000-0002-1128-7460
Natalia D. Malkina, Cand. Biol. Sci., Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
utvar@blagoslovenie.su; ORCID: http://orcid.org/0000-0002-8566-0010
Viktoria V. Udalova, Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
viudalova@yandex.ru; ORCID: http://orcid.org/0000-0002-0392-8379
Vera A. Alferova, Researcher, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
alferovava@gmail.com; ORCID: http://orcid.org/0000-0002-8961-5890
Vladimir A. Korshun, ChemD, Head, Laboratory Chemical Study of Biologically Active Compounds of Microbial Origin, G.F. Gauze Research Institute for Search for New Antibiotics, Moscow, Russia; e-mail:
v-korshun@yandex.ru; ORCID: http://orcid.org/0000-0001-9436-6561

 Определение антимикотической активности
Определение антимикотической активности


