По мнению ряда авторов, бремя герпесвирусных инфекций (ГВИ)_на настоящий момент является недостаточно оцененным [1, 2]. Известны 9 представителей этого семейства, вызывающих заболевание у человека: вирусы простого герпеса 1-го и 2-го типов (ВПГ-1 и ВПГ-2), Varicella-Zoster virus (VZV), вирус Эпштейна–Барр (ВЭБ), цитомегаловирус (ЦМВ), вирусы герпеса человека 6-го (ВГЧ-6А и ВГЧ-6В), 7-го и 8-го типов (ВГЧ-7 и ВГЧ-8) [3, 4]. Однако методы рутинной лабораторной диагностики разработаны и внедрены в практику только для ВПГ-1, ВПГ-2, VZV, ВЭБ, ЦМВ, ВГЧ-6 без подразделения на ВГЧ-6А и -6В [5]. В ряде стран мира, в том числе в Российской Федерации, официальной регистрации подлежат только случаи ветряной оспы (опоясывающего лишая), инфекционного мононуклеоза и цитомегаловирусной инфекции (ЦМВИ) [6].
В то же время широкая повсеместная распространенность и хронический характер течения ГВИ определяют возможность развития сочетанной патологии практически с любым патогеном [7–12]. В литературе описаны клинические проявления простого герпеса и инфекции, вызванной VZV, на фоне гриппа [13, 14], кори [15, 16], ВИЧ-инфекции [17] и др. Как правило, сочетанные инфекции имеют более тяжелое клиническое течение.
Пандемия новой коронавирусной инфекции COVID-19 способствовала переоценке роли ГВИ. Особое внимание исследователей привлекли случаи развития опоясывающего лишая (VZV) на фоне инфекции, вызванной SARS-CoV-2. Высказано предположение, что реактивация латентной VZV-инфекции, вызвана воспалительной реакцией при COVID-19 в носоглотке [18]. Установлено, что перед появлением клинических признаков опоясывающего лишая у пациентов, инфицированных SARS-CoV-2, происходит снижение количества CD3+- и CD8+-лимфоцитов. В среднем высыпания, характерные для VZV, появлялись на 4–7-й день от момента госпитализации в стационар больных с коронавирусной инфекцией на фоне приема гидроксихлорохина и не имели связи с проведением искусственной вентиляции легких [19]. В другом исследовании показано, что клинические проявления опоясывающего лишая имеют место даже после перенесенной субклинической SARS-CoV-2-инфекции [20].
В то же время довольно незначительное число публикаций посвящено вопросу микст-инфицирования SARS-CoV-2 с ВПГ-1, ВПГ-2, ВЭБ, ЦМВ и ВГЧ-6 [21 31]. Описанные единичные клинические случаи не позволяют установить частоту развития активной ГВИ на фоне COVID-19. В этой связи особый интерес представляет изучение эпидемиологических особенностей ГВИ на раннем этапе развития пандемии COVID-19 (весна 2020 г.) путем проведения исследования, которое позволит ответить на вопрос: являются ли пациенты с COVID-19 группой риска развития активной инфекции, вызванной вирусами герпеса?
Целью исследования явилось изучение особенностей развития эпидемического процесса инфекций, вызванных ВПГ-1, ВПГ-2, ВЭБ, ЦМВ и ВГЧ-6 на фоне развития пандемии COVID-19.
Для этой цели предполагалось:
1. Проанализировать внутригодовую динамику заболеваемости населения Москвы COVID-19 в 2020 г. и регистрируемыми нозологическими формами ГВИ (инфекционный мононуклеоз и ЦМВИ) в 2019 и 2020 гг.
2. Сопоставить частоту выявления серологических маркеров инфицирования вирусами герпеса (ВПГ-1, ВПГ-2, ВЭБ, ЦМВ, ВГЧ-6) в группах больных COVID-19 и условно здоровых лиц.
Материалы и методы
Проведен ретроспективный анализ заболеваемости населения Москвы COVID-19 и регистрируемыми нозологическими формами ГВИ (инфекционный мононуклеоз и ЦМВИ). Материалами послужили данные формы № 2 Росстата «Сведения об инфекционных и паразитарных заболеваниях» за 2019 и 2020 гг. Информация о числе заболевших COVID-19 за 2020 г. получена из общедоступного интернет-ресурса «Стопкоронавирус.рф»
Весной 2020 г. (март–май) на наличие серологических маркеров инфицирования вирусами герпеса (ВПГ-1, ВПГ-2; ВЭБ; ЦМВ; ВГЧ6) в крови было обследовано 92 условно здоровых человека (доноры крови и ее компонентов, далее – доноры) и 95 пациентов с COVID-19 без дыхательной недостаточности с впервые в жизни установленным диагнозом. У 30 пациентов заболевание протекало в виде острого назофарингита, у 65– интерстициальной пневмонии, не требующей проведения искусственной вентиляции легких. Все пациенты находились на лечении в инфекционном стационаре для больных COVID-19.
Из 95 обследованных РНК SARS-CoV-2 в мазках из носоглотки была выявлена только у 59 чел. (62,1%; 95% ДИ 57,1–67,1). Антитела к SARS-CoV-2 (IgM, IgG или их сочетание) на 10–21-й день от начала клинических проявлений COVID-19 выявлены у 86 пациентов (90,5%; 95% ДИ 84,6–96,4). У 36 чел. с отрицательными результатами исследования мазка из носоглотки на выявлены Ig к SARS-CoV-2, в том числе только IgM – у 4 пациентов, IgG – у 8, сочетание IgM и IgG – у 24. У 8 пациентов с выявленными IgG данные о заболевании COVID-19 до настоящей госпитализации в анамнезе отсутствовали. Таким образом, у всех пациентов инфекция COVID-19 подтверждена лабораторно.
Группы доноров и пациентов были сопоставимы по полу и возрасту. В группе доноров женщины составили 33,7% (95% ДИ 23,79–43,61), мужчин – 66,3% (95% ДИ 56,39–76,21); в группе пациентов –16,8% (95% ДИ 9,2–24,4) и 83,2% (95% ДИ 75,6–90,8) соответственно. Средний возраст обследованных доноров – 41,0 год (95% ДИ 38,8–43,2), пациентов – 42,4 года (95% ДИ 33,6–51,2).
Критерии включения в исследование:
- возраст от 18 до 65 лет (мужчины и женщины);
- постоянное (на протяжении 10 и более лет) проживание на территории Москвы или Московской области;
- отсутствие алкогольной и/или наркотической зависимости;
- отсутствие психических расстройств, требующих лечения антидепрессантами;
- отсутствие идентифицированных маркеров ВИЧ, гепатитов В и С;
- отсутствие иной инфекционной и соматической патологии, сопровождающейся иммунодефицитом, или приема лекарственных препаратов, относящихся к группе иммунодепрессантов;
- наличие информированного согласия на проведение лабораторно-инструментального обследования.
В исследование не были включены:
- доноры, не допущенные по медицинским показаниям к сдаче крови и ее компонентов;
- доноры, имеющие в анамнезе COVID-19 или антитела к SARS-CoV-2;
- пациенты, ранее перенесшие COVID-19, у которых госпитализация по поводу данной инфекции является повторной;
- пациенты, у которых наличие COVID-19 не подтверждено выделением РНК SARS-CoV-2 методом ОТ-ПЦР РВ в мазке из носоглотки или обнаружением антител (IgM и/или IgG) методом ИФА;
- пациенты с тяжелым клиническим течением COVID-19, требующие проведения искусственной вентиляции легких.
Из исследования также исключали лиц, сыворотки крови от которых имели признаки гемолиза.
Забор крови для исследования у доноров проводили непосредственно перед донацией. У пациентов с COVID-19 взятие мазка из носоглотки проводили в день первичного обращения за медицинской помощью, забор крови – на 10–21-й день от начала клинических проявлений.
Исследования на наличие IgM и IgG к ВПГ-1 и ВПГ- 2, ВЭБ (IgM VCA, IgG VCA, IgG EA, IgG EBNA), ЦМВ, SARS-CoV-2; IgG – к ВГЧ-6, определение авидности IgG ВПГ-1, ВПГ-2, а также ЦМВ и ВЭБ (IgG VCA) проводили методом ИФА с использованием наборов реагентов производства АО «Вектор-Бест» (Новосибирск, Россия). IgM к ВГЧ-6 определяли в непрямой реакции иммунофлюоресценции с помощью набора реагентов Euroimmun AG (Германия). Результаты оценивали в соответствии с критериями, изложенными в инструкциях.
Для статистической обработки результатов использовали таблицы Microsoft Excel, 2019. Рассчитывали показатели заболеваемости на 100 тыс. населения, частоты выявления серологических маркеров в % и их доверительные интервалы. Различия считались достоверными при доверительной вероятности 95% и доверительной значимости (p) < 0,05. Для изучения синхронности внутригодовой динамики заболеваемости инфекционным мононуклеозом, ЦМВИ и COVID- 19 использовали коэффициент линейной корреляции Пирсона (r). При положительном значении r связь расценивалась как прямая, при отрицательном – как обратная. Модуль r указывал на силу связи: от 0 до 0,29 – слабая, от 0,3 до 0,69 – средняя, от 0,7 до 1 – сильная. Для оценки достоверности показателя r рассчитывали его ошибку (mr) и коэффициент Стьюдента (t). Различия считались достоверными при доверительной вероятности 95% и p < 0,05.
Результаты
Первые случаи COVID-19 в Москве были зарегистрированы в марте 2020 г. Последующий рост числа заболевших в апреле и мае происходил на фоне интенсивного снижения заболеваемости инфекционным мононуклеозом и менее выраженного – ЦМВИ (см. рисунок). С июля по декабрь в динамике заболеваемости COVID-19 и инфекционным мононуклеозом зарегистрирована синхронная тенденция к росту (r = 0,9, mr = 0,05, t = 18; p < 0,05 – связь достоверная сильная прямая). Между показателями заболеваемости ЦМВИ и COVID-19 за аналогичный период установлена прямая корреляционная связь средней силы (r = 0,6, mr = 0,18, t = 3,3; p < 0,05 – связь достоверная прямая средней силы).
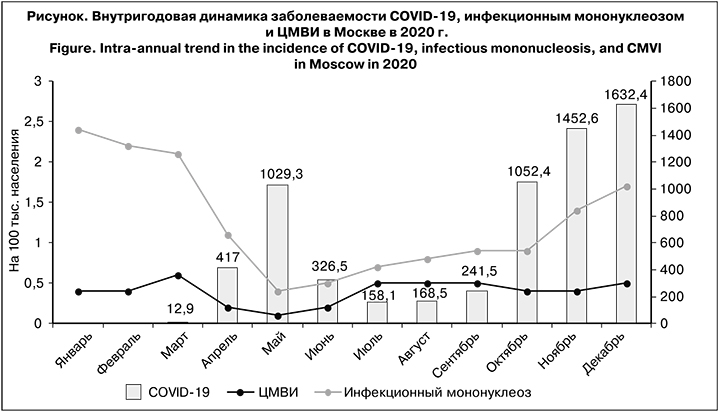
При сравнении заболеваемости инфекционным мононуклеозом и ЦМВИ в 2020 и 2019 гг. установлено.что в 2019 г. показатели заболеваемости ЦМВИ (6,3 на 100 тыс. населения; 95% ДИ 6,1–6,5) и инфекционным мононуклеозом (24,7 на 100 тыс.; 95% ДИ 23,5–25,9) были достоверно выше, чем в 2020 г. – 4,7 (95% ДИ 4,5–4,9) и 15,1 (95% ДИ 14,4–15,8) на 100 тыс. соответственно (р < 0,05).
 Внутригодовая динамика заболеваемости инфекционным мононуклеозом характеризовалась сезонным подъемом в холодный период года и относительным эпидемическим благополучием в летние месяцы, которое в 2019 г. продолжалось с мая по август, а в 2020 г. после минимального показателя в мае (0,4 на 100 тыс. населения) сразу же был отмечен рост. Изменение заболеваемости ЦМВИ по месяцам в 2020 г. существенно не отличалось от такового в 2019 г. Как в 2019, так и в 2020 гг. выраженный сезонный подъем показателей не выявлен.
Внутригодовая динамика заболеваемости инфекционным мононуклеозом характеризовалась сезонным подъемом в холодный период года и относительным эпидемическим благополучием в летние месяцы, которое в 2019 г. продолжалось с мая по август, а в 2020 г. после минимального показателя в мае (0,4 на 100 тыс. населения) сразу же был отмечен рост. Изменение заболеваемости ЦМВИ по месяцам в 2020 г. существенно не отличалось от такового в 2019 г. Как в 2019, так и в 2020 гг. выраженный сезонный подъем показателей не выявлен.
Исследование частоты выявления серологических маркеров инфицирования ВПГ-1, ВПГ-2, ВЭБ, ЦМВ и ВГЧ-6 проведено на фоне роста заболеваемости COVID-19 (первая волна) и снижения – регистрируемыми нозологическими формами ГВИ.
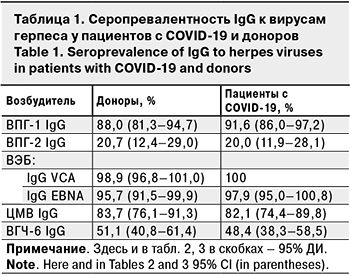
Оценка серопревалентности IgG к ВПГ-1, ВПГ-2, ВЭБ, ЦМВ и ВГЧ-6 не выявила достоверных различий между группами пациентов и доноров (табл. 1).
Дополнительное определение индекса авидности IgG к ВПГ-1, ВПГ-2, ВЭБ и ЦМВ также не позволило выявить значимых различий между группами (табл. 2). Расчет удельного веса низкоавидных IgG на 100 обследованных дает представление о частоте выявления первичной острой инфекции во взрослой популяции.

Частота выявления серологических маркеров активной ГВИ – IgM к ВПГ-1, ВПГ-2, ЦМВ и ВГЧ-6 – в исследуемых группах была сопоставима (табл. 3). Исключение составили маркеры активной ВЭБ-инфекции – IgM к капсидному (IgM VCA) и IgG к раннему (IgG EA) антигенам, которые достоверно чаще выявляли в группе пациентов (p < 0,05).
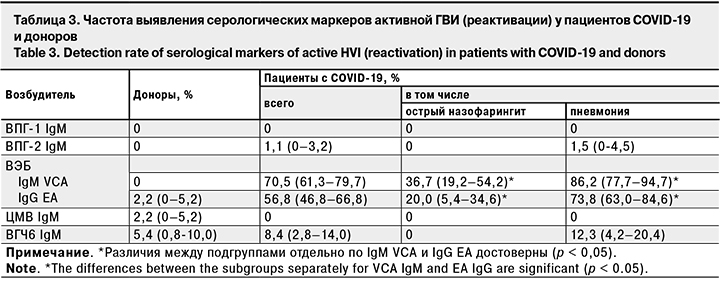
Анализ результатов обследования на маркеры активной инфекции пациентов с острым назофарингитом и интерстициальной пневмонией без дыхательной недостаточности выявил достоверное превышение частоты выявления IgM VCA и IgG EA к ВЭБ и IgM к ВГЧ-6 у последних (p < 0,05).
Обсуждение
Первая волна эпидемического процесса COVID-19 весной 2020 г. совпала с сезонным снижением заболеваемости инфекционным мононуклеозом и, по всей видимости, спровоцировала в дальнейшем ее более ранний и продолжительный подъем с июня по декабрь включительно, по сравнению с 2019 г. (с сентября по ноябрь). По результатам другого исследования для инфекционного мононуклеоза в Москве в 2014–2018 гг. установлены сезонные колебания показателей с периодом относительного эпидемического благополучия в июне–августе [32]. Таким образом, именно 2020 г. характеризуется выраженными изменениями внутригодовой динамики заболеваемости инфекционным мононуклеозом. Схожих тенденций в заболеваемости ЦМВИ не выявлено.
Выдвинутая гипотеза о влияния COVID-19 на эпидемический процесс инфекционного мононуклеоза, этиологическим агентом которого в 90% случаев является ВЭБ, подтверждается не только наличием сильной прямой корреляционной связи между изменениями показателей заболеваемости этими нозологиями, но и результатами проведенных серологических исследований.
Было показано, что на фоне сопоставимых показателей серопревалентности к ВПГ-1, ВПГ-2, ВЭБ, ЦМВ и ВГЧ-6, частоты выявления низкоавидных IgG к ним, а также маркеров, указывающих на реактивацию этих возбудителей в группах доноров и пациентов с COVID- 19, основным отличием стал показатель выявления маркеров реактивации ВЭБ-инфекции (IgM VCA и IgG EA на фоне присутствия IgG VCA и IgG EBNA), который у пациентов был достоверно выше.
Вероятной причиной реактивации ВЭБ-инфекции может быть описанное в литературе изменение иммунологической реактивности организма человека под действием COVID-19, проявляющееся дисбалансом CD4+ и CD8+ T-клеток [12, 33]. С другой стороны, ранее было показано, что реактивация ВЭБ в культуре клеток происходит без участия иммунной системы хозяина под влиянием внешних негативных факторов [34]. В этой связи не исключено, что SARS-CoV-2 может оказывать непосредственное воздействие на клетки, латентно инфицированные вирусами герпеса, вступая с ними в конкурентные отношения и, тем самым, вызывая реактивацию. В каждом из 2 предполагаемых сценариев SARS-CoV-2 создает благоприятные условия к переходу вирусов герпеса из латентного состояния к репродукции.
Установленная в настоящем исследовании частота выявления низкоавидных IgG -маркеров первичной инфекции, вызванной ВПГ-1, ВПГ-2, ВЭБ и ЦМВ у пациентов с COVID-19 (8,4, 6,3 и 1,1 на 100 обследованных соответственно) и доноров (6,5, 2,2, 0) согласуется с данными других исследований, в ходе которых показано, что у взрослого населения низкоавидные IgG к ВПГ-1 и ВПГ-2 обнаруживают в 0,7–5,1% случаев [35– 37], ВЭБ – в 3,6–4,2% [9], ЦМВ – в 2,0% [36].
Не было выявлено особенностей и в уровнях серопревалентности к ВПГ-1, ВПГ-2, ВЭБ, ЦМВ и ВГЧ-6 у пациентов с COVID-19 (91,6, 20,0, 100, 82,1 и 48,4% соответственно), которые не имели достоверных отличий от таковых у доноров (88,0, 20,7, 98,9, 83,7 и 51,1%). Для сравнения: серопревалентность к ВПГ-1, ВПГ- 2, ВЭБ, ЦМВ и ВГЧ-6 среди разных групп взрослого населения, по данным других исследований, составляет 59,3–82,4% [38, 39], 21,1–51,8% [38, 39], 72–99,5% [40, 41], 51–100% [42, 43], 51–90% [11, 44] соответственно.
Это свидетельствует в пользу отсутствия влияния особенностей предшествующего развития эпидемического процесса ВЭБ-инфекции на заболеваемость COVID-19 и еще раз подтверждает триггерную роль SARS-CoV-2 в реактивации этой ГВИ.
В литературе описаны единичные случаи реактивации ВЭБ на фоне COVID-19 [31, 45]. При этом наибольший интерес представляет исследование, в ходе которого ДНК ВЭБ в крови была выявлена у 95,2% пациентов с тяжелым течением COVID-19, находящихся на искусственной вентиляции легких, и у 83,6% пациентов без ИВЛ. Важно отметить, что генетический материал других герпесвирусов (ЦМВ и ВГЧ-6) обнаружен не был [46, 47]. Исследование на наличие серологических маркеров ГВИ в группах пациентов с COVID-19 и здоровых лиц на репрезентативной выборке, позволяющее дифференцировать первичную острую инфекцию и реактивацию, ранее не проводилось и было выполнено нами впервые.
Анализ публикаций показывает, что интерес ученых был прикован к пациентам с тяжелыми формами COVID-19, частота выявления активной ГВИ у больных с легким и среднетяжелым течением без дыхательной недостаточности ранее не оценивалась. Тем не менее, проведенное нами сопоставление показателей в подгруппах пациентов с легким и среднетяжелым течениемCOVID-19, впервые позволило установить зависимость частоты выявления IgM VCA и IgG EA к ВЭБ и IgM к ВГЧ-6 от тяжести заболевания.
Таким образом, в настоящем исследовании представлены убедительные доказательства роли SARS-CoV-2 в реактивации ВЭБ на 10–21-е сутки от момента обращения пациентов за медицинской помощью, что дает основание для дальнейшего углубленного изучения этой проблемы.
Выводы
1. Выявлены особенности эпидемического процесса ГВИ в Москве на фоне развития пандемии COVID-19 весной 2020 г.:
- высокая распространенность серопозитивности к инфекциям, вызванным ВПГ-1, ВПГ-2, ВЭБ, ЦМВ и ВГЧ-6, как среди пациентов с COVID-19, так и среди здоровых лиц (88–91,6, 20–20,7, 98,9–100, 82,1–83,7 и 48,4–51,1% соответственно);
- равнозначная частота выявления маркеров первичной острой инфекции, вызванной ВПГ-2 и ВПГ-2 (6,5–8,4%), ВЭБ (2,2–6,3%), ЦМВ (0–1,1%) и реактивации ВПГ-1, ВПГ-2, ЦМВ и ВГЧ-6 (0, 0–1,1, 0–2,2 и 5,4–8,4% соответственно) в группах доноров и пациентов с COVID-19 (p > 0,05);
- более ранний и продолжительный подъем во внутригодовой динамике заболеваемости инфекционным мононуклеозом с июня по декабрь включительно по сравнению с 2019 г;
- достоверно более высокая частота реактивации ВЭБ-инфекции (наличие IgM VCA и IgG EA на фоне IgG VCA и IgG EBNA) в группе пациентов с COVID-19 по сравнению с донорами (70,5 и 56,8% против 0 и 2,2% соответственно; p < 0,05).
2. Согласно полученным данным, SARS-CoV-2 можно рассматривать как триггерный фактор, запускающий в организме человека механизм перехода ВЭБ от фазы латенции к литической репродукции, а пациентов COVID-19 – как группу риска по реактивации хронической ВЭБ-инфекции.



