Себорейный дерматит (СД) – хроническое рецидивирующее заболевание кожи, связанное с повышенной секрецией кожного сала и изменением его качественного состава, он является одним из самых распространенных дерматозов в мире [1]. N. Zander и соавт. при обследовании более 160 000 человек отметили встречаемость СД у 3,2% респондентов, при этом фиксировалось частое сочетание СД с другими поражениями кожи [2]. У взрослых эта патология кожи является хроническим часто рецидивирующим заболеванием и проявляется очагами покраснения, шелушащимися пятнами, наличием жирных или сухих чешуек на коже в областях с повышенным количеством сальных желез. Кожа лица у больных СД поражается в 90% случаев, кожа волосистой часть головы – в 70%, верхняя часть туловища – в 27%. У 1,5–2% больных отмечается поражение кожи конечностей [3–5].
У ВИЧ-инфицированных больных поражение кожных покровов и слизистых оболочек встречается примерно в 90% случаев, при этом СД встречается значительно чаще, чем другие дерматозы, и связано это с вовлечением ВИЧ в ведущие дермальные иммунные реакции. В связи с ростом продолжительности жизни ВИЧ-инфицированных больных при использования антиретровирусной терапии (АРТ), на первый план у этих пациентов выходит лечение сопутствующей патологии, а заболевания кожи являются самыми распространенными.
Важным звеном в оценке проявлений различных дерматозов у ВИЧ-инфицированных больных является их «стандартизация», которая позволит использовать «связывающие симптомы» для оценки тяжести течения ВИЧ-инфекции и назначать адекватную терапию [6–8]. Для понимания особенностей течения кожных заболеваний, оценки их влияния на состояние больных и рекомендаций по лечению в научной среде используется большое количество как общих, так и частных дерматологических индексов. Так, частный индекс тяжести периорального дерматита (ИТПОД), основанный на наличии и интенсивности проявления 3 симптомов – эритемы, папул и шелушения кожи – был предложен в 2006 г. A. Wollenberg и T. Oppel и используется для клинической оценки течения дерматоза у больных СД [9, 10].
Особый интерес представляет изучение течения у пациентов с ВИЧ-инфекцией СД, который встречается в 30–70% случаев, может регрессировать, появляться вновь, сочетаться с другими кожными заболеваниями, принимать упорное рецидивирующее течение. Многие исследователи указывают на клинические и морфологические особенности проявлений СД и его связь с уровнем CD4+-лимфоцитов, а также на более тяжелое его течение, чем у больных без ВИЧ-инфекции [11–13]. Данных же о взаимосвязи течения СД со стадией ВИЧ-инфекции и уровнем вирусной нагрузки (ВН) у ВИЧ-инфицированных больных нет.
Цель исследования – выявление клинических особенностей течения СД у ВИЧ-инфицированных больных в зависимости от стадии ВИЧ-инфекции, иммунного статуса и ВН.
Материалы и методы
За период с 2015 по 2018 г. под нашим наблюдением находился 401 больной СД, среди которых было 198 ВИЧ-инфицированных (основная группа) и 203 ВИЧ-негативных пациента (группа сравнения). В основной группе было 110 (55,5%) мужчин и 88 (44,5%) женщин, в группе сравнения – 114 (56,2%) мужчин и 89 (43,8%) женщин. Возраст больных варьировал от 21 года до 45 лет (в среднем – 29,7 года).
Длительность СД в обеих группах составляла от 6 мес. до 12 лет. У всех больных основной группы СД диагностировали до подтверждения наличия ВИЧ-инфекции. Средняя частота обострений СД в основной группе составила 3,7 раза за год, в группе сравнения – 1,8 раза.
Больные СД с ВИЧ-инфекцией наблюдались на базе Инфекционной клинической больницы № 2 Департамента здравоохранения города Москвы, ВИЧ-негативные пациенты с СД – на базе филиала «Мединцентр» ГлавУпДК при МИД России (Москва).
Все пациенты были жителями Москвы и Московской области, наблюдались на протяжении года после постановки на учет. Контрольные осмотры проводили каждые 6 мес. Для определения интенсивности клинических проявлений СД использовали ИТПОД, с помощью которого определяли выраженность эритемы, количество папул, интенсивность шелушения в баллах (табл.1) и выделяли 3 степени СД: легкую, среднюю и тяжелую [9, 10]. В зависимости от количества баллов индекс трактуется следующим образом: 0 – заболевание отсутствует, 0,5–2,5 балла – легкая степень, 3,0–5,5 былла – средняя/умеренная степень, 6,0–9,0 баллов – тяжелая степень заболевания.

Диагноз ВИЧ-инфекции подтверждали в иммуноблотинге реакцией ИФА с набором реагентов «Вектор-Бест» (Новосибирск, Россия). Уровень РНК ВИЧ-1 определяли методом ПЦР на приборе ICYCLER (Австрия) с использованием тест-системы «АмплиСенс HIV-Monitor», (ЦНИИ эпидемиологии Роспотребнадзора, Москва, Россия), количество субпопуляции лимфоцитов – методом проточной цитометрии на приборе FACS Calibur (Becton Discenson, США). Постановку клинического диагноза ВИЧ-инфекции (определение клинической стадии ВИЧ-инфекции) выполняли согласно «Национальным рекомендациям по диспансерному наблюдению и лечению больных ВИЧ-инфекцией» [11].
Статистическую обработку материала проводили с помощью программы Microsoft Office professional plus 2010.
 Результаты
Результаты
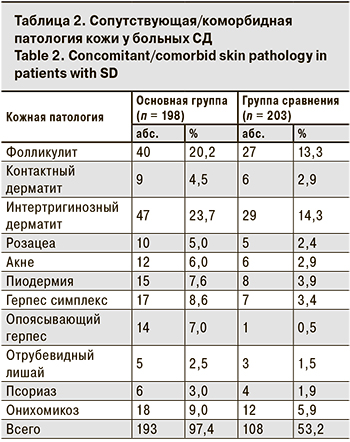
В основной группе непрерывное течение СД регистрировали у 53 (26,4%) пациентов, в группе сравнения – у 12 (5,9%). Сочетание СД с другими кожными заболеваниями выявлено у 193 (97,4%) больных основной группы и у 108 (53,2%) больных группы сравнения (табл. 2).
Клинические проявления СД носили распространенный характер (с поражением кожи головы, туловища, конечностей) в основной группе у 43 (20,7%) больных, в группе сравнения – у 18 (8,9%). Преимущественное поражение кожи лица наблюдали у 143 (72,2%) больных основной группы и у 156 (76,8%) больных группы сравнения, поражение кожи волосистой части головы – соответственно у 11 (5,5%) и 19 (9,4%) больных, поражение кожи верхней части туловища – у 1 (0,5%) и 7 (3,4%) больных. Локального вовлечения кожи конечностей у больных основной группы не выявлено, в группе сравнения отмечено 4 (1,9%) случая.
У 123 (62,1%) пациентов основной группы СД проявлялся в виде единичных бледно-розовых очагов с небольшим количеством желтоватых чешуек, корочек и умеренным шелушением. Кожные изменения главным образом локализовались на лице и коже волосистой части головы. У 75 (37,9%) пациентов высыпания имели более интенсивную темно-красную окраску с незначительным возвышением над уровнем здоровой кожи, умеренно выраженным шелушением и значительным количеством рыхлых желтых корочек на поверхности. Из субъективных ощущений больные отмечали незначительный зуд в области высыпаний.
На момент первичного осмотра у больных основной группы были определены стадии ВИЧ-инфекции (табл. 3). У 143 (72,2%) пациентов на стадии вторичных заболеваний (4А–4В) количество CD4+-лимфоцитов было снижено и находилось в пределах 50–370 клеток/мл. ВН была высокой (> 4 log10) у 101 (51%) пациентов, что объясняется активной репликацией вируса.
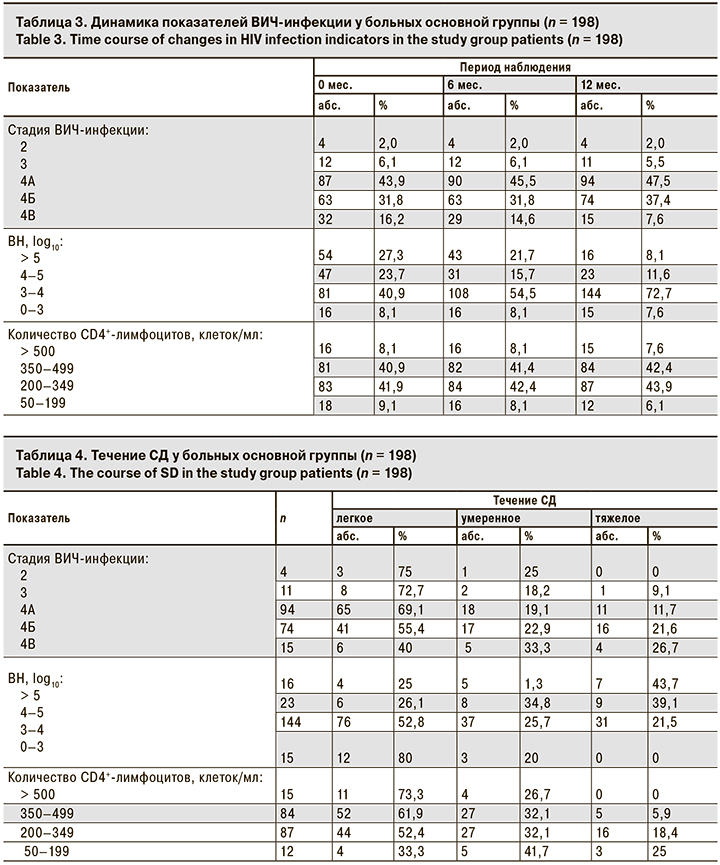
Изменения динамики показателей ВИЧ-инфекции объясняются утяжелением течения заболевания у 1 больного на субклинической стадии и улучшением его на фоне АРТ у больных на стадиях 4А–4В.
СД встречается у пациентов на всех стадиях ВИЧ-инфекции. При этом по мере перехода ВИЧ-инфекции в более тяжелую стадию, уменьшения количества CD4+-лимфоцитов и нарастания ВН происходит утяжеление течения СД (табл. 4).
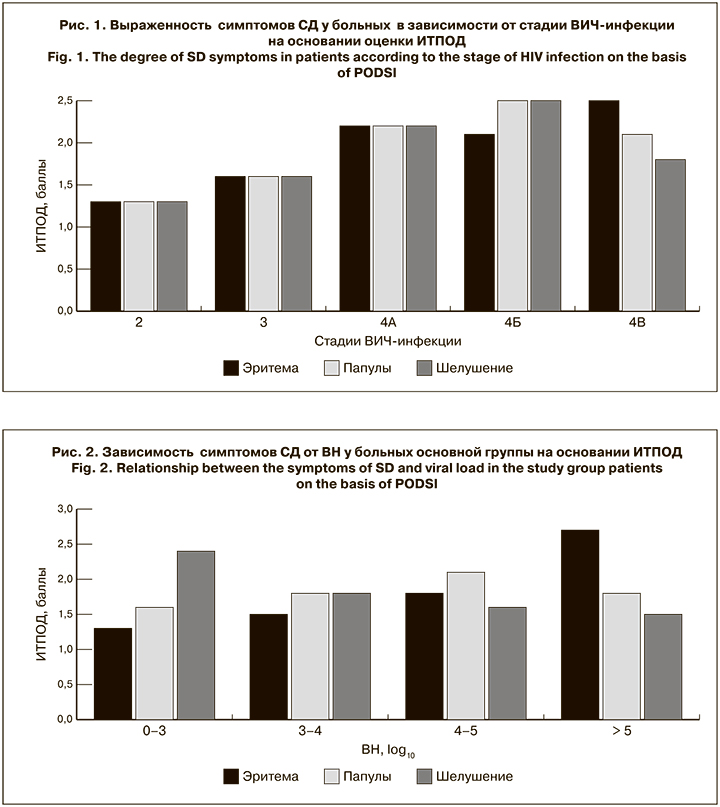
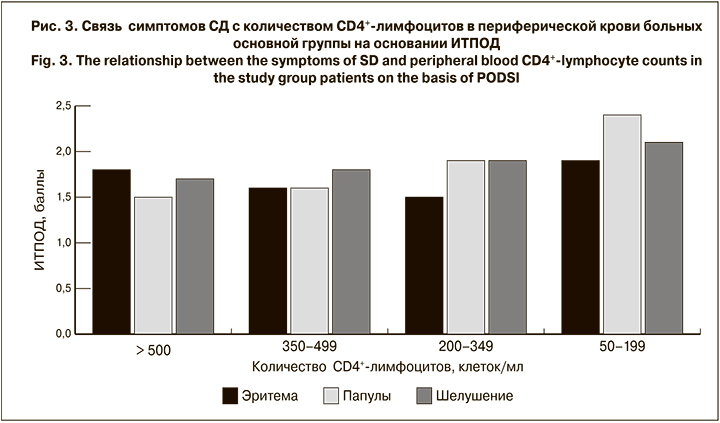
Для оценки связи клинических проявлений СД при ВИЧ-инфекции мы сравнили интенсивность их манифестации в зависимости от клинической стадии ВИЧ-инфекции, ВН и количества CD4+-лимфоцитов. Установлено, что течение СД достоверно ухудшается при нарастании стадии ВИЧ-инфекции. При этом интенсивность эритемы и шелушения кожи разнонаправленно коррелирует с показателями ВН, а интенсивность папулезных высыпаний прямо пропорциональна количеству CD4+-лимфоцитов. Такая зависимость отмечалось в течение всего периода наблюдения. Конечные результаты представлены на рисунках.
Обсуждение
Частота сопутствующей/коморбидной патологии кожи у больных СД в нашем наблюдении была сопоставима с данными, представленными в работах N. Zander и соавт. [2] и P.K. Ramdial и соавт. [14], что подтверждает достоверность полученных нами результатов.
Изучая выраженность клинических симптомов СД в зависимости от стадии ВИЧ-инфекции, ВН и иммунного статуса больных, к сожалению, схожих исследований мы не обнаружили. По нашему мнению, полученные результаты могут быть использованы для клинической оценки изменения течения ВИЧ-инфекции.
Выводы
- У ВИЧ-инфицированных больных СД чаще, чем у ВИЧ-негативных больных встречается сопутствующая/коморбидная патология кожи.
- Тяжесть течения СД у ВИЧ-инфицированных больных зависит от клинической стадии ВИЧ-инфекции, количества CD4+-лимфоцитов и уровня ВН.
- Интенсивность проявления симптомов СД (эритема, шелушение кожи, папулезные высыпания) может служить маркером течения ВИЧ-инфекции.



