Доказательная медицина (ДМ) представляет собой новый подход к медицинской практике. Существует несколько определений понятия «доказательня медицина»:
- «сознательное, четкое и беспристрастное использование лучших из имеющихся доказанных сведений для принятия решения о помощи конкретным больным» [1];
- «усиление традиционных навыков клинициста в диагностике, лечении, профилактике и других областях путем систематического формулирования вопросов и применения математических оценок вероятностей и рисков» [2];
- «последовательное применение современных лучших доказательств, почерпнутых из опубликованных клинических и эпидемиологических исследований, в ведении пациентов с вниманием к балансу пользы и вреда диагностических и сравниваемых лечебных вмешательств, а также с учетом уникальных особенностей каждого пациента, включая исходный риск, сопутствующие состояния и личные предпочтения» [3];
- «подход к медицинской практике, ставящий своей целью оценить и улучшить уход за пациентом. Он требует сознательной интеграции лучших сведений, полученных в медицинских исследованиях, с мнением и предпочтениями пациента для принятия решений о медицинском уходе. Этот подход помогает врачам ставить верный диагноз, определять лучший план обследования, выбирать самое эффективное лечение или методы профилактики, а также разрабатывать рекомендации для широких групп пациентов с тем же заболеванием» [4].
Последнее из определений используется в Medical Subject Headings [5], поэтому в дальнейшем мы будем исходить из него с некоторым дополнением: принципы ДМ могут применяться не только в клинической практике, но и при принятии любого решения в сфере медицины.
U. Tröhler [6] выделил в развитии ДМ несколько периодов, которые мы приводим с некоторыми изменениями (табл. 1).
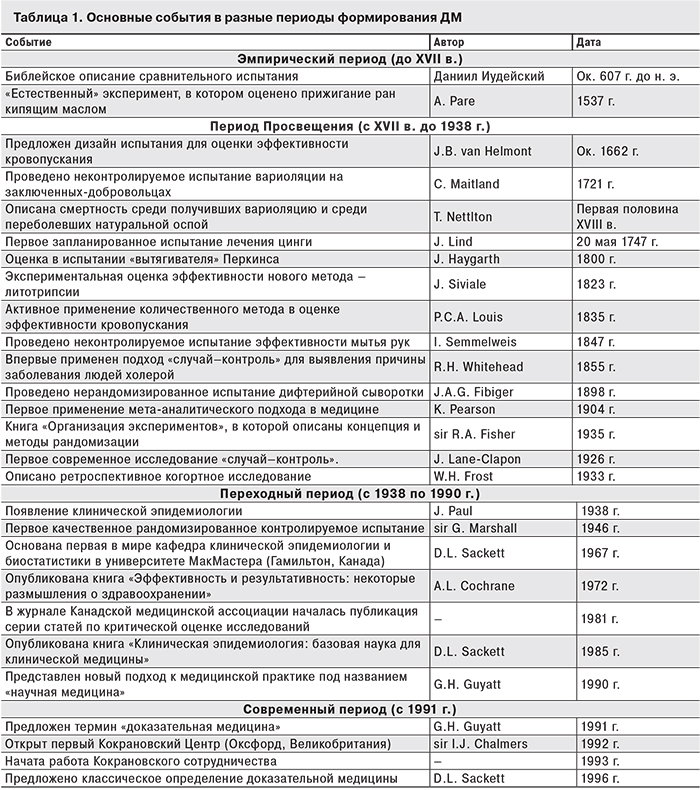
Эмпирический период (до XVIII в.) [6]. В древности основания для принятия врачебных решений получали с помощью суждений по аналогии и несистематического клинического опыта (врача, его коллег и учителей). Этот подход достиг наибольшего совершенствования к 280 г. до н. э. в древнегреческой школе эмпириков, в честь которой и назван [7].
Интуитивные попытки обосновывать решения с помощью результатов сравнительных исследований имеют столь же древние корни: в Библии (Дан 1: 12–15) встречается описание экспериментального сравнения «царской» и вегетарианской диет, в ходе которого юноши-иудеи придерживались одной из них в течение 10 дней, после чего оценивался их внешний вид. Эксперимент был проведен по настоянию Даниила Иудейского, который желал показать преимущество одной из диет [8, 9].
Столь же интуитивен был и «естественный эксперимент» Амбруаза Парэ (Ambroise Paré). Во время осады замка Вилаин (Villaine) в 1537 г. часть раненых солдат из-за скудности запасов получила не предписанное в то время лечение огнестрельных ран (прижигание кипящим маслом), а обработку смесью из яичных желтков, розового масла и скипидара. На следующее утро обеспокоенный хирург был несказанно удивлен: раненые, не получившие традиционного лечения, выглядели значительно лучше. Это наблюдение подвигло А. Парэ навсегда отказаться от прижигания огнестрельных ран кипящим маслом [9–11].
История кровопускания насчитывает не одно тысячелетие [7], но первое предложение подвергнуть метод оценке исходило от ван Гельмонта (van Helmont) в 1662 г. В письме коллегам он предложил взять «из больниц, ночлежек или откуда-то еще 200 или даже 500 бедных людей, у которых отмечается лихорадка, плеврит и прочее» затем поделить их «на две группы», бросив жребий. Результаты предлагалось оценивать по числу похорон в каждой группе [2, 11, 12]. Сегодня не до конца ясно, был ли этим врачом Жан Баптиста ван Гельмонт или же его сын – Франциск Меркурий. В 1662 г., которым датируется цитируемое письмо, Жана Баптисты уже не было в живых.
Период Просвещения (с XVIII в. до 1938 г.) [6]. Самое значительное достижение этого периода – переход от эмпирического познания к научному – оказало огромное влияние на принятие практических решений в медицине и формирование ДМ. Вместе с тем в это время также имели место самые вопиющие случаи пренебрежения научными достижениями.
Древний и эффективный метод профилактики натуральной оспы – вариоляция – европейским врачам того времени представлялся весьма спорным. Только в 1721 г. шотландский хирург Чарльз Мейтлэнд (Charles Maitland), сопровождавший жену британского посла в Константинополь, выполнил вариоляцию дочери посла при большом стечении сведущих людей, засвидетельствовавших преимущества метода [13]. Иногда это событие связывают с самой леди Мери Вортли-Монтаг (Lady Mary Wortley Montague), не имевшей отношения к медицине [9]. Спустя 4 мес. с позволения короля Георга I эксперимент был повторен на шести заключенных, согласившихся участвовать в нем в обмен на помилование. Легкая форма натуральной оспы, перенесенная пятью заключенными, стала еще одним убедительным доказательством преимуществ вариоляции [9, 13]. Немногим позже Томас Неттлтон (Thomas Nettleton) количественно оценил смертность в группе переболевших натуральной оспой (умерло «почти 22 из 100»), в то время как среди 55 инокулированных им никто не умер. Сходные результаты были получены и другим британским врачом Джеймсом Юрином (James Jurin), состоявшим с Т. Неттлтоном в активной переписке [13].
Цинга, веками косившая моряков, не единожды попадала в поле зрения врачей, но именно Джеймсу Линду (James Lind) принадлежит экспериментальное обоснование лечения этой болезни. Сочтя собственный клинический опыт недостаточным, Д. Линд провел систематический обзор всей имевшейся литературы по цинге [14]. А во время плавания на судне «Salisbury» 20 мая 1747 г. он начал эксперимент с участием 12 из 80 заболевших цингой моряков, в котором была установлена эффективность цитрусовых в лечении этой болезни [8, 11, 15, 16]. Всемирно известный «Трактат о цинге» опубликован Дж. Линдом в 1953 г., но прошло еще долгих 42 года (!) до внедрения в практику четко описанного и экспериментально подтвержденного метода ввиду отсутствия теоретического обоснования [14].
В обширном перечне совершенно бесполезных медицинских вмешательств (таких как пилюли Андерсона Скотта, эликсир Даффи и др. [17]) видное место занимает «вытягиватель Перкинса». Он представлял собой стержни с булавовидным утолщением на конце, изготовленные из «секретного сплава». Уверения автора в чудодейственной силе «вытягивателя» решил проверить Джон Хайгарт (John Haygarth), под руководством которого в 1800 г. шести пациентам был проведен курс лечения настоящим «вытягивателем» и его деревянным макетом. В результате пациенты отметили одинаковую эффективность обоих методов, что убедило врачей того времени в неэффективности метода [18].
На другом берегу Ла-Манша, во Франции количественный метод развивался под названием «medicine d’observation» [19]. Жан Сивиаль (Jean Siviale) для демонстрации превосходства изобретенного им метода литотрипсии над традиционной перинеальной литотомией обобщил данные о летальности при каждой из этих процедур [15, 20]. Его труды были отвергнуты Парижской академией наук 1835 г. по формальным признакам [20]. Однако в том же году куда более благосклонно была принята работа Пьера Шарля Александра Луи (Pierre Charles Alexandre Louis), посвященная оценке эффективности кровопускания при воспалительных заболеваниях легких, приведшая к полному отказу от метода в Европе [10, 12, 15, 20–22]. Работы Ж. Сивиаля и П. Луи спровоцировали и более глубокую дискуссию о роли и месте статистики в медицине, завершившуюся безоговорочным поражением сторонников количественного метода. Ожесточенное сопротивление практикующих врачей строилось на утверждении, что знание о «среднестатистическом пациенте» не дает им представления о конкретном пациенте. Поэтому врачи должны лечить, опираясь на собственный опыт и советы коллег [15].
В то же время основной причиной неприятия количественного метода можно назвать заявление его сторонников о безусловном превосходстве количественного метода над другими способами обоснования решений в медицине [20].
Локальная вспышка холеры на Броад-стрит в 1855 г. повергла в растерянность местный медицинский комитет, который пытался установить ее причину. Молодой врач Джон Сноу (John Snow) самостоятельно опросил всех заболевших и, применив количественный метод, нашел связующее звено: все пили воду из одной колонки [11]. Комитет заслушал, но не принял доводы Дж. Сноу, а один из членов комитета, священник Реверенд Генри Вайтхед (Reverend Henry Whitehead), был настолько скептичен, что самостоятельно (порой до 5 раз!) опросил все семьи на Броад-стрит, в том числе и о деталях потребления воды в период с 30 августа по 8 сентября того года. В результате он вынужден был признать, что «среди заболевших, отношение пивших к не пившим [воду из колонки] – 80 к 20, в то время как среди здоровых то же отношение составило 57 к 279». Так впервые было проведено исследование «случай–контроль» [23, 24].
«Родильная горячка» – бич родильных домов прошлого – уносила жизнь каждой пятой роженицы, пока в 1847 г. Игнац Филипп Земельвейс (Ignaz Philipp Semmelweis) не открыл ее причину – «трупный яд». «Трупный яд», переносимый руками врачей из анатомического театра в родильный зал, оказалось не так сложно устранить: необходимо было всего лишь мыть руки (в то время – с применением гипохлорита кальция). Внедрение этого мероприятия в одной больнице позволила И. Земельвейсу добиться снижения смертности от родильной горячки в 15 раз (с 18,3% в апреле до 1,2% в июле 1847 г.). Однако описание смертности до и после внедрения метода не убедило врачей того времени, поскольку противоречило устоявшимся теориям, а требование мыть руки и вовсе казалось многим оскорбительным [25].
Значительно обогатился арсенал инструментов получения доказательств к началу XX в. Одно из первых контролируемых испытаний провел в 1898 г. Йоханнес Андреас Гриб Фибигер (Johannes Andreas Grib Fibiger), оценив эффективность дифтерийной сыворотки на достаточно большом количестве больных. Несмотря на то что случайное распределение пациентов по группам лечения и плацебо постулировалось как основной методологический принцип, пациентов распределяли по группам в зависимости от даты обращения [10, 26].
Первое количественное обобщение результатов отдельных исследований (названное «мета-анализом» в 1976 г. [27, 28]) было проведено в 1904 г. Карлом Пирсоном (Karl Pearson) [15, 27, 29].
Истинной вехой в развитии научного метода в медицине стала публикация в 1935 г. сэром Рональдом Эйлмером Фишером (sir Ronald Aylmer Fisher) книги «Дизайн экспериментов», в которой представлена концепция рандомизации [15, 27].
Первое современное исследование типа «случай–контроль» провела Джэнет Лейн-Клэйпон (Janet Lane-Clapon) в 1926 г., установив такие факторы риска развития рака молочной железы у женщин, как отсутствие родов и одиночество [23, 30].
Впервые ретроспективное когортное исследование работников никелевого завода было проведено сэром Остином Брэдфордом Хиллом (sir Austin Bradford Hill) в 1929–1938 г. (результаты его были опубликованы только в 1969 г.) [31], однако первое описание этого дизайна дано в 1933 г. Вэйдом Хемптоном Фростом (Wade Hampton Frost), предложившим и сам термин 2 года спустя [31, 32]. В то же время результаты начатого им в 1910 г. проспективного когортного исследования заболеваемости туберкулезом (самый ранний вариант когортного исследования) были опубликованы в 1939 г. [32]. Более современный вариант проспективного когортного исследования широко известен – это исследование когорты Британских медиков, начатое в 1951 г. сэром Брэдфордом Остином Хиллом и сэром Уильямом Ричардом Шэбо Доллом (sir William Richard Shaboe Doll) с целью подтверждения связи курения с развитием рака легкого [32].
Переходный период (1938–1991 гг.) (по [6] с изм.). В этот период произошли важнейшие события, доказавшие необходимость изменения традиционного подхода к медицинской практике. Официальное введение эпидемиологического метода (и вместе с ним количественного метода) в клиническую практику произошло в 1938 г., когда Джон Пол (John Paul) впервые предложил применить его для решения клинических задач [33].
Осознание необходимости проверки любых медицинских вмешательств в методологически качественных исследованиях впервые проявилось на государственном уровне в 40-е годы XX в. Такой проверке эффективности в отношении легочного туберкулеза подвергся антибиотик стрептомицин (пенициллин формальной проверке не подвергался из-за очевидной эффективности [9]). Результаты этого многоцентрового рандомизированного контролириуемого испытания, проведенного под руководством сэра Джоффри Маршала (sir Geoffrey Marshall), были опубликованы в 1946 г. [10, 15].
Отдельного упоминания требует история, произошедшая с Дэвидом Лоуренсом Саккеттом (David Lawrence Sakkett) в 1959 г. Будучи студентом-медиком выпускного курса, он ухаживал за подростком с «инфекционным гепатитом» (гепатит А). По всеобщему убеждению, только строгий постельный режим в течение 1–2 мес. мог уберечь печень несчастного от необратимых поражений, но Д. Саккетт заинтересовался, что случится, если не придерживаться постельного режима. Мир юного врача перевернуло испытание, проведенное в 1955 г. Томом Чалмерсом, в котором было установлено, что время выздоровления среди придерживающихся и не придерживающихся постельного режима одинаково, а частота побочных явлений не отличается [34, 35]. Пронеся воспоминание об этом случае сквозь годы, Д. Саккетт в 1967 г. открыл первую кафедру клинической эпидемиологии и биостатистики в Университете МакМакстера (McMaster University; Гамильтон, Канада) [36], в стенах которой и зародился новый подход к медицинской практике [16, 35, 37].
Немалую роль в становлении ДМ сыграл Арчибальд Леман Кокран (Archibald Leman Cochrane), получивший широкую известность благодаря книге «Эффективность и результативность: некоторые размышления о здравоохранении» (1972), в которой обосновывалась необходимость отказа от вмешательств с недоказанной эффективностью [38]. В его книге также заложены основы иерархии доказательств.
Оксфордская база перинатальных испытаний была создана благодаря высказанной им в 1979 г. идее о необходимости обобщения имеющихся результатов рандомизированных котролируемых испытаний. В 1987 г., за год до смерти, А. Кокран предложил исследователям воспользоваться методологией систематического обзора, которую он полагал весьма перспективной [39, 40].
Центральный раздел ДМ – «критическая оценка» биомедицинских исследований – впервые представлен в серии статей, публикация которой началась в журнале Канадской медицинской ассоциации в 1981 г. [33, 41]. А спустя 4 года основы ДМ были изложены в книге «Клиническая эпидемиология: базовая наука для клинической медицины» [35].
Завершает переходный период презентация нового подхода к медицинской практике под названием «научная медицина» («scientific medicine»), которую провел ученик Д. Саккетта Гордон Генри Гаятт (Gordon Henry Guyatt) в стенах университета МакМастера в 1990 г. Однако это название было принято медицинским факультетом в штыки во многом из-за намека на «ненаучность» практики, существовавшей до этого момента [37].
Современный период ( с 1991 г.) (по [6] с изм.). Смена в 1991 г. названия нового подхода «научная медицина» на общеизвестное сегодня «доказательная медицина» является отправной точкой современного периода его развития. Обтекаемое название, предложенное Г. Гаяттом [16, 35, 37] на страницах «ACP Journal club», больше не вызывало неприятия у врачей [33].
В 1992 г. мировому медицинскому сообществу на страницах «JAMA» в статье «Evidence-Based Medicine: A New Approach to Teaching the Practice of Medicine» была представлена ДМ. Подход быстро обрел множество сторонников [33, 38].
Кокрановское сотрудничество, немалая роль в создании которого принадлежит сэру Иэну Джоффри Чалмерсу (sir Iain Jeoffrey Chalmers) [34, 37, 42], начало работу по составлению широко известных сегодня систематических обзоров в 1993 г., а годом ранее был открыт первый Кокрановский центр в Оксфорде [16, 34, 43].
Акцент ДМ на разделении медицинских решений с пациентами проявился уже после ее появления: в более поздних определениях уделяется существенное внимание именно пожеланиям и предпочтениям пациента [16, 34]. И так же меняется подход к использованию исследований практическим врачом: на смену первичным исследованиям, которых сегодня необъятное количество, приходит применение качественных клинических рекомендаций, составленных врачами-профессионалами для широкого применения.
Доказательная медицина – новый подход к медицинской практике, имеющий очень древние корни. Важность ДМ оценило медицинское сообщество, назвавшее ее одним из 15 важнейших достижений медицины за последние полтора века [16, 35]. В прошлом результаты сравнительных исследований зачастую игнорировались или рассматривались как неприемлемые в клинике. Однако развитие количественного метода подарило нам множество высококачественных и теоретически проработанных дизайнов исследований. На сегодняшний день при принятии решений как практикующий врач, так и специалист в области организации здравоохранения должны руководствоваться не только собственным опытом и мнением экспертов, основанным на рассуждениях, но и обращаться к результатам лучших существующих сравнительных исследований. Сформулированные не так давно принципы ДМ существовали на протяжении многих веков в неявном виде и показали свою состоятельность. Практическое применение принципов ДМ будет способствовать повышению качества и эффективности медицинской помощи населению.



