По данным «Доклада о результатах и основных направлениях деятельности Федеральной службы исполнения наказаний (2015–2017 год)»1, на 01.01.2015 в учреждениях уголовно-исполнительной системы находилось 49 600 больных наркоманией (7,35% от общего числа отбывающих наказание) и 54 800 осужденных с психическими расстройствами (8,12%). Согласно информации, представленной на официальном сайте Федеральной службы исполнения наказаний России2, за преступления, связанные с наркотиками, в исправительных колониях (ИК) в 2016 г. отбывали наказание 138 260 осужденных. Среди больных наркоманией и психически дезадаптированных осужденных имеется значительное число лиц, живущих с ВИЧ/СПИДом, многим из них по показаниям назначена антиретровирусная терапия (АРТ). Согласно опубликованным ранее результатам исследования эпидемического процесса ВИЧ-инфекции в пенитенциарных учреждениях Хабаровского края [1], отличительной социальной характеристикой ВИЧ-инфицированных осужденных был низкий уровень их образования и низкий уровень знаний о мерах профилактики гемоконтактных инфекций. Учитывая высокий удельный вес лиц, живущих с ВИЧ/СПИДом, из групп повышенного риска среди осужденных, отбывающих наказание в ИК, представлялось целесообразным оценить их приверженность к АРТ, выяснить спектр мутаций лекарственной устойчивости ВИЧ в случаях вирусологической неэффективности АРТ с целью рациональной коррекции схем терапии при выявлении мутаций высокой устойчивости к антиретровирусным препаратам (АРВП). Учитывая регулярную смену контингента осужденных за счет освобождающихся после отбытия срока наказания и вновь прибывающих в ИК, генотипирование и филогенетический анализ нуклеотидных последовательностей ВИЧ, выявленных у осужденных, информативны в отношении спектра субтипов ВИЧ-1, циркулирующих среди групп повышенного риска заражения.
Целью настоящего исследования было изучение молекулярно-генетических особенностей ВИЧ у осужденных, принимающих АРТ в условиях ИК. Задачи исследования включали оценку частоты и спектра мутаций лекарственной устойчивости ВИЧ-1 среди осужденных с вирусологической неэффективностью АРТ, генотипирование и филогенетический анализ выявленных нуклеотидных последовательностей ВИЧ-1, оценку степени приверженности осужденных к назначенной АРТ.
Материалы и методы
В 2016 г. из двух женских ИК, находящихся на территории Свердловской области, было получено 89 образцов крови от ВИЧ-инфицированных осужденных, которым была назначена АРТ, после информированного добровольного согласия на обследование. Во всех образцах определяли вирусную нагрузку с помощью наборов реагентов «РеалБест РНК ВИЧ количественный» согласно инструкции производителя (АО «Вектор-Бест», Россия) на амплификаторе Rotor-Gene Q («QIAGEN», Германия). В 32 пробах, имевших вирусную нагрузку > 1000 копий/мл, была определена резистентность ВИЧ-1 к ингибиторам протеазы (ИП) и обратной транскриптазы генотипическим методом с использованием наборов реагентов «АмплиСенс® HIV-Resist-Seq» (ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Россия) на генетическом анализаторе Applied Biosystems 3500 Genetic Analyzer («Life Technologies», США). Сборку, оценку качества, редактирование, выравнивание консенсусных нуклеотидных последовательностей фрагментов генов обратной транскриптазы и протеазы ВИЧ-1 проводили с помощью программного обеспечения «ДЕОНА» (ООО «Мед АйТи Групп», Россия), также выполнявшего идентификацию мутаций резистентности ВИЧ-1 и оценку степени влияния выявленных мутаций на устойчивость к 19 АРВП, относящимся к нуклеозидным/нуклеотидным ингибиторам обратной транскриптазы (НИОТ), ненуклеозидным ингибиторам обратной транскриптазы (ННИОТ) и ИП. Для описания мутаций лекарственной устойчивости ВИЧ-1 использовали электронный ресурс HIV Drug Resistance Database Стэнфордского университета (Stanford University)3.
Генотипирование выделенных нуклеотидных последовательностей ВИЧ-1 проводили с помощью онлайн-программы REGA HIV-1 Subtyping Tool v.3.0 Стэнфордского университета4. Поиск субтиповых рекомбинантных последовательностей выполняли с помощью онлайн-программ jpHMM-HIV Геттингенского университета (Georg-August-Universität Göttingen)5 и RIP Лос-Аламосской национальной лаборатории (Los Alamos National Laboratory)6.
Для филогенетического анализа полученных последовательностей ВИЧ-1 использовали программу MEGA v.77. Филограммы были построены по алгоритму «ближайшего соседа» (Neighbor-Joining). Расчет эволюционных дистанций между последовательностями производили согласно двухпараметрической модели М. Кимуры (Kimura 2-parameter). Достоверность топологии филограмм оценивали методом повторных выборок на основании анализа 1000 псевдореплик. Достоверными считали построения при индексе поддержки не менее 70%. При построении филограммы был использован геновариант предшественника AFSU – EU861977 [2].
У 138 заключенных из двух ИК, которым была назначена АРТ, степень приверженности к лечению оценивали согласно Методическим рекомендациям МР 3.1.5.0075/1-138.

Результаты
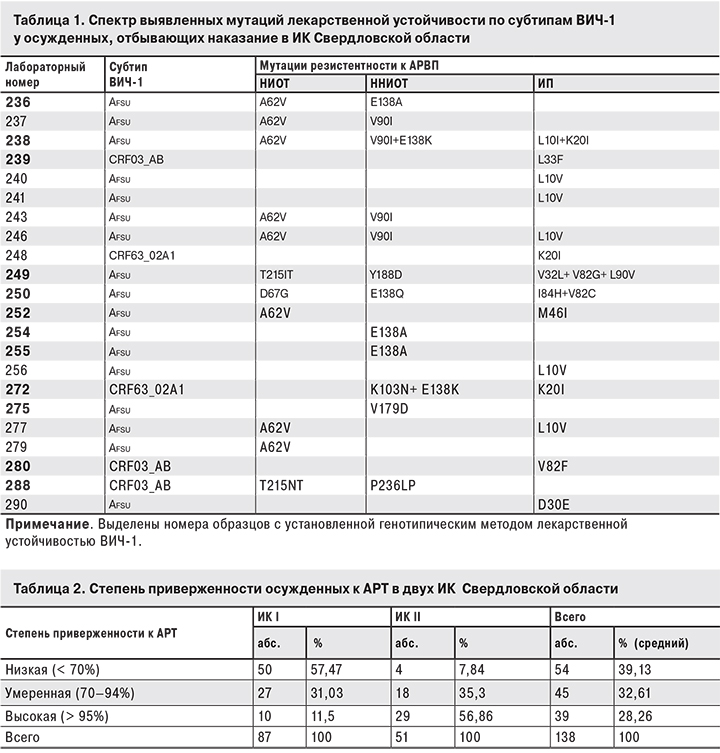
Определение вирусной нагрузки в 89 образцах крови от осужденных, которым была назначена АРТ, показало, что в 57 (64,0%) образцах вирусная нагрузка составляла < 1000 копий/мл. Из 32 образцов плазмы крови, имевших вирусную нагрузку > 1000 копий/ мл, была выделена РНК ВИЧ и выполнено секвенирование нуклеотидных последовательностей генов обратной транскриптазы и протеазы ВИЧ-1. 20 (62,5%) из 32 проанализированных последовательностей были интерпретированы программой «ДЕОНА» как полностью чувствительные к 19 АРВП. Ни одна из 32 нуклеотидных последовательностей не содержала мутаций, ассоциированных с высоким уровнем резистентности к назначенным АРВП в текущей схеме. Полученный результат был в некоторой степени неожиданным, поскольку в ИК отбывает наказание значительное количество осужденных по делам, связанным с наркотиками, многие из которых либо были инфицированы штаммами ВИЧ с первичной лекарственной устойчивостью, либо вторичная резистентность могла возникнуть при нерегулярном приеме АРВП. Среди образцов, поступивших в референс-лабораторию Уральского окружного центра по профилактике и борьбе со СПИД при ФБУН «Екатеринбургский НИИ вирусных инфекций» Роспотребнадзора за тот же период 2016 г., нуклеотидные последовательности ВИЧ-1, которые были интерпретированы как полностью чувствительные к 19 АРВП, встречались значительно реже. Такие последовательности были выявлены в 8 (12%) из 62 образцов, полученных из Челябинской области, в 3 (25%) из 12 образцов, полученных из Тюменской области, в 13 (37%) из 35 образцов, полученных из Курганской области. Лишь одна из 32 последовательностей, выделенных у осужденных, была интерпретирована как имеющая высокий уровень устойчивости к невирапину и эфавирензу, однако в текущей схеме АРТ данные препараты не применяли. В 12 из 32 последовательностей ВИЧ-1 от осужденных в соответствии с алгоритмом программы «ДЕОНА» была выявлена лекарственная устойчивость «среднего», «низкого» и «возможно низкого» уровня к различным АРВП. Спектр выявленных аминокислотных замен в результате мутаций лекарственной устойчивости ВИЧ-1 представлен в табл. 1.
Генотипирование нуклеотидных последовательностей, полученных от осужденных, показало, что преобладающим был субтип A1 с ближайшим предшественником – геновариантом Afsu (происходящим от EU861977). При этом 5 последовательностей относились к циркулирующим рекомбинантным формам CRF03_AB, 2 – к циркулирующим рекомбинантным формам CRF63_02A1.
При сравнении выделенных нуклеотидных последовательностей ВИЧ-1 между собой на филограмме сформировалось 3 корневых топологических ветви (см. рисунок), объединивших 3 основных кластера последовательностей в соответствии с тремя субтипами ВИЧ-1. Наибольший по числу последовательностей кластер объединил геноварианты ВИЧ-1 субтипа A1 преимущественно от осужденных, имевших регистрацию в населенных пунктах Свердловской области: Екатеринбурге, Нижнем Тагиле, Камышлове, Краснотурьинске, Серове, Полевском, Арамиле, Реже, Асбесте, Богдановиче, Тавде, Кашино. В кластере субтипа A1 был выделен субкластер, объединивший 2 близкородственные последовательности ВИЧ-1 (идентичность 99%) от лиц, зарегистрированных в Перми и в г. Богдановиче Свердловской области. В кластере субтипа CRF63_02A1 также были обнаружены 2 близкородственные последовательности (идентичность 97,6%), выделенные от лиц, зарегистрированных в Томске и Нижнем Тагиле (Свердловская область).
Степень приверженности к терапии у 138 осужденных, которым была назначена АРТ и среди которых проводилось углубленное лабораторное обследование, приведена в табл. 2.
Доля осужденных с высоким уровнем приверженности к АРТ значительно различалась по данным опроса в двух ИК. Тем не менее, среди 89 из 138 опрошенных, прошедших лабораторное обследование, низкая вирусная нагрузка (< 1000 копий/мл) в ИК I была выявлена у 51,1% обследованных (у 23 из 45), в ИК II – у 59,1% обследованных (у 26 из 44). Кроме того, в настоящей работе не было выявлено обратной зависимости между указанной в направлении на исследование степенью приверженности к АРТ и вирусной нагрузкой.
Вероятной причиной расхождения результатов опроса и данных лабораторного обследования была низкая надежность оценки степени приверженности к АРТ. Нерегулярность приема АРВП в ИК также была обусловлена нестабильностью поставок АРВП с октября 2015 г. по март 2016 г., что создавало предпосылки для возникновения вторичной лекарственной устойчивости ВИЧ.
Обсуждение
Высокая (62,5%) доля нуклеотидных последовательностей ВИЧ-1, которые были интерпретированы как полностью чувствительные к 19 АРВП, на фоне назначенной АРТ и вирусологической неэффективности лечения (вирусная нагрузка > 1000 копий/мл) могла быть обусловлена низким уровнем приверженности осужденных к АРТ, что подтверждается данными опроса. Известно, что длительная отмена АРТ наряду с ростом вирусной нагрузки приводит к постепенному вытеснению полирезистентных мутантов монорезистентными и далее – к доминированию последовательностей исходного геноварианта, определяющих консенсусную нуклеотидную последовательность [3, 4].
Выявление акцессорных мутаций лекарственной устойчивости ВИЧ-1 при отсутствии основных мутаций резистентности к АРВП также может косвенно указывать на длительную отмену АРТ. В настоящем исследовании наиболее часто выявляли аминокислотную замену A62V у геновариантов субтипа AFSU, которая считается акцессорной по отношению к основной мутации множественной устойчивости к НИОТ (с аминокислотной заменой Q151M или K65R), изменяющей активный центр обратной транскриптазы. В изолированном виде аминокислотная замена A62V существенно не снижает чувствительности ВИЧ-1 к НИОТ и выявляется наиболее часто у геновариантов субтипа AFSU, тем не менее, она не относится к мутациям полиморфизма. Замена L10V является результатом акцессорной мутации полиморфизма, которая либо снижает чувствительность к ИП, либо увеличивает скорость репродукции вирусов, имеющих основную мутацию, изменяющую активный центр протеазы. Замена K20I у ВИЧ-1 субтипов В и С является результатом акцессорной мутации, снижающей чувствительность к ИП нелфинавиру. V90I – результат акцессорной мутации полиморфизма, подвергающейся слабой позитивной селекции в присутствии каждого из АРВП класса ННИОТ. Аминокислотные замены E138KAQ снижают чувствительность к ННИОТ этравирину и рилпивирину приблизительно вдвое. Тем не менее методом сайт-направленного мутагенеза было показано, что замена E138Q в плазмиде, несущей геном ВИЧ-1 субтипа С, снизила чувствительность к этравирину более чем в 10 раз, к рилпивирину и эфавирензу – в 5 раз, к невирапину – в 10 раз [5]. Следовательно, дополнительные исследования мутаций полиморфизма методами сайт-направленного мутагенеза могут привести к изменению их интерпретации при генотипическом определении лекарственной устойчивости ВИЧ-1, в том числе – в зависимости от субтипа и геноварианта вируса.
Филогенетический анализ нуклеотидных последовательностей ВИЧ-1, полученных в настоящей работе, выявил субкластер геновариантов CRF63_02A1, объединивший осужденную, зарегистрированную в Нижнем Тагиле Свердловской области и осужденную, зарегистрированную в Томске. Геновариант CRF63_02A1 возник в результате рекомбинации вариантов CRF02_AG и субтипа A [6] и в настоящее время является доминирующим на территориях Сибири (Новосибирская, Томская, Кемеровская области, Алтайский край) [7]. Учитывая дату положительного результата иммуноблоттинга (май 2014 г.) у осужденной, зарегистрированной в Нижнем Тагиле Свердловской области, можно предположить занос геноварианта CRF63_02A1 из Томской области, где он является доминирующим, в Свердловскую область, где на протяжении последних лет преобладал субтип A1.
Выводы
- В 64% образцов от осужденных вирусная нагрузка была неопределяемой или не превышала 1000 копий/мл, что указывало на вирусологическую эффективность АРТ.
- Во всех исследованных образцах от осужденных с вирусной нагрузкой >1000 копий/мл не выявлено высокой или множественной генетической устойчивости ВИЧ-1 к назначенным АРВП. Наиболее вероятной причиной вирусологической неэффективности АРТ у осужденных являлась низкая приверженность к лечению.
- Среди исследованных нуклеотидных последовательностей ВИЧ-1 62,5% были интерпретированы как чувствительные к 19 АРВП. Такой результат возможен после длительной отмены АРТ, когда последовательность штамма дикого типа становится доминирующей в консенсусной нуклеотидной последовательности.
- Среди осужденных, ранее зарегистрированных в Свердловской области, преобладал субтип ВИЧ-1 Afsu.
* * *
Работа выполнена в рамках Отраслевой научно-исследовательской программы Роспотребнадзора на 2016–2020 годы (п.1.3.1.6. «Мониторинг эпидемического процесса ВИЧ-инфекции в Уральском федеральном округе. Эпидемиологические особенности ВИЧ-инфекции среди лиц, отбывающих наказание в учреждениях пенитенциарной системы Уральского федерального округа»).



