Парентеральные гепатиты В (ГВ) и С (ГС) по-прежнему остаются одной из наиболее значимых инфекционных патологий человека. ГВ является вакциноуправляемой инфекцией, массовая вакцинация против него проводится в Российской Федерации уже почти 20 лет. Широкий охват вакцинацией привел к резкому снижению числа новых случаев заражения, однако регистрируемая заболеваемость хроническим ГВ (ХГВ) остается стабильно высокой, равно как и выявляемая в сероэпидемиологических исследования распространенность инфекции [1]. ГС в настоящее время становится инфекцией, управляемой с помощью диагностики и терапии. Внедрение в клиническую практику современных противовирусных препаратов позволяет добиться излечения хрониченского ГС (ХГС) более чем у 95% инфицированных и таким образом снизить риск смерти от рака и цирроза печени, а также число новых случаев заражения [2].
Значительная доля случаев инфекций, вызываемых вирусами ГВ (ВГВ) и ГС (ВГС) протекает бессимптомно и ускользает от регистрации и скрининговых программ. Поэтому регистрируемые показатели заболеваемости являются только вершиной айсберга и не полностью отражают истинную нагрузку этих инфекций на популяцию и интенсивность циркуляции вызывающих их вирусов. Популяционные исследования, в которых определяется распространенность маркеров перенесенной и текущей инфекций, вызванных ВГВ и ВГС, во всех возрастных когортах являются важнейшим инструментом для оценки истинной нагрузки этих инфекций на популяцию и эффективности проводимых программ вакцинопрофилактики ГВ. Кроме того, эти исследования позволяют определить спектр штаммов вирусов, циркулирующих в настоящее время. Подобные исследования важны для фундаментальной эпидемиологии, для понимания закономерностей изменений популяционного иммунитета и поведения вирусов в ответ на противоэпидемические мероприятия и другие внешние воздействия. Результаты таких исследований очень важны для практического здравоохранения, поскольку позволяют понимать, какой будет в ближней и отдаленной перспективе эпидемическая ситуация и на каких группах населения целесообразно сосредоточить скрининговые программы.
Калининградская область в силу своего географического расположения и интенсивных транспортных связей со странами Евросоюза представляет особый интерес с точки зрения распространенности парентеральных вирусных гепатитов и генетического разнообразия циркулирующих в регионе вирусов. В области, население которой составляет около 1 млн человек, заболеваемость ХГС стабильно превышает среднероссийские показатели и варьирует от 64,2 на 100 тыс. населения в 2012 г. до 39,1 – в 2019 г. Именно ХГС является ведущей инфекционной патологией печени в регионе. По данным официальной статистики, многолетняя заболеваемость ХГС стабильно в 4–5 раз превышает заболеваемость ХГВ в Калининградской области (величина показателей последней варьирует от 18,2 на 100 тыс. населения в 2012 г. до 8,3 – в 2019 г.).
Исследование, проведенное на представительной выборке условно здорового населения Калининградской области, направлено на оценку распространенности ВГС и ВГВ в регионе и определение наиболее пострадавших от этих инфекций возрастных групп. Результаты данного исследования позволят определить наиболее адекватную тактику массового лабораторного скрининга на ВГС и ВГВ в реальных условиях, а также выработать стратегию скрининга ВГС при проведении региональных программ по борьбе с ГС.
Цель исследования – определение частоты выявления маркеров текущей и перенесенной инфекций, вызванных ВГВ и ВГС, среди условно здорового населения Калининградской области.
Задачи исследования:
- определить в обследованных когортах долю лиц, имеющих следующие сочетания маркеров ГС: (1) положительные только по анти-ВГС (перенесенная инфекция); (2) положительные по РНК ВГС (текущая инфекция);
- определить в обследованных когортах долю лиц, имеющих следующие сочетания маркеров ГВ: (1) положительные только по анти-НВс (перенесенная или скрытая инфекция); (2) положительные по HBsAg (текущая инфекция).
- определить генотип ВГС для всех образцов, позитивных по РНК ВГС;
- проанализировать факторы риска инфицирования ВГВ и ВГС среди условно здорового населения Калининградской области на основании результатов анкетирования.
 Материалы и методы
Материалы и методы
В исследование были включены 9 возрастных когорт условно здорового населения Калининградской области: до 1 года, 1–9, 10–14, 15–19, 20–29, 30–39, 40–49, 50–59 лет и старше 60 лет. Число обследованных в каждой возрастной когорте, соотношение полов и средний возраст приведены в табл. 1. Соотношение полов во всех возрастных когортах было примерно равным. Всего обследован 1051 человек, что составляет около 0,11% населения области (по данным Росстата на 2019 г. – 1 002 187 человек [3]).
В исследование включали лиц, проходивших рутинную диспансеризацию; посетителей прививочного кабинета, проходивших рутинную вакцинацию; пациентов, посещающих поликлинику по причинам, не связанным с инфекционными заболеваниями.
Критерии включения в исследование:
- подписание пациентом или его законным представителем информированного согласия, одобренного этическим комитетом;
- возраст от менее 1 года до 95 лет;
- отсутствие на момент включения в исследование симптомов острого заболевания [со слов пациента или родителя (законного представителя) ребенка];
- постоянное проживание в Калининградской области.
Критерии исключения из исследования:
- лечение препаратами крови или выделенными из крови препаратами в течение 3 мес. до включения в исследование [со слов пациента или родителя (законного представителя) ребенка];
- температура тела > 37,1 °С или острое заболевание;
- любая вакцинация в течение 4 нед. до взятия крови на исследование.
От всех участников исследования или их законных представителей были получены анкетные данные о факторах риска инфицирования ВГС (наличие татуировок, переливаний крови и хирургических вмешательств в анамнезе), социо-экономических условиях (приложения 1 и 2). У каждого участника исследования был произведен однократный забор крови в объеме около 8 мл у взрослых и около 3 мл у детей моложе 15 лет.
Каждый образец сыворотки крови был разделен на аликвоты (4 аликвоты по 1 мл каждая для взрослых лиц; 4 аликвоты по 0,5 мл каждая для детей моложе 15 лет). Все аликвоты образцов хранились при температуре -70 °С до приведения тестирования.
Все образцы сыворотки крови тестировали методом иммуноферментного анализа (ИФА): на анти-ВГС с применением набора реагентов «Бест Анти-ВГС», на HBsAg – «HBsAg-ИФА-БЕСТ» с чувствительностью 0,01 нг/мл и на анти-HBc – «ВектоHBcAg-антитела» производства ЗАО «Вектор-Бест» (Россия). Все образцы, реактивные по анти-ВГС и HBsAg в скрининговом тесте, подтверждали в соответствующих подтверждающих тестах – на антитела к структурным и неструктурным белкам ВГС («Бест анти-ВГС-подтверждающий тест» и «HBsAg-подтверждающий-ИФА-БЕСТ» ЗАО «Вектор-Бест», Россия).
Все реактивные по анти-ВГС образцы тестировали параллельно на РНК ВГС с помощью набора «АмплиСенс® HСV-FL» (ООО «ИнтерЛабСервис», Россия) для качественного определения РНК ВГС с аналитической чувствительностью 10 МЕ/мл при выделении нуклеиновых кислот из образцов объемом 1 мл.
Все постановки с диагностикумами проводили в соответствии с инструкциям производителей.
Во всех образцах, положительных по РНК ВГС, определяли генотип вируса методом амплификации и секвенирования участков core и NS5B генома ВГС [нуклеотидные позиции 273–1315 и 8616–8638 соответственно, по прототипному изоляту ВГC, штамм H77, генотип 1а (номер в базе данных GenBank AF011753)]. Для фрагмента core условия амплификации первого раунда ПЦР были следующими: 94 °С – 5 мин., затем 35 циклов: денатурация при 94 °С– 45 с, отжиг при 55 °С– 45 с и удлинение цепи при 72 °С – 90 с, финальная элонгация при 72 °С – 7 мин. Праймеры: 5’-gct-agc-cga-gta-gtg-ttg-gg–3’ (внешний, прямой), 5’-acc-agt-tca-tca-tca-tat-ycc–3’ (внешний, обратный). Продукт первой ПЦР амплифицировали во втором раунде ПЦР при тех же условиях. Праймеры: 5’–gaa-agg-cct-tgt-ggt-act-gc–3’ (внутренний, прямой), 5’–ttc-atc-atc-ata-ttc-cat-gcca–3’ (внутренний, обратный). Размер полученного фрагмента составлял 1048 нт.
Для фрагмента NS5B условия амплификации в ПЦР были следующими: 94 °С – 5 мин., затем 35 циклов: денатурация при 94 °С– 45 с, отжиг при 50 °С – 45 с и удлинение цепи при 72 °С – 90 с, финальная элонгация при 72 °С – 7 мин. Праймеры: 5’-ttctcrtatgayacccgctgytttga-3’ (прямой), 5’-tacctvgtvatagcctccgtgaa-3’ (обратный). Размер полученного фрагмента составлял 390 нт.
Обратную транскрипцию и амплификацию проводили с помощью наборов Transcriptor First Strand cDNA Synthesis Kit и Fast Start High Fidelity PCR System (Roche Applied Science, Германия) по протоколам производителя. Все полученные продукты амплификации вырезали из геля и выделяли из агарозы с помощью набора QIAquick Gel Extraction kit (QIAGEN, Hilden, Германия). Первичную нуклеотидную последовательность определяли на автоматическом секвенаторе 3500 Genetic Analyzer (ABI, Foster City, США) с использованием набора Big Dye Terminatorv 3.1 Cycle Sequencing Kit. Филогенетический анализ всех нуклеотидных последовательностей ВГС выполняли с помощью программного обеспечения MEGA 7.0.18.
Статистическую обработку данных проводили методами вариационной статистики с помощью стандартной программы Excel 2010 и программы статистической обработки данных GraphPadPism 4, включавшей расчет 95% доверительного интервала (95% ДИ) для показателей частоты выявления и определение достоверности различий средних значений показателей в сравниваемых группах с использованием точного критерия Фишера и распределения χ2 с коррекцией Йейтса. Различия оценивали как достоверные при p < 0,05.
Результаты
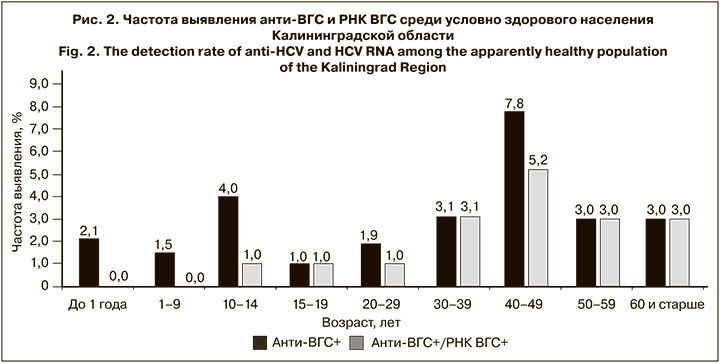
Частота выявления HBsAg в обследованной выборке составила в среднем 0,4% (4/1051; 95% ДИ 0,11–1,01). Доля обследованных лиц, имевших анти-НВс, составила в среднем 17,1% (180/1051; 95% ДИ 14,97–19,53). Частота выявления серологических маркеров ГВ (HBsAg и анти-HBc) в разных возрастных когортах представлена на рис. 1, анти-ВГС и РНК ВГС – на рис. 2.
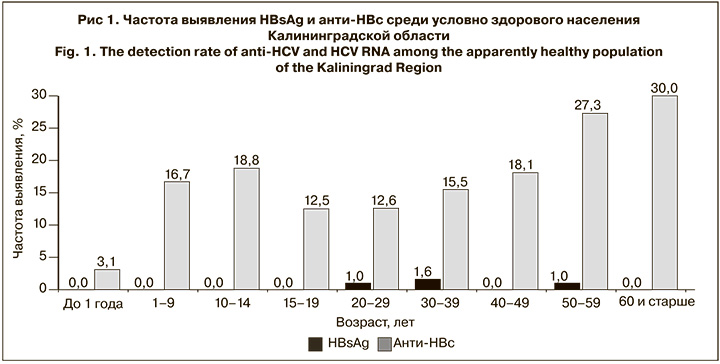
Не было выявлено ни одного случая коинфекции ВГВ и ВГС. В среднем частота выявления анти-ВГС составила 2,9% (31/1051; 95% ДИ 2,07–4,17). Случаи выявления анти-ВГС были зарегистрированы во всех возрастных группах. Число мужчин и женщин среди анти-ВГС-позитивных лиц было примерно одинаково (17 и 14 соответсвенно). Среди детей в возрасте до 1 года анти-ВГС была выявлена в 2,1% случаев (2/97).
Распространенность анти-ВГС среди лиц в возрасте 40–49 лет составила 7,8% (9/116), что достоверно превышало показатели в остальных возрастных группах (p < 0,05). В то же время различия показателей между остальными возрастными группами не были статистически значимыми (p > 0,05).
 В среднем распространенность текущей ВГС-инфекции, подтвержденной выявлением вирусной РНК, среди условно здорового населения Калининградской области составила 1,8% (19/1051; 95% ДИ 1,14–2,82%), при этом доля лиц с активной инфекцией среди позитивных по анти-ВГС составила 61,3% (19/31). Среди детей в возрасте до 1 года не было выявлено ни одного случая активной ВГС-инфекции, что свидетельствует о наличии материнских анти-ВГС у серопозитивных детей в этой группе. Также отсутствовали случаи активной ВГС-инфекции среди детей в возрасте 1–9 лет. Во всех остальных возрастных группах зарегистрированы случаи текущей ВГС-инфекции.
В среднем распространенность текущей ВГС-инфекции, подтвержденной выявлением вирусной РНК, среди условно здорового населения Калининградской области составила 1,8% (19/1051; 95% ДИ 1,14–2,82%), при этом доля лиц с активной инфекцией среди позитивных по анти-ВГС составила 61,3% (19/31). Среди детей в возрасте до 1 года не было выявлено ни одного случая активной ВГС-инфекции, что свидетельствует о наличии материнских анти-ВГС у серопозитивных детей в этой группе. Также отсутствовали случаи активной ВГС-инфекции среди детей в возрасте 1–9 лет. Во всех остальных возрастных группах зарегистрированы случаи текущей ВГС-инфекции.
В табл. 2 приведены показатели распространенности текущей ВГС-инфекции среди обследованных лиц, объединенных в более крупные возрастные когорты с целью уменьшения ДИ расчетного показателя.
Наиболее высокую распространенность текущей ВГС-инфекции наблюдали в группе 40–49 лет – 5,2% (6/116), что было достоверно выше, чем среди детей и подростков в возрасте до 19 лет включительно (p < 0,01), однако не отличалось достоверно от аналогичных показателей в других группах взрослого населения. Средний показатель распространенности ВГС-инфекции среди населения Калининградской области старше 20 лет составил 3,1% (17/548; 95% ДИ 1,9–5,0), что достоверно превышает показатель среди детей и подростков в возрасте до 19 лет включительно (p < 0,05).
 Очевидно, что в Калининградской области жители старше 19 лет входят в группу повышенного риска наличия ВГС-инфекции.
Очевидно, что в Калининградской области жители старше 19 лет входят в группу повышенного риска наличия ВГС-инфекции.
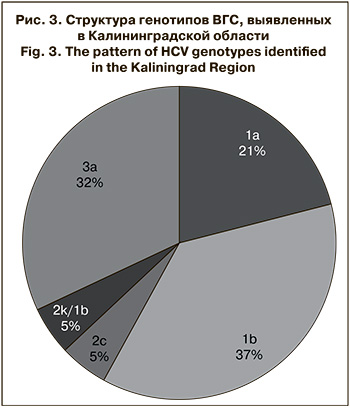
При изучении структуры генотипов ВГС, циркулирующих в Калининградской области (рис. 3), помимо широко распространенных в Российской Федерации 1b и 3а, в 21% случаев (4/19) был выявлен генотип 1а, редко встречающийся на территории страны, а также единичные случаи инфекции, вызванной генотипом 2с и рекомбинантной формой 2k/1b.
Анализ возможных факторов риска инфицирования ВГВ и ВГС (наличие в анамнезе операций, переливаний крови, употребления инъекционных наркотиков, татуировок, пирсинга) на основе анкетных данных выявил их только у 4 инфицированных ВГС лиц, при этом в 3 случаях основным фактором риска являлось инъекционное введение наркотиков.
Результаты выявления факторов риска инфицирования во всех возрастных группах условно здорового населения Калининградской области в целом и по каждому фактору в отдельности представлены на рис. 4 и в табл. 3.
Доля лиц в обследованной когорте, имеющих в анамнезе факторы риска инфицирования ВГВ и ВГС, резко увеличивается, начиная с 15–19 лет (37,5% против 3,1–8,9% в более младших возрастных группах; p < 0,05) и остается высокой в более старших возрастных группах (28,4–39,5%; различия между группами не достоверны, p > 0,05).
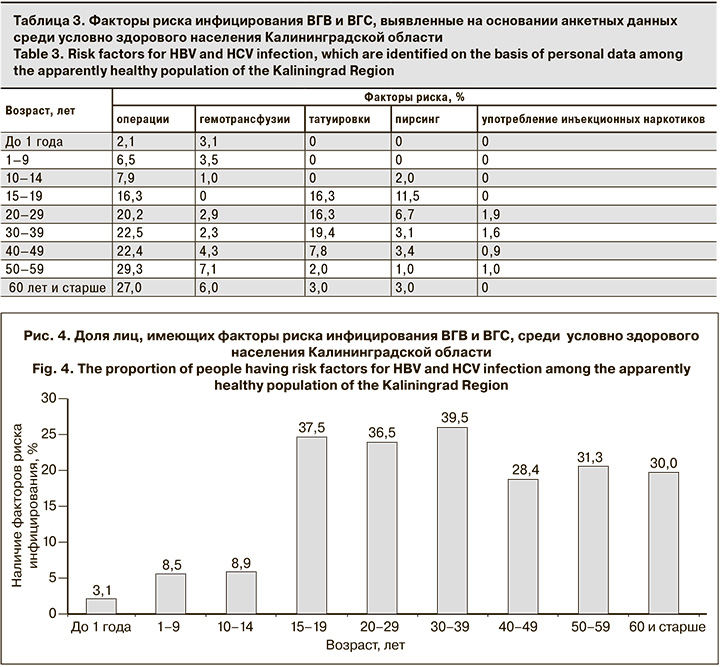
Наиболее частым фактором риска инфицирования ВГВ и ВГС условно здорового населения региона является наличие операций в анамнезе: среди лиц старше 20 лет в зависимости от возраста показатель составляет 20,2–29,3%. Вторым по распространенности фактором среди лиц в возрасте от 20 до 49 лет является наличие татуировок (7,8–19,4%). Среди молодежи (15–29 лет) в 6,7–1,5% случаев отмечено наличие пирсинга. Случаи употребления инъекционных наркотиков зарегистрированы в среднем у 0,57% (6/1051) участников исследования в возрасте от 20 до 59 лет.
Обсуждение
Одной из наиболее значимых трудностей в борьбе с ГВ и ГС является их невыявленность у значительной доли инфицированных, которые, с одной стороны, не зная о своем статусе, не получают необходимой противовирусной терапии, с другой – остаются потенциальным источником инфекции. Кроме того, отсутствие достоверных сведений о нагрузке этих инфекций на популяцию делают невозможным адекватное планирование мер по искоренению вирусных гепатитов как угрозы здравоохранению, запланированному ВОЗ к 2030 г. [2]. В настоящее время эпидемия ГВ и ГС вышла из групп риска в общую популяцию, поэтому ВОЗ рекомендует для оценки их распространенности проводить сероэпидемиологические исследования не только в группах риска, но и среди условно здорового населения для оценки наиболее пораженных возрастных категорий [4]. Применение такого подхода в США позволило установить, что большинство случаев ГС приходится на группу лиц, рожденных между 1945 и 1965 г., и рекомендовать включение этой возрастной когорты в скрининговые программы [5].
Региональные особенности эпидемического процесса могут приводить к тому, что возрастные группы повышенного риска инфицирования ГВ и/или ГС на территории РФ могут быть неодинаковыми на разных территориях. Ранее мы показали, что лица старше 60 лет являются такой группой повышенного риска наличия невыявленной ВГС-инфекции в Якутии [6] и Белгородской области [7]. Результаты проведенного исследования показали, что в Калининградской области все взрослое население можно отнести к группе повышенного риска наличия ВГС-инфекции, однако пиковые показатели были отмечены в группе 40–49 лет. Еще одной отличительной особенностью Калининградской области оказалась широкая распространенность ВГС генотипа 1а, который относительно редко встречается на территории РФ, но широко распространен в странах Евросоюза [8]. Очевидно, значительная доля случаев инфекции, вызванной этим генотипом, является результатом завоза в регион из европейских стран. Для Калининградской области характерна и относительно невысокая распространенность текущей ВГВ-инфекции при широкой распространенности ВГС. Тем не менее результаты выявления анти-НВс, сохраняющихся, как правило, пожизненно после перенесенной инфекции [9], указывают на интенсивную циркуляцию ВГВ в большинстве обследованных возрастных групп условно здорового населения региона. Отсутствие текущей инфекции, подтвержденной выявлением HBsAg, среди позитивных по анти-НВс лиц, вероятно, связано с невысокой частотой хронизации инфекции. А это указывает на то, что встреча с ВГВ происходит преимущественно не в младенчестве, когда риск хронизации инфекции максимален [10], а в более старшем возрасте. Выявленная в данном исследовании возрастная структура анти-НВс также свидетельствует, что встреча с ВГВ происходит, как правило, после достижения возраста 1 года, то есть не в результате вертикальной передачи вируса. По-видимому, именно различия в частоте хронизации ГВ и ГС у взрослых лиц являются причиной столь выраженных различий в частоте выявления текущей инфекции, вызванной этими вирусами. Кроме того, у части лиц с анти-НВс может иметь место скрытая HBsAg-негативная инфекция, связанная с сохранением репликации ВГВ на низком уровне. В проведенном исследовании мы не определяли ДНК ВГВ у лиц с анти-НВс, однако согласно данным литературы, частота скрытой ВГВ-инфекции среди позитивных по анти-НВс лиц может составлять до 11% [11].
Результаты анализа показали, что доля лиц с парентеральными факторами риска резко возрастает, начиная с 15–19 лет. Наличие операций в анамнезе – ведущий фактор риска во всех возрастных группах старше 14 лет, при этом второй частоте фактор риска – татуировки – характерен для лиц в возрасте от 15 до 39 лет. Следует отметить ограниченную значимость анализа факторов риска по анкетным данным, так как только у незначительной части выявленных инфицированных лиц эти факторы были указаны в анкетах.
Заключение
В целом для Калининградской области в настоящее время характерна высокая распространенность ВГС-инфекции в общей популяции при относительно невысокой распространенности ВГВ. Лица старше 19 лет являются когортой повышенного риска наличия ВГС-инфекции: среди них этот показатель составляет 3,1%. Для Калининградской области характерно генотипическое разнообразие ВГС, наиболее часто встречаются генотипы 1а, 1b и 3а. Это в значительной степени отличает Калининградскую область от остальных регионов Российской Федерации, где генотип 1а встречается редко. У большинства инфицированных в эпидемиологическом анамнезе отсутствуют сведения о факторах риска инфицирования ВГС и ВГВ, поэтому представляется нецелесообразным сосредотачивать скрининг на ВГС и ВГВ исключительно в группах повышенного риска инфицирования этими вирусами. По-видимому, скрининг на ВГС-инфекцию целесообразно проводить для всего взрослого населения региона.
* * *
Исследование выполнено в рамках Государственного задания по теме «Оценка нагрузки инфекции вируса гепатита С на популяцию и связанной с ней смертности в Российской Федерации с последующим прогностическим моделированием эпидемиологической ситуации в зависимости от охвата противовирусной терапией больных хроническим гепатитом С».



