Начавшаяся на рубеже 2019–2020 гг. пандемия новой коронавирусной инфекции не только стала серьезным испытанием для здравоохранения, но и нанесла серьезный экономический ущерб большинству, если не всем, государствам планеты. История первой в XXI веке пандемии началась 31 декабря 2019 г., когда на морском рынке в г. Ухань (КНР) был выявлены несколько очагов странной пневмонии, напоминавшей SARS 2003 г. [1, 2]. Заболевание быстро распространилось в результате активной миграции населения, преимущественно туристов, в другие государства Юго-Восточной Азии, а затем и Европы [3–5]. Так, в течение января–февраля 2020 г. в одном только г. Ухань было выявлено более 49 000 больных [6]. Столь стремительное распространение побудило ВОЗ объявить пандемию новой инфекции, получившей название «коронавирусная болезнь 2019 г.» (coronavirus disease 2019 – COVID-19), при этом вирус назвали SARS-CoV-2 [7].
В настоящее время интенсивность пандемии демонстрирует тренд к некоторому снижению, но должно еще пройти достаточно времени, пока заболеваемость окончательно прекратиться, если такое вообще возможно в обозримом будущем. По состоянию на 13.12.2020 в мире заражено 71 912 367 человек, из которых 50 306 489 выздоровели и 830 419 умерли. В России на эту же дату выявлено 2 653 928 зараженных, из которых 2 106 235 выздоровели и 6945 умерли. Наивысший уровень заболеваемости отмечен в Москве (692 210 человек), Санкт-Петербурге (174 486 человек) и Московской области (127 821 человек). Приведенные данные вполне согласуются с высокой плотностью населения на этих территориях.
Белгородская область по уровню заболеваемости расположилась на 44-м месте среди регионов России в рейтинге заболеваемости COVID-19 (18 522 случая заражения). Первый случай COVID-19 в области был выявлен 8 марта 2020 г. Пациентка перед заболеванием посещала Испанию. В течение следующих 4 нед. были выявлены единичные случаи заражения, но начиная с 16-й недели 2020 г. наблюдался практически экспоненциальный рост, продолжавшийся 8 нед. (см. рисунок). Максимальный показатель заболеваемости (37,1 на 100 тыс. населения) был зафиксирован на 22-й неделе 2020 г., после чего рост сменился стабилизацией на уровне 34 на 100 тыс. населения, а с 22-й недели началось медленное снижение с последующей повторной стабилизацией на уровне 20–22 на 100 тыс. населения.
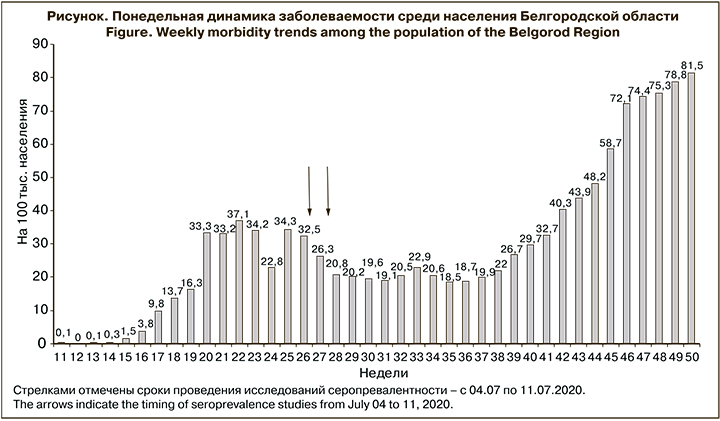
Пока нет удовлетворительного объяснения столь специфичной динамики инфекционного процесса. Возможно, это связано с относительно низкой плотностью населения области, составляющей всего 57,09 чел/ км2, что существенно ниже, чем на других территориях европейской части России. В целом заболеваемость в Белгородской области можно охарактеризовать как довольно низкую, что, как будет показано ниже, связано и с такой же невысокой серопревалентностью.
Независимо от этиологии инфекционное заболевание возникает, развивается и угасает в зависимости от доли восприимчивых индивидуумов, вовлеченных в эпидемический процесс. На начальном этапе любой новой инфекции, в том числе COVID-19, число восприимчивых лиц максимально, а реактивных, наоборот, минимально. По мере развития эпидемического процесса процент восприимчивых лиц уменьшается, а резистентных – возрастает. Параллельно с этим снижается уровень заболеваемости, а когда доля иммунорезистетных субъектов в популяции достигает 60–70%, инфекционный процесс самопроизвольно угасает [8, 9]. Существует, по меньшей мере, 3 возможности достижения порогового значения иммунорезистетности: спонтанное увеличение числа лиц, перенесших инфекционное заболевание; специфическая иммунизация не менее 70% субъектов, вовлеченных в эпидемический процесс, и контролируемое увеличение числа переболевших с помощью физических и фармакологических методов. Первый случай имеет высокий уровень риска летальных исходов и постинфекционных осложнений, особенно характерных при COVID-19 [10, 11]. Активная вакцинация является золотым стандартом профилактики при заболеваниях, сопровождающихся долгосрочным напряженным иммунитетом. Определенным этапом контроля текущей ситуации и прогнозирования дальнейшего развития COVID-19 может стать оценка серопревалентности населения к SARS-CoV-2.
Целью исследования было определение уровня и структуры популяционного иммунитета к SARS-CoV-2 среди населения Белгородской области на фоне пандемии COVID-19.
Материалы и методы
Работа проводилась по единой методике оценки популяционного иммунитета к SARS-CoV-2 у населения Российской Федерации, разработанной Роспотребнадзором при участии Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера (далее – НИИЭМ им. Пастера) с учетом протокола, рекомендованного ВОЗ [12]. Исследование одобрено локальным этическим комитетом НИИЭМ им. Пастера. Перед началом исследования все участники или их юридические представители были ознакомлены с целью, методикой исследования и подписали информированное согласие.
Отбор добровольцев для исследования проводили методом анкетирования и рандомизации. Критерием исключения была активная инфекция COVID-19 в момент анкетирования. Объем выборки определяли по формуле:
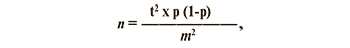
где n – объем выборки;
t – уровень точности (для 95% ДИ t = 1,96);
p – оценочная распространенность изучаемого явления (в данном случае при 50% = 0,5);
m – допустимая ошибка – 5% [13].
Все возрастные группы участников исследования были сопоставимы по численности и включали 383–458 человек. Мужчин было 680 (24,7%), женщин – 2073 (75,3%), то есть участие женщин в исследовании было в 3 раза активнее.
Доля переболевших COVID-19 с диагнозом, установленным в лечебно-профилактическом учреждении, составила 1,4% (39 человек), а доля добровольцев, имевших признаки ОРЗ в день обследования, – 1,6% (46 человек). Численность участников из каждого района Белгородской области находилась в диапазоне 16–1070 человек и была пропорциональна численности населения районов.
Отбор проб и последующее определение специфических IgG-антител осуществляли иммуноферментным методом по описанной ранее методике [12]. Результаты учитывали качественным методом и считали положительными при превышении уровня cut off.
Для статистической обработки результатов использовали методы вариационной статистики с помощью статистического пакета Excel. Связь между уровнями заболеваемости и серопревалентности рассчитывали по методу Пирсона. Для оценки достоверности различий сравниваемых показателей использовали уровень вероятности p < 0,05.
Результаты
 Возрастное и географическое распределение серопревалентности среди населения
Возрастное и географическое распределение серопревалентности среди населения
Серопревалентность среди жителей Белгородской области (табл. 1) в целом составила 8,7 ± 0,5%, а по возрастным группам была в диапазоне от 6,6 ± 1,8 до 14,5 ± 4,5%. Максимальный уровень серопревалентности (14,5 ± 4,5%) выявлен среди детей в возрасте 1–6 лет, минимальный (6,6 ± 1,8%) – в возрастной группе 14–17 лет. Серопревалентность не имела гендерных различий и составила у мужчин – 7,8 ± 1,0%, у женщин – 8,7 ± 0,6%.
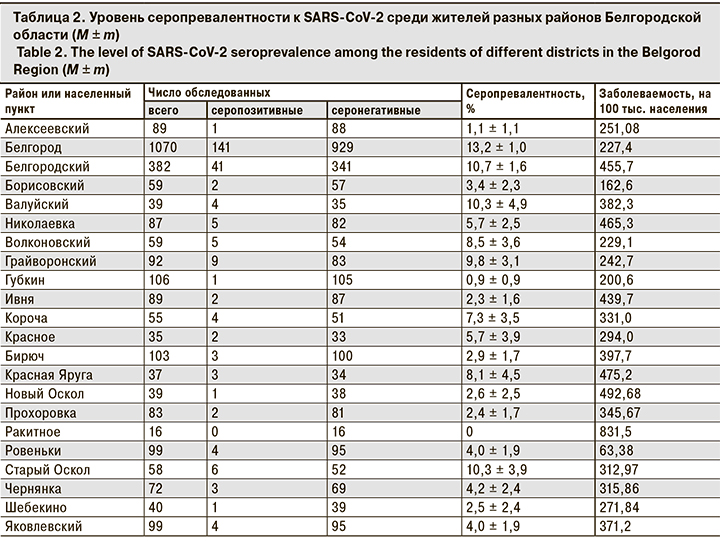
По районам Белгородской области серопревалентность находилась в диапазоне от 1,1 ± 1,1% (Алексеевский р-н) до 13,2 ± 1,0% (Белгород). Низкий уровень серопревалентности был установлен также в пос. Ивня (2,3 ± 1,6%), высокий – в муниципальном Белгородском районе (10,7 ± 1,6%) (табл. 2).
В целом обращает на себя внимание высокая вариабельность значений заболеваемости и серопревалентности. Так, в Белгородском районе и пос. Ивня заболеваемость сопоставима – 455,7 и 439,7 соответственно, а серопревалентность различается в 4,7 раза – 10,7 ± 1,6 и 2,3 ± 1,6%, соответственно. Различия можно объяснить только бóльшей численностью населения в Белгородском районе. Несмотря на несколько обескураживающие данные, мы попытались оценить уровень корреляции между показателями заболеваемости и серопревалентности по районам Белгородской области. При этом коэффициент корреляции (r) составил -0,181. При проверке по t-критерию Стьюдента не выявлено достоверной корреляционной связи между сравниваемыми показателями. Значение r составило 0,8 что ниже минимального порога при p = 0,1.
Уровень серопозитивности у лиц, переболевших или имевших контакт с больными COVID-19
Среди лиц, перенесших в анамнезе COVID-19, доля серопозитивных составила 23,1 ± 6,7%, а при отсутствии данных о перенесенной инфекции – 8,3 ± 0,5%. Представляется, что уровень сероконверсии у реконвалесцентов неоправданно низок. Однако мы не располагали данными о сроке, прошедшем со времени клинического и вирусологического выздоровления и датой взятия крови на определение специфических IgG. Показано, что IgG обнаруживаются, начина с 5–12-го дня, и могут снижаться со 2-го месяца после клинического выздоровления [14, 15]. Считается, что носителями анти-SARS-CoV-2 иммунитета являются долгоживущие плазматические клетки и В-лимфоциты памяти [15].
Сходная с реконвалесцентами реакция отмечена при определении антител к SARS-CoV-2 у лиц с позитивными результатами ПЦР. В группе с положительной реакцией на РНК вируса доля серопозитивных составила 21,7 ± 8,6%, а в группе с отрицательной ПЦР – в 1,8 раза ниже (12,1 ± 3,0%).
Важную роль в распространении COVID-19 может играть контактная передача. Существуют контакты бытовые (дома или при посещении объектов торговли, развлекательных учреждений, на транспорте) и профессиональные, особенно частые у медицинских и торговых работников, водителей и кондукторов общественного транспорта, сотрудников дошкольных и школьных учреждений. Решающим условием снижения контактной передачи инфекции может быть строгое выполнение требований противоэпидемической защиты.
В группе добровольцев, имевших контакты с больными COVID-19, доля серопозитивных составила 13,5 ± 2,6% а среди тех, кто не имел подобных контактов, – только 8,4 ± 0,5% (p < 0,05). Полученные результаты подтвердили гипотезу о значимости контактов с носителями SARS-CoV-2 для инфицирования окружающих и последующего формирования у них серопревалентности, нередко при отсутствии каких-либо клинических проявлений инфекции.
94,4% добровольцев не имели признаков ОРЗ, доля серопозитивных среди них составила 8,7 ± 0,5%, не отличаясь от средней по всей популяции. В подгруппе лиц с признаками ОРЗ (n = 46) доля серопозитивных составила 10,9 ± 4,6%, что не значимо больше среднепопуляционного значения (8,7 ± 0,5%). Эти данные могут косвенно свидетельствовать о том, что случаи ОРЗ в Белгородской области, скорее всего, не были связаны с COVID-19.
Оценка доли бессимптомных форм
Бессимптомное течение является характерным признаком COVID-19 и, как считается, может служить важным фактором трансмиссии вируса [16]. В этом смысле определение доли бессимптомных форм в популяции имеет существенное значение в плане распространения инфекции в непораженной популяции и может в значительной мере скорректировать спектр и направление противоэпидемических мероприятий.
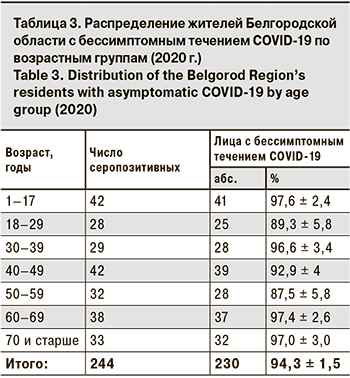 Для расчета доли бессимптомных форм инфекции среди серопозитивных лиц определяли долю тех, у кого отсутствует хотя бы 1 из признаков: диагноз COVID-19, положительный результат ПЦР, признаки ОРЗ. Среди жителей Белгородской области этот показатель в целом составил 94,3 ± 1,5%, довольно равномерно распределяясь по возрастным группам (табл. 3). Снижение серопозитивности в группах 18–29 и 50–59 лет было небольшим и недостоверным. Высокий уровень серопревалентности среди лиц с бессимптомным течением инфекции, вероятно, является позитивным признаком, свидетельствующим о значительном уровне защищенности у этой категории. Вопрос только в природе циркулирующих антител и их вкладе и иммунорезистентность [15].
Для расчета доли бессимптомных форм инфекции среди серопозитивных лиц определяли долю тех, у кого отсутствует хотя бы 1 из признаков: диагноз COVID-19, положительный результат ПЦР, признаки ОРЗ. Среди жителей Белгородской области этот показатель в целом составил 94,3 ± 1,5%, довольно равномерно распределяясь по возрастным группам (табл. 3). Снижение серопозитивности в группах 18–29 и 50–59 лет было небольшим и недостоверным. Высокий уровень серопревалентности среди лиц с бессимптомным течением инфекции, вероятно, является позитивным признаком, свидетельствующим о значительном уровне защищенности у этой категории. Вопрос только в природе циркулирующих антител и их вкладе и иммунорезистентность [15].
Отсутствие типичных клинических симптомов (лихорадки, кашля, слабости и т. д.) еще не свидетельствует об отсутствии SARS-CoV-2. Описаны случаи обнаружения вируса на компьютерной томограмме легких у лиц, не имевших каких-либо проявлений заболевания, кроме поражений по типу «матового стекла» [17]. В любом случае пациенты с бессимптомными формами заболевания нуждаются в дальнейшем обследовании и наблюдении с позиции вероятности трансмиссии вируса и катамнеза самого больного.
Обсуждение
Результаты исследования показали, что уровень серопревалентности среди участников исследования варьировал в пределах от 7,2 ± 1,2 до 14,5 ± 4,5%. Как и в других регионах РФ (Санкт-Петербурге и Ленинградской области) [12, 18], наиболее высокая серопревалентность была отмечена среди детей. Можно предположить, что определенное влияние на становление антительного коронавирусного пейзажа у детей оказывают перекрестные антитела, появляющиеся в результате ОРВИ, вызванных другими типами β-коронавирусов, имеющих общие детерминанты в нуклеокапсидных белках [19], либо менее строгое, чем требуется, следование правилам противоэпидемического режима. В остальных возрастных группах существенных отличий по уровню серопревалентности не отмечено. При этом в целом уровень коллективного иммунитета среди добровольцев Белгородской области на момент обследования можно характеризовать как низкий, несмотря на то что кровь на серопревалентность брали в начальной фазе нисходящего тренда заболеваемости после 4-недельного периода стабилизации числа зараженных. Довольно неожиданной оказалась низкая доля серопревалентных среди реконвалесцентов после перенесенной COVID-19 – 23,1%. Обычно частота выявления антител к SARS-CoV-2 в этой группе достигает 80% и более [20]. К сожалению, авторы не располагали информацией о сроке взятия крови на исследование относительно периода заболевания. Отсутствие этих данных не позволяет корректно оценить динамику серопревалентности у реконвалесцентов, поскольку она существенно зависит от времени, прошедшего между заболеванием и взятием проб крови для исследования [14]. Среди носителей РНК вируса, имеющих положительный результат ПЦР, доля серопревалентных составила 21,7%, что в 1,7 раза выше, чем среди лиц с отрицательным результатом ПЦР. Среди участников исследования, имевших контакт с больными COVID-19, доля серопозитивных возрастала в 1,6 раза по сравнению с лицами, не имевшими подобного контакта – 13,5% против 8,4%.
Что касается бессимптомных форм, обращает на себя внимание высокий уровень серопревалентности (94,3%). Существуют 2 вероятности, лежащие в основе этого явления: с одной стороны, это характерный признак SARS-CoV-2 [21], с другой стороны нельзя исключать инаппарантной сероконверсии, при которой даже в отсутствие манифестной формы инфекции может развиваться гуморальный иммунный ответ [12. 17].
Выводы
1. Коллективный иммунитет к SARS-CoV-2 совокупного населения Белгородской области составил 8,7%.
2. Максимальный уровень серопревалентности (14,5%) был выявлен среди детей в возрасте 1–6 лет.
3. При наличии контактов с больными COVID-19 риск серопозитивности увеличивается в 1,6 раза.
4. После перенесенной инфекции COVID-19 антитела выявляли в 23,1% случаев.
5. У лиц с позитивным результатом ПЦР-анализа, полученным ранее, антитела обнаруживали в 21,7% случаев.
6. Доля бессимптомных форм инфекции среди серопозитивных жителей Белгородской области составила 94,3%.



