Реализация расширенной программы иммунизации (с 1974 г.) доказала несомненную важность вакцинопрофилактики как наиболее эффективного и доступного средства борьбы с инфекционной патологией для сохранения здоровья населения за счет снижения заболеваемости и смертности, прежде всего, среди детей [1]. Глобальная ликвидация оспы и региональная ликвидация полиомиелита являются убедительными доказательствами результативности проводимой прививочной работы.
Согласно рекомендациям ВОЗ, для большинства инфекций, управляемых с помощью вакцинопрофилактики (далее – управляемых инфекций), охват населения профилактическими прививками, являющийся одним из ключевых показателей качества ее проведения, должен составлять не менее 95% среди детского населения и 90% – среди взрослого. По данным официальной статистики, в России в отношении большинства управляемых инфекций указанные значения были достигнуты и поддерживаются на необходимом уровне до настоящего времени [2].
Вакцинация против кори в масштабах страны осуществляется с 1967 г. (с 1987 г. – двукратная). Вакцинация против эпидемического паротита (ЭП) была введена в 1983 г. (с 1987 г. – двукратная) и с 2000 г. – двукратная вакцинация против краснухи.
В соответствии с действующим национальным календарем профилактических прививок, введение вакцины против кори, краснухи и ЭП проводится детям в возрасте 12 мес. и 6 лет. Все взрослые в возрасте до 35 лет должны быть привиты против кори, а женщины до 25 лет должны быть вакцинированы против краснухи1.
Указанные инфекции рассматриваются эпидемиологами в комплексе ввиду наличия у них ряда общих черт (вирусная природа возбудителя, сходные контагиозность и механизм передачи, унифицированная система санитарно-эпидемиологического надзора; для их профилактики используют живые аттенуированные ассоциированные вакцины, вводимые в одинаковые сроки) [3, 4].
На фоне многократного снижения заболеваемости и смертности от кори, краснухи и ЭП возможность их ликвидации в глобальном масштабе была научно обоснована. Предполагаемые сроки достижения целей Программы ВОЗ по элиминации указанных инфекций в 5 регионах мира неоднократно переносились с 2010 г. на более поздние из-за осложнения эпидемической ситуации по кори в Европейском и Североамериканском регионах, в странах СНГ и России (в настоящее время действует Программа по элиминации кори и краснухи к 2020 г.2). На территории Российской Федерации на протяжении последних 8 лет регистрировались очаги кори, в том числе в организованных коллективах: среди военнослужащих, студентов, медицинских работников [5–7]. По данным ВОЗ [4], за 6 мес. 2018 г. в Европейском регионе было зафиксировано 41 000 лабораторно подтвержденных случаев кори, имели место и летальные исходы3; в России было зарегистрировано 1717 случаев кори (показатель заболеваемости составил 1,17 на 100 тыс. населения) [8].
Эпидемическая ситуация по ЭП также является неустойчивой: после многолетнего снижения заболеваемости под влиянием проводимой в стране иммунопрофилактики в 2016 г. показатель заболеваемости вырос в 5,85 раза по сравнению с 2015 г. (1108 случаев, из них 630 – у детей до 17 лет) и составил 0,75 на 100 тыс. населения [9]. В 2017 г. было зарегистрировано 4443 случая (из них 2114 – у детей до 17 лет), а за 6 мес. 2018 г. – 1573 случая (из них 656 – у детей до 17 лет) [8].
Эпидемическая ситуация в отношении краснухи в настоящее время является благополучной. По данным официальной статистики, показатель заболеваемости за последние 7 лет не превышает рекомендуемый ВОЗ для элиминации заболевания на территории страны (менее 1 на 100 тыс. населения) [8]. Случаи врожденной краснухи не регистрируются.
Массовая вакцинация населения направлена на формирование коллективного (популяционного) иммунитета как основного фактора, препятствующего возникновению и распространению соответствующих заболеваний даже в случае заноса их возбудителей на территорию страны. Популяционный иммунитет – это состояние приобретенной специфической защищенности населения, слагающееся из иммунитета индивидуумов, входящих в данную популяцию, сформированного за счет перенесенной инфекции или профилактической вакцинации [10]. Для его оценки используют лабораторные методы серологического контроля, позволяющие рассчитать долю восприимчивых (неиммунных, серонегативных) и защищенных (иммунных, серопозитивных) лиц к управляемым инфекциям [3]. Деление группы обследованных на серонегативных и серопозитивных осуществляется на основании соответствия/несоответствия результатов индивидуального серологического обследования пороговым уровням, указанным производителями тест-систем, используемых для лабораторной диагностики.
В России для оценки коллективного иммунитета нормативно установлено проведение серологического мониторинга4 среди достоверно привитых лиц следующих индикаторных возрастных групп: 3–4 года, 9–10 лет, 16–17 лет, 25–29 лет, 30–35 лет, 40 лет и старше (в этой возрастной группе оценка восприимчивости проводится без учета данных о вакцинации). При этом в серологическое обследование не включены лица, по каким-либо причинам не получившие вакцину, получившие ее однократно и переболевшие корью, краснухой или ЭП ранее.
При анализе состояния коллективного иммунитета используют также термин «иммунологическая структура населения», в процессе изучения которой распределение восприимчивых и защищенных лиц в коллективе оценивается без учета их вакцинального статуса во всех возрастных группах от рождения до старческого возраста. Использование такого подхода дает возможность получить более достоверные данные о восприимчивости населения к управляемым инфекциям, эпидемиологических рисках на конкретной территории в заданное время, уровне и динамике изменения иммунитета в группах риска [3].
В работах отечественных авторов имеются данные о восприимчивости отдельных групп населения к управляемым инфекциям [11–14]. Однако в связи с очевидными трудностями сбора донорского материала от детей работы, посвященные изучению иммунологической структуры населения в целом, встречаются в научной литературе достаточно редко.
Цель исследования – оценка иммунологической структуры населения Москвы в отношении вирусов кори, краснухи и ЭП в период элиминации этих инфекций.
Материалы и методы
В исследовании использован 1951 образец сыворотки крови от условно здоровых лиц разного возраста (1072 взрослых в возрасте от 18 до 55 лет и 879 детей от рождения до 17 лет) и пола (43,7% женщин и 56,3% мужчин) из коллекции отдела эпидемиологии ФГБУ «Национальный исследовательский центр эпидемитологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России. Сывороточный материал был собран в период с 2016 по 2017 г., случайным образом сформирована однородная репрезентативная выборка (сбор образцов для исследования осуществляли в 5 медицинских организациях различного профиля, расположенных в разных административных округах Москвы). Критериями включения лиц в исследование было отсутствие какого-либо заболевания в остром периоде и проживание на территории Москвы (данные о прививочном анамнезе обследованных отсутствовали).
Изучение напряженности иммунитета (по наличию IgG) к вирусам кори, краснухи и ЭП в сыворотках крови осуществляли методом твердофазного непрямого иммуноферментного анализа (ИФА) с использованием отечественных тест-систем производства ЗАО «Вектор-Бест» (п. Кольцово, Новосибирская область) в соответствии с инструкциями по применению.
Статистическую обработку данных осуществляли с помощью программ Microsoft Excel и STATISTICA 6.0. Уровни значимости альфа и бета установлены равными 5%, то есть значение р < 0,05, рассматривается как значимое, а анализ имел 95%-ю мощность. Согласно проведенным статистическим расчетам (опция «оценка мощности критериев и расчет объема выборки» в ППП STATISTICA 6.0) установлено, что размер репрезентативной выборки должен составлять не менее 1100 образцов, минимальная численность возрастных групп сравнения – 100 образцов.
Для полученных показателей было рассчитано среднее значение (m) и 95%-й доверительный интервал [ДИ], который вычисляли по методу Клоппера–Пирсона (точный метод). Для проверки достоверности различий между группами обследованных использовали t-критерий Стьюдента.
Результаты
Из таблицы видно, что иммунная прослойка среди детского населения в отношении кори, краснухи и ЭП была достоверно меньше (при р < 0,05) соответствующих показателей среди взрослого населения.
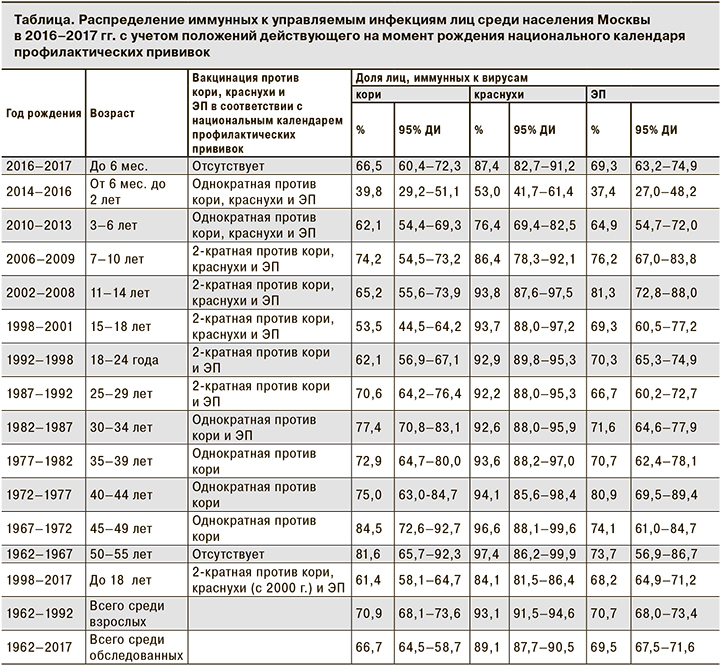
Установлено, что дети в возрасте от 6 мес. до 2 лет наиболее уязвимы в отношении управляемых инфекций по сравнению с прочими возрастными группами, так как иммунная прослойка среди них была наименьшей. Восприимчивость к вирусам кори, краснухи и ЭП у детей до 6 мес. (66,5, 87,4 и 69,3% соответственно) и взрослых в группе от 25 до 44 лет (детородный возраст) была сопоставима (69,4, 92,9 и 70,5% соответственно).
Среди детей максимальная доля иммунных к вирусу кори выявлена в возрастной группе 7–10 лет, а к вирусам краснухи и ЭП – в группе 11–14 лет. При этом по мере увеличения возраста (в группе детей 15–17 лет) увеличивалась и доля серонегативных к кори и ЭП при сохранении высокой (более 93,0%) доли серопозитивных к вирусу краснухи.
Среди взрослого населения Москвы иммунная прослойка в отношении вируса кори варьировала в пределах от 61,4 до 84,5%, вируса краснухи – от 84,1 до 97,4%, вируса ЭП – от 66,7 до 80,9%.
С позиции статистической значимости различий по t-критерию при р < 0,05 все возрастные группы обследованных можно ранжировать в зависимости от уровня иммунной прослойки в отношении вируса кори:
- I – наиболее восприимчивые, среди которых доля серопозитивных не превышала 62,1% (дети и молодые люди до 24 лет);
- II – лица, среди которых доля серопозитивных составляла 70,6–77,4% (возрастная группа 25–44 года);
- III – лица, наиболее защищенные в отношении кори, среди которых доля иммунных составила 81,6–84,5% (возрастная группа 45–55 лет).
Видно, что по мере увеличения возраста обследованных доля серопозитивных к кори лиц среди них увеличивается. Эта тенденция в меньшей степени прослеживается в отношении вирусов краснухи и ЭП: статистически значимые различия имеются только между группами детей и взрослых (р < 0,05), а среди разных возрастных групп взрослых отсутствуют (р > 0,05). Из таблицы видно, что доля иммунных к вирусам кори (более 81,6%) и краснухи (более 96,6%) максимальна в возрастной группе 50–55 лет (среди лиц, родившихся до введения массовой вакцинации), а также в группе 45–49 лет (среди лиц, родившихся после введения однократной вакцинации против кори) (р < 0,05).
В отношении ЭП установлено, что доля серопозитивных была относительно стабильной во всех возрастных группах и колебалась в небольших пределах: от 68,2% среди детей до 18 лет до 74,1% среди взрослых в возрасте 45–49 лет. Статистически значимых различий между группами лиц, родившихся после введения вакцинации против ЭП (1983 г.) и в период естественного эпидемического процесса этой инфекции, выявить не удалось. Исключением является возрастная группа 40–44 года, где доля иммунных к вирусу ЭП лиц была значительно больше по сравнению с прочими и составила 80,4% (р < 0,05).
Обсуждение
Анализируя полученные результаты, можно отметить, что иммунная прослойка в отношении управляемых инфекций (кори, краснухи, ЭП) варьировала в зависимости от возраста обследованных. При этом дети и молодые люди (в среднем до 35 лет) были более восприимчивы по сравнению со старшими возрастными группами, что согласуется с данными отечественных и зарубежных авторов [14–16] и может свидетельствовать о дефектах реализации массовой вакцинопрофилактики.
Доли иммунных к управляемым инфекциям среди детей раннего возраста (до 6 мес.) и в группе взрослых детородного возраста не имели статистически значимых различий (р > 0,05), что может свидетельствовать, на наш взгляд, об известной степени достоверности полученных результатов в целом, так как известно, что напряженность естественного пассивного иммунитета детей указанной возрастной группы определятся материнскими антителами памяти (передаваемыми трансплацентарно и исчезающими к годовалому возрасту) [11, 16]. Полученные результаты согласуются с данными других авторов. Так, Н.Т. Тихонова и соавт. [11] при изучении напряженности иммунитета у новорожденных в 2017 г. выявили 78,3 ± 2,7% иммунных к вирусу кори и 83,6 ± 2,4% – к вирусу краснухи. При этом сравнительно небольшой удельный вес детей до 6 мес. в структуре детской заболеваемости корью, краснухой и ЭП связан с их низкой социальной активностью, поэтому основным методом профилактики заболеваемости детей в возрасте до 1 года является вакцинация женщин детородного возраста.
Значительная доля восприимчивых к управляемым инфекциям среди детей в возрасте от 6 мес. до 2 лет, на наш взгляд, является следствием разных причин.
Во-первых, эта возрастная группа включает детей от 6 мес. до 1 года, утративших материнские антитела памяти, но не вакцинированных против кори, краснухи и ЭП по возрасту. Во-вторых, среди детей старше 1 года (введение вакцины которым предусмотрено национальным календарем профилактических прививок в возрасте 12 мес.) в настоящее время все чаще встречаются отказы и нарушения сроков введения вакцин, что негативно влияет на формирование иммунной прослойки в этой возрастной группе [17].
Наличие значительной доли восприимчивых к управляемым инфекциям в возрастной группе до 2 лет подтверждается структурой заболеваемости корью и ЭП. Так, по данным О.В. Цвиркун и соавт. [18], а также И.В. Михеевой [9], в структуре детской заболеваемости корью и ЭП основную долю составляют дети указанной группы, вовлекаемые пассивно в эпидемический процесс при контакте с больными взрослыми, среди которых и происходит интенсивное распространение инфекций. Таким образом, состояние восприимчивости взрослого населения значительно влияет на заболеваемость детей.
Полученные данные об уменьшении доли восприимчивых к управляемым инфекциям детей по мере увеличения их возраста являются вполне ожидаемыми, так как ревакцинация против кори, краснухи и ЭП проводится в возрасте 6 лет.
Причины различной восприимчивости к управляемым инфекциям среди детей старше 6 лет и взрослых (иммунная прослойка в отношении кори и ЭП варьировала в разных возрастных группах и была меньше 90%, тогда как аналогичный показатель в отношении краснухи был относительно стабилен и превышал 90%) было сложно установить в рамках данного исследования. Возможно, объяснением полученных результатов могут служить различия в иммунном ответе на антигенные компоненты вирусов кори, краснухи и ЭП соответствующих вакцин [19], а также в сроках введения вакцинации против этих инфекций в национальный календарь (вакцинация против краснухи была внесена в 2000 г., значительно позже, чем против кори и ЭП). Таким образом, можно ожидать, что в нашем исследовании только дети имеют постпрививочный противокраснушный иммунитет, а значительная иммунная прослойка среди взрослого населения обусловлена естественным течением эпидемического процесса (доля серопозитивных варьировала от 92,2% в возрастной группе 25–30 лет до 97,4% в группе 50–55 лет).
В исследовании H.F. Gidding и соавт. [15], проведенном в 2012–2013 гг. в Австралии, где история массовой вакцинации аналогична российской (вакцинация против кори была включена в национальный календарь профилактических прививок в 1968 г.), было установлено, что среди детей в возрасте от 10 до 19 лет доля иммунных к кори составила 70%, а в возрасте от 1 года до 9 лет варьировала от 77,3 до 86,8% и превышала значения, выявленные среди взрослых лиц. Мы выявили более узкую иммунную прослойку среди детского населения. Так, в возрастной группе до 9 лет защищенными в отношении кори были 63,3% [95% ДИ 59,3–67,2], а в группе 9– 18 лет – 57,2% [95% ДИ 51,2–63,0].
Снижение восприимчивости к управляемым инфекциям по мере увеличения возраста среди взрослого населения, по нашему мнению, связано с преобладанием в старших возрастных группах лиц с постинфекционным иммунитетом, более выраженным и стойким (пожизненным) по сравнению с поствакцинальным [19]. Так, в работах, посвященных иммунологической структуре населения в период 80–90-х годов5,6, иммунная прослойка в отношении кори и ЭП была достаточно обширной и сформировалась в значительной степени под воздействием естественного эпидемического процесса (количество восприимчивых варьировало в пределах 5–15%). При этом показатели заболеваемости были значительными (от 150 на 100 тыс. населения в 1980 г. до 4,5 на 100 тыс. населения в 1995 г.) и обусловлены были неиммунными детскими контингентами.
H.F. Gidding и соавт. [15] выявили более обширную, чем в нашем исследовании, долю иммунных к кори лиц среди взрослых при аналогичной динамике ее изменения в возрастных группах (от 73,1% в группе 20–24 года до 97,1% в группе 45–49 лет). При этом авторы статьи утверждали, что наличие среди обследованных 25% и более восприимчивых лиц является неблагоприятным признаком при охвате населения профилактическими прививками более 95% и требует корректировки прививочной работы.
Заключение
Анализ иммунологической структуры населения показал наличие значительной доли восприимчивых к кори и ЭП среди детей до 6 лет и молодых взрослых (в среднем до 35 лет), что диктует необходимость проведения дополнительных мероприятий по вакцинации среди этих контингентов. С учетом полученных данных в ближайшем будущем при взрослении неиммунных детей и увеличении числа восприимчивых лиц в старших возрастных группах возможен подъем заболеваемости управляемыми инфекциями при заносе их возбудителей на территорию страны.
Высокий уровень популяционного иммунитета среди населения Москвы (более 90% во всех возрастных группах взрослых) в отношении краснушной инфекции является мощным барьером на пути распространения инфекции в настоящее время, что подтверждается спорадическим уровнем заболеваемости.



