В условиях неблагополучной эпидемической обстановки, связанной с глобальными биологическими угрозами (СОVID-19), профилактика инфекций, связанных с оказанием медицинской помощи (ИСМП), занимает важное место в работе медицинских организаций (МО) и призвана обеспечить качество и безопасность лечения, снижение риска развития осложнений, в том числе вторичных бактериальных инфекций [1–4]. «Временные методические рекомендации “Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)” Версия 13.1 (17.11.2021)» и СП 3.1 3597-20 «Профилактика новой коронавирусной инфекции (СОVID-19)» предусматривают эпидемиологический мониторинг ИСМП и выполнение комплекса мер эпидемиологической безопасности на всех этапах оказания медицинской помощи.
Термином «ИСМП» обозначают целую группу инфекций, определяемых как любое клинически выраженное инфекционное заболевание, возникшее у пациента в результате оказания медицинской помощи во время госпитализации, в амбулаторно-поликлинических условиях или на дому, вне МО, а также у медицинских работников в силу осуществления профессиональной деятельности [5]. Современная доктрина госпитальной эпидемиологии предусматривает наличие в системе обеспечения качества оказания медицинской помощи междисциплинарного риск-ориентированного контроля распространения ИСМП, направленного на идентификацию, анализ и оценку, снижение рисков и преследующего цель по формированию приверженности персонала профилактике указанных инфекций [6, 7]. Значимость его многократно возрастает в период глобальных биологических угроз.
Риск возникновения и распространения ИСМП определяется многими факторами: степенью эпидемической безопасности больничной среды и медицинских технологий, инвазивностью и количеством проводимых лечебно-диагностических манипуляций, наличием поствакцинального и постинфекционного иммунитета к возбудителям наиболее распространенных инфекционных заболеваний у персонала и пациентов, особенностями течения хронических заболеваний у пациентов, а также уровнем подготовки и квалификации медицинских работников.
Качественная оценка определенных рисков распространения ИСМП основана на двух основных положениях. Во-первых, риск возникновения ИСМП постоянно существует в любых МО. Очевидно, что он возрастает на фоне пандемии, когда внутрибольничные инфекции провоцируют утяжеление течения и увеличение частоты неблагоприятных исходов COVID-19. Во-вторых, воздействие на указанный риск является более эффективным по сравнению с воздействием на результат его реализации, которым является случай ИСМП [1, 2, 7]. Реализация риска в МО приводит к отклонению фактических результатов оказания медицинской помощи и применения тех или иных медицинских технологий от запланированных.
Контингентами, подверженными риску возникновения ИСМП как во время пандемии COVID-19, так и в ее отсутствие, являются пациенты и персонал МО. Активные миграционные потоки и скученность населения определяют высокую численность контактов между людьми и наиболее актуальны для мегаполисов, таких как Москва.
Среди причин возникновения ИСМП лидируют бактериальные инфекции. Пациенты стационаров чаще подвержены риску возникновения ИСМП, вызванных условно-патогенными бактериями из группы так называемых «ESCAPE-патогенов» (to еscape – избегать), которые в процессе селекции приобрели свойства ускользать от действия антимикробных и дезинфекционных средств. Этиологическая структура бактериальных ИСМП весьма разнообразна и, по данным научной литературы, представлена в основном условно-патогенными возбудителями, циркулирующими во внутрибольничной среде. Преобладающими возбудителями ИСМП во всех странах мира являются полирезистентные к антибиотикам микроорганизмы: Е. coli, Klebsiella spp., Enterobacter spp., Serratia spp., Pseudomonas spp., Acinetobacter spp., оксациллин (метициллин)- резистентный эпидермальный стафилококк (ORSE), ванкомицин-резистентный энтерококк (VRE) [8–10].
Как известно, в качестве ИСМП могут выступать как бактериальные (до 90%), так и вирусные инфекции. По данным научной литературы, в последние годы среди персонала МО все чаще регистрируют случаи высококонтагиозных инфекций, управляемых средствами вакцинопрофилактики, или, иными словами, управляемых инфекций [11, 12]. Занос возбудителей инфекционных заболеваний в стационар происходит, как правило, при поступлении пациентов, находящихся в инкубационном периоде (до возникновения специфических клинических проявлений), что при наличии факторов риска приводит к формированию эпидемических очагов внутрибольничных инфекций. Значимыми факторами экзогенного риска возникновения управляемых инфекций в МО являются наличие благоприятных условий для реализации механизма передачи соответствующего возбудителя и отсутствие специфического иммунитета у медицинского персонала (относящегося к декретированным группам населения и подлежащего обязательной вакцинации согласно национальному календарю профилактических прививок).
Наиболее актуальными из управляемых вирусных инфекций (помимо SARS-CоV-2) являются гепатит В (ГВ) и корь. Согласно данным научной литературы, медицинские работники чаще заболевают ГВ в сравнении с другими группами населения, увеличивая при этом риск инфицирования пациентов и внутрибольничного распространения инфекции [7, 13].
В 2019 г. в России, как и во многих странах мира, регистрировали максимальные уровни заболеваемости корью, в том числе вспышечного характера, с вовлечением медицинских работников и пациентов многопрофильных стационаров [14].
Таким образом, принципиально важным является получение данных о наиболее часто встречающихся возбудителях таких инфекций, их антибиотикорезистентности, а также об отделениях, подверженных наибольшему риску возникновения ИСМП, обусловленных ESCAPE-патогенами. Наличие указанного комплекса сведений позволяет проводить целенаправленный поиск источников ИСМП, выявлять факторы риска, связанные с конкретными медицинскими вмешательствами и манипуляциями, проводить риск-ориентированный эпидемиологический надзор и своевременную, эффективную профилактику и терапию при помощи антибиотиков [5, 7, 8].
Цель исследования – качественная оценка факторов риска возникновения и распространения ИСМП на примере многопрофильных стационаров Москвы.
Материалы и методы
Анализ внутрибольничной заболеваемости в Российской Федерации и Москве проводили по данным отчетной формы № 2 Федерального государственного статистического наблюдения «Сведения об инфекционных и паразитарных заболеваниях».
Для оценки уровня и напряженности иммунитета медицинских работников к возбудителям вирусных инфекций методом непрямого твердофазного иммуноферментного анализа (ИФА) с использованием отечественных тест-систем производства ЗАО «Вектор-бест» проведено скрининговое серологическое исследование образцов сывороток крови, взятых у сотрудников многопрофильных соматических стационаров Москвы (коллекция ФГБУ НИЦЭМ им. Н.Ф. Гамалеи Минздрава России), на наличие специфических антител класса IgG к вирусам гепатита В (ВГВ) (n = 890) (защитным уровнем антител считали значение более 10 мМЕ/мл), а также кори и краснухи (n = 200) (положительными считали образцы с уровнем антител выше 0,18 МЕ/мл и 10 мМЕ/мл соответственно). На наличие маркеров инфицирования ВГВ было исследовано 653 образца сыворотки крови от вакцинированных по полной схеме лиц и 237 образцов от невакцинированных (группы были сопоставимы по возрасту и полу).
Для оценки риска возникновения ИСМП, вызванных условно-патогенными бактериями группы ESCAPE-патогенов у пациентов разных клинических отделений, использовали данные микробиологического мониторинга за 4 года (с 2017 по 2020 г.). Исследованы отделяемое из операционных ран и слизистой носа, эндотрахеальный аспират, кровь, моча, спинномозговая жидкость из патологических локусов пациентов на 3–4-й день поступления в отделения при условии отсутствия у них этих патогенов при поступлении или пребывании в других отделениях. Госпитальные штаммы бактерий (изоляты) были выделены из клинического материала как в ассоциациях, так и в чистом виде (в виде монокультуры). В исследовании пациентов, повторно выделяющих штаммы одного и того же вида, учитывали только однократно.
Бактериологический мониторинг осуществляли классическим методом посева на питательные среды с применением дополнительных тестов для определения отдельных видов резистентности: скрининг на агаре с оксациллином, определение продукции бета-лактамаз расширенного спектра (БЛРС) на среде Мюллера–Хинтона с использованием цефтазидима и ингибитора клавулановой кислоты методом двойных дисков и определением чувствительности к антибиотикам диско-диффузионным методом с последующим анализом спектра клинически и эпидемиологически значимой микрофлоры и профиля антибиотикорезистентности. Для анализа и интерпретации полученных результатов применяли специализированные аналитические компьютерные программы (ChoNet, «Микроб-2», «Журнал микробиолога»). Плановые санитарно-бактериологические исследования выполнены в условиях стационаров, где исследовали 6547 смывов, взятых с различных эпидемиологически значимых объектов внутрибольничной среды.
Статистическую обработку данных осуществляли с помощью программ Microsoft Excel и Statistica 12.0 (StatSoft, США) с применением методов параметрической статистики. Средние значения (m) были оценены с учетом 95% доверительного интервала (95% ДИ) по методу Клоппера–Пирсона (точный метод). Для оценки достоверности различий показателей в группах обследованных лиц использовали t-критерий Стьюдента с чувствительностью р < 0,05.
Результаты
По данным официальной статистической отчетности за 2020 г., в РФ был зарегистрирован 1 случай внутрибольничного инфицирования ГВ в амбулаторно-поликлиническом звене медицинской помощи в Москве. Однако указанная инфекция остается серьезной проблемой здравоохранения: показатель заболеваемости острым ГВ в Москве в 2020 г. составил 1,35 на 100 тыс. населения, хроническим (впервые установленным) – 9,09 на 100 тыс. Таким образом, риск инфицирования ВГВ при оказании медицинской помощи в МО существует постоянно. В связи с этим медицинские работники, как декретированная группа населения, должны быть в обязательном порядке вакцинированы против ВГВ согласно национальному календарю профилактических прививок.
Сравнительная оценка частоты выявления маркеров инфицирования ВГВ у невакцинированных и прошедших иммунизацию медицинских работников свидетельствует о статистически значимых различиях практически по всем изученным параметрам (р < 0,05) (табл. 1). Как видно из представленных данных, у 21,5% (95% ДИ 17,5–23,8) вакцинированных по полной схеме медицинских работников выявлено отсутствие каких-либо серологических маркеров ВГВ. Доля серонегативных среди привитых была статистически достоверно ниже (р < 0,001), чем в группе не вакцинированных против ВГВ.
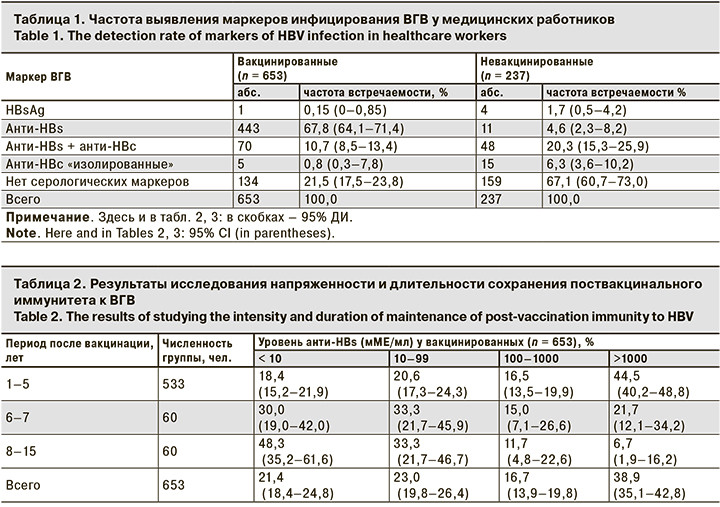
Известно, что сочетание антител к HBs-антигену (анти-HBs) и ядерному антигену ВГВ (анти-HBc) свидетельствует о перенесенном в прошлом ГВ [7, 13]. По результатам исследования частоты выявления маркеров инфицирования ВГВ в обследуемых группах показано существенное превышение удельного веса лиц с наличием анти-HBs в сочетании с анти-HBc среди невакцинированных по сравнению с привитыми сотрудниками. Такие результаты указывают на активную циркуляцию ВГВ среди медицинских работников и существование риска инфицирования. Установлено статистически достоверное снижение указанного риска у привитых сотрудников по сравнению с невакцинированными, так как относительный риск (RR) составил 0,4 (95% ДИ 0,3–0,6) (RR < 1; p < 0,05).
Следует отметить, что у 11 сотрудников, не имеющих сведений о прививке и отнесенных нами в группу «невакцинированные», были обнаружены анти-HBs, свидетельствующие о предшествующей иммунопрофилактике. «Изолированные» aнти-HBc, указывающие на скрытую HBsAg-инфекцию, чаще выявляли в группе невакцинированных медицинских работников [7, 11].
Результаты изучения длительности и напряженности специфического иммунитета к ГВ у медицинского персонала показали, что через 5 лет после завершения полного курса вакцинации максимальный уровень (> 1000 мМЕ/мл) анти-HBs выявлен в 44,5% случаев (95% ДИ 40,2–48,8) случаев от числа всех обследованных лиц (табл. 2).
По мере увеличения периода времени (до 8–15 лет), прошедшего после завершения полного курса вакцинации, доля медицинских работников с максимальным уровнем анти-HBs, статистически достоверно (р < 0,05) снизилась до значения 6,7% (95% ДИ 1,9–16,2). При этом доля лиц, у которых уровень антител был < 10 мМЕ/мл (то есть ниже протективного), статистически достоверно увеличивалась до 48,3% (95% ДИ 35,2–61,6) через 8–15 лет.
Кроме того, показано, что после законченного курса вакцинации в старших возрастных группах медицинских работников существует риск снижения уровня антител в сыворотке крови с течением времени. Так, частота выявления специфических антител (анти-НВs) на защитном уровне в возрастной группе 20–29 лет составила 83,4% (95% ДИ 79,2–86,1), а в группе 50 лет и старше – только 59,1% (95% ДИ 57,2–61,4; р < 0,05).
Таким образом, по результатам исследования установлено, что для медицинских работников факторами риска инфицирования ВГВ являются возраст старше 50 лет, а также период более 8 лет, прошедший после окончания курса вакцинации.
Еще одной актуальной на сегодняшний день инфекцией является корь, рост заболеваемости которой на территории РФ, в том числе в Москве, был отмечен с 2011 по 2014 г., а затем с 2016 по 2019 г. Накануне развития пандемии COVID-19 в 2019 г. регистрировали максимальное за последние 20 лет распространение этой инфекции (показатель заболеваемости в РФ и Москве составил 3,06 и 11,23 на 100 тыс. населения соответственно). В 2020 г. на фоне действия широкомасштабных и беспрецедентных по объему противоэпидемических мероприятий в отношении новой коронавирусной инфекции наблюдалось эпидемическое благополучие по кори. Так, показатель заболеваемости значительно снизился по сравнению с 2019 г. и составил в РФ 0,83 на 100 тыс. населения, в Москве – 2,48. При этом в стране было зарегистрировано 48 внутрибольничных случаев заражения этой инфекцией, из них 17 – в столице, что свидетельствовало о сохранении риска заноса и распространения ее в виде ИСМП.
При оценке специфического иммунитета против кори у медицинских работников отмечено, что группой риска по заражению этой инфекцией являются лица в возрасте 40–49 лет, среди которых доля серонегативных была максимальной и составила 12,5% (95% ДИ 8,3–17,9). В других обследованных возрастных группах (до 40 лет и старше 50 лет) этот показатель не превышал 7%.
Краснуха, наравне с корью, входит в Программу ВОЗ по элиминации. Однако современные эпидемические ситуации по этим инфекциям совершенно различны [15]. Так, на фоне роста заболеваемости корью благодаря вакцинации эндемичное распространение краснухи в России было прекращено, а в 2020 г. зарегистрировано только 3 случая этой инфекции, 2 из них – в Москве. Оценка специфического иммунитета медицинского персонала к вирусу краснухи показала, что доля серонегативных среди обследованных лиц в разных возрастных группах была значительно меньше, чем к вирусу кори, и не превышала 7%. Это свидетельствует о минимальном риске распространения краснухи в МО с участием медицинских работников. Следует отметить, что вакцинация против указанной инфекции в рамках Национального календаря профилактических прививок была начата в нашей стране с 2000 г., а значит, популяционный иммунитет взрослого населения (в том числе медицинских работников) в основном обеспечивается за счет лиц, перенесших эту болезнь ранее.
Результаты микробиологического мониторинга клинически и эпидемиологически значимой микрофлоры в разных отделениях многопрофильных стационаров Москвы, участвующих в исследовании, представлены в табл. 3.
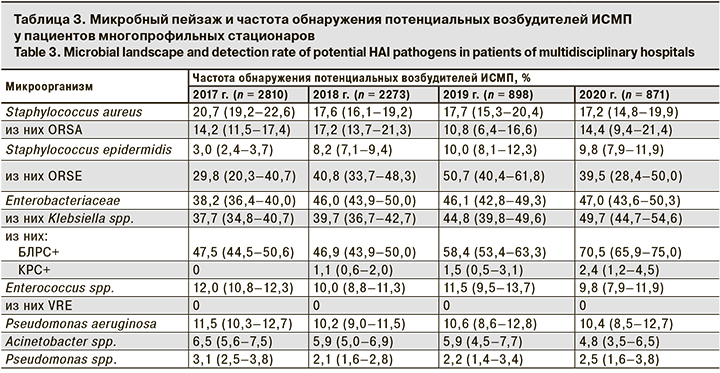
При обследовании пациентов многопрофильных стационаров в микробном спектре преобладала (р < 0,001) грамотрицательная микрофлора в виде энтеробактерий разных видов (в среднем за период исследования доля их составила 44,3% (95% ДИ 41,8–45,9). Среди штаммов этого семейства доминировали изоляты Klebsiella spp., при этом на протяжении всех 4 лет мониторинга увеличивался удельный вес штаммов продуцирующих БЛРС В 2020 г. он составил более 70%. Выработка БЛРС – один из наиболее распространенных, эпидемиологически и клинически значимых механизмов резистентности энтеробактерий к современным бета-лактамным антибиотикам [16, 17].
Грамположительная микрофлора на протяжении всего периода исследования занимала 2-е место в общем спектре потенциальных возбудителей ИСМП. На ее долю ежегодно приходилось от 35,7 до 37,7% всех изолированных микроорганизмов, которые чаще были представлены Staphylococcus aureus (от 17,2 до 20,7%). Причем доля оксациллин (метициллин)-резистентного Staphylococcus aureus (ORSA) варьировала от 10,8 до 17,2%. Возбудитель был устойчив ко всем бета-лактамным антибиотикам и чувствителен только к гликопептидам (ванкомицину).
Меньший удельный вес (р < 0,001) приходился на Staphylococcus epidermidis, среди изолятов которого преобладал ORSE (см. табл. 3). Штаммы ORSE были устойчивы ко всем бета-лактамам и чувствительны только к гликопептидам (ванкомицину).
Наибольшая доля ORSA и ORSE выявлена в отделениях гнойной хирургии, где в ходе мониторинга раневой микрофлоры мы наблюдали возникновение ИСМП в виде суперинфекции гнойных ран и язв. При этом среди выделенных из раневого отделяемого штаммов стафилококков резистентные к антибиотикам изоляты (ORSA и ORSE) встречались в 46,2% случаев, что значительно выше (р < 0,001) доли резистентных стафилококков, выделенных из очагов острой гнойной инфекции мягких тканей (11,7%).
Еще один тип эпидемического процесса ИСМП в отделениях гнойной хирургии был связан с ампутацией нижних конечностей на уровне бедра по поводу ишемической гангрены с формированием культи и наложением швов. При этом наблюдали нагноение раны ампутационной культи, микрофлора которой была представлена, в том числе, ORSA и ORSE, с меньшим удельным весом (21,8%; р < 0,05).
В общем спектре грамположительной микрофлоры до 12,0% составили энтерококки, занимающие важную позицию в структуре грамположительных бактерий. Однако среди этих изолятов не обнаружены VRE, широко известные в мировой медицинской практике как возбудители тяжелейших ИСМП.
Необходимо подчеркнуть, что рост числа случаев выделения Klebsiella spp., являющихся продуцентами БЛРС, отмечен в основном в отделениях реанимации и интенсивной терапии (ОРИТ). Так, в 2018 г. 79,3% штаммов этих бактерий было выделено из различных локусов у пациентов этих отделений. На 3–4-й день госпитализации в ОРИТ с высокой частотой выявляли все ESCAPE-патогены, за исключением VRE.
Неферментирующие грамотрицательные бактерии (НФГОБ) в общем спектре клинически значимой микрофлоры были представлены Pseudomonas aeruginosa и Acinetobacter, которые характеризуются определенной природной резистентностью к антимикробным препаратам и быстрым нарастанием антибиотикоустойчивости в госпитальных условиях. Согласно полученным данным, удельный вес Pseudomonas aeruginosa в общей структуре микрофлоры пациентов варьировал в пределах от 10,2 до 11,5% (см. табл. 3). Acinetobacter на протяжении всего периода наблюдений встречался статистически достоверно реже (р < 0,05), и доля его составляла от 4,8 до 6,5%. При этом в 78,4% случаев штаммы Pseudomonas aeruginosa и Acinetobacter обнаружены у пациентов ОРИТ. Для выявления потенциального риска передачи возбудителей ИСМП в условиях стационаров исследовано 6547 смывов с объектов внешней среды в рамках плановых санитарно-бактериологических исследований (рисунок, см. на вклейке).
При низкой доле нестандартных смывов (менее 2%) выявлен высокий риск циркуляции потенциальных возбудителей ИСМП – всего 22% всех грамотрицательных бактерий (Pseudomonas aeruginosa, Acinetobacter, энтеробактерии, продуцирующие БЛРС) в замкнутом пространстве стационаров. Нельзя также исключить возможность пассажа их через организм ослабленных основной и сопутствующей патологией пациентов, что характерно для ОРИТ, где эпидемический процесс ИСМП развивается в условиях искусственно созданной экологической системы. Микробный пейзаж клинически значимой и внутрибольничной микрофлоры представлен грамотрицательными бактериями, включающими указанные эпидемиологически значимые штаммы.
Видовое разнообразие бактерий, контаминирующих объекты окружающей среды в стационарах, соответствует микрофлоре клинического материала от пациентов (общими для них стали все представители семейства кишечных бактерий и НФГОБ). В структуре грамположительных бактерий внутрибольничной среды обнаружены ORSA (12,6% (95% ДИ 9,5–16,4)) и ORSE (7,4% (95% ДИ 4,5 – 10,8)), что согласуется с данными о выделении этих патогенов из клинического материала от пациентов – 14,2% (95% ДИ 11,5–17,4) и 29,8% (95% ДИ 20,3–40,7) соответственно. При этом VRE в составе микрофлоры госпитальной среды обнаружен не был.
Обсуждение
Высокая актуальность и медико-социальная значимость распространения ВГВ среди населения, в том числе среди медицинских работников как группы профессионального риска, диктуют необходимость разработки различных подходов к повышению эффективности вакцинации, в том числе путем применения адъювантов, иммуномодуляторов, оптимизации схем, создания новых вакцинных препаратов и др. Следует отметить, что определение гуморального иммунного ответа в ИФА лишь косвенно отражает напряженность антиген-специфичного Т-клеточного ответа, который играет важную роль в защите от вирусных инфекций. Длительный протективный эффект вакцины обусловлен формированием иммунологической памяти, которая связана с накоплением клона долгоживущих (20 лет и более) клеток памяти [11, 13]. Однако факт отсутствия специфического иммунного ответа на прививку против ВГВ требует обсуждения и может быть связан, в том числе, с иммунизацией вакцинами зарубежного производства, содержащими только серотип аd НВs-антигена, а также с возможной мутацией возбудителя. Проблема мутантных форм ВГВ в последнее время становится все более актуальной, поскольку массовая вакцинация населения против ГВ и применение противовирусных препаратов для лечения хронического ГВ способствуют их селекции и распространению [18]. Вопрос об ограничении профессиональных обязанностей медицинских работников, у которых не установлена серопротекция (то есть титры антител не превышают 10 мМЕ/мл), является чрезвычайно сложным, и его детальное обсуждение с учетом юридических, профессиональных и этических аспектов выходит за рамки данной статьи. На сегодняшний день ВОЗ рекомендует решать этот вопрос индивидуально в каждом конкретном случае.
Таким образом, проблема вирусных гепатитов сохраняет свою актуальность для сотрудников многопрофильных стационаров. Ее особенностями являются широкое распространение маркеров инфицирования ВГВ, наличие скрытых форм инфекции и вирусных мутаций, не выявляемых регламентированными рутинными методами ИФА [18].
В условиях нестабильной эпидемической ситуации по кори, наблюдаемой в последние годы во многих странах, в том числе в России и ее столице, показано существование потенциального риска распространения этой инфекции в условиях стационара с участием медицинских работников. Установлено наличие среди них контингента серонегативных лиц, доля которых была максимальной в возрастной группе 40–49 лет (12,5%). Полученные данные согласуются с результатами других исследований по сходной тематике [19–23]. В этой связи нужно заметить, что снижение охвата вакцинацией населения в условиях пандемии COVID-19, отмечаемое повсеместно, а также настороженности медицинских работников усугубляет сложившуюся ситуацию и требует проведения кампаний по дополнительной вакцинации ранее не охваченных лиц, в том числе по результатам исследования напряженности иммунитета [24].
Полученные данные об эпидемиологическом благополучии по краснухе согласуются с данными не только официальной статистики о спорадическом уровне заболеваемости населения (установленном ВОЗ – менее 1 на 1 млн населения), но и исследователей, проводивших скрининговые серологические исследования состояния популяционного иммунитета [15, 24].
Следует отметить, что внедрение в клиническую практику новых диагностических и лечебных технологий значительно снизило летальность в остром периоде критических состояний. В то же время концентрация в ОРИТ больных со сниженной антимикробной защитой, полиорганной недостаточностью, нарушением перфузии тканей и выраженное селективное давление антимикробной терапии, широкое применение дезинфицирующих средств являются факторами риска возникновения для бактерий новых экологических ниш, в которых происходит селекция субпопуляций с новым набором факторов вирулентности и детерминант устойчивости [4, 5, 7]. Подтверждением этому является обнаружение в ОРИТ штаммов клебсиелл, продуцирующих карбапенемазы расширенного спектра (КРС).
Реальный риск распространения БЛРС, а затем и КРС, тесно связан с частым использования карбапенемов, воздействующих на клеточную стенку бактерий и имеющих наиболее широкий спектр активности (в отношении грамотрицательных и грамположительных возбудителей), кроме ORSA и ORSЕ. Выраженное селективное давление является фактором риска распространения ингибитор-резистентных В-лактамаз – КРС, которые не ингибируются клавулановой кислотой. КРС и карбапенем-резистентные патогены являются наиболее эпидемиологически значимыми возбудителями ИСМП и представляют крайне сложную проблему при лечении тяжелых инфекций в отделениях, массово использующих мощную антимикробную терапию [25, 26]. Такие штаммы формируются в ОРИТ и характеризуются высокой конкурентоспособностью к колонизации организма пациента по сравнению с другими микроорганизмами. Кроме того, в силу чрезвычайно интенсивного и напряженного лечебно-диагностического процесса, большой загруженности персонала в ОРИТ наиболее высока вероятность обмена микрофлорой между пациентами. Результатом интенсивной, нередко избыточной, антибиотикотерапии в этих отделениях является распространение внутри многопрофильного стационара ИСМП, вызванных полирезистентными возбудителями [16, 17].
Полученные данные свидетельствуют об актуальности проблемы НФГОБ в общем спектре клинически значимой микрофлоры, представленных в основном Pseudomonas aeruginosa (10,2–11,5%) и Acinetobacter (4,8–6,5%), которые относят к числу бактериальных агентов с высоким эпидемическим потенциалом, способных в короткие сроки «формировать госпитальные штаммы и вызывать вспышки ИСМП» [26, 27]. НФГОБ являются серьезной проблемой для стационаров разного профиля, особенно ОРИТ, ожоговых отделений, отделений хирургического профиля [8–10].
Одной из основных причин формирования устойчивости Pseudomonas aeruginosa к антибиотикам и дезинфектантам является ее способность образовывать биопленки, которые защищают бактерии как от естественных защитных факторов организма пациентов, так и от неблагоприятного воздействия внутрибольничной среды. Наиболее быстрое формирование биопленок происходит на поверхностях сосудистых и мочевых катетеров, интубационных трубок, искусственных клапанов сердца и других кардиоваскулярных имплантов [27].
Таким образом, существует риск перекрестного инфицирования и заражения пациентов стационаров, что подтверждается высокой сопоставимостью результатов планового микробиологического исследования объектов внутрибольничной среды и состава микрофлоры клинического материала от больных с подозрением на ИСМП. Перепрофилирование и интенсификация работы многопрофильных стационаров для борьбы с пандемией COVID-19 усугубляют непростую ситуацию с распространенностью ИСМП. Перегруженность ОРИТ больными с новой коронавирусной инфекцией, а также обширная антимикробная терапия в сочетании с инвазивными методами лечения закономерно увеличивают риск гибели пациентов от осложнений, связанных с инфицированием.
Заключение
По результатам исследования в многопрофильном стационаре Москвы выявлены риски возникновения ИСМП, связанные с наличием когорты серонегативных к вирусу кори медицинских работников в возрасте 40–49 лет, а также с отсутствием маркеров ВГВ у вакцинированных против него лиц. Показано, что риск инфицирования ВГВ увеличивался с возрастом, а также по прошествии 8 лет и более после введения полного курса вакцины. Кроме того, установлен риск распространения ИСМП бактериальной природы, связанный с циркуляцией во внутрибольничной среде штаммов представителей энтеробактерий БЛРС+ и КРС+, НФГОБ, грамположительной кокковой флоры (ОRSA, ОRSЕ). Организация риск-ориентированного контроля ИСМП в контексте пандемии новой коронавирусной инфекции должна быть основана на мультидисциплинарном подходе к данной проблеме с использованием различных методов исследования, в том числе серологического, микробиологического, санитарно-бактериологического, клинико-эпидемиологического, статистического и др.



