Пневмококк является ведущей причиной бактериальной пневмонии, сепсиса и менингита по всему миру. Показатели летальности от инвазивной пневмококковой инфекции (ПИ) варьируют от 5 до 35% в зависимости от локализации инфекции, сопутствующих заболеваний и возраста пациента [1]. Летальность от бактериемической пневмококковой пневмонии в преантибиотическую эру составляла 77%. С 50-х годов XX века показатель летальности от инвазивной ПИ снизился до 28%. Летальные исходы в основном регистрировали у пожилых людей и у пациентов с сопутствующей патологией, такой как почечная и печеночная недостаточность, хроническая обструктивная болезнь легких, сахарный диабет [2].
В глобальном масштабе растет распространенность резистентных к антибактериальным препаратам (АБП) штаммов пневмококка [3]. В 60–70-е годы XX века чувствительность пневмококка к пенициллину и тетрациклину считалась неизменной. В 70-е годы устойчивые штаммы обнаруживали, но редко, и возможность их распространения рассматривалась как крайне маловероятная. В 90-е годы клиницисты и микробиологи столкнулись с растущим вызовом устойчивых к АБП пневмококков, которые начали повсеместно распространяться в 80-е годы [2]. Сообщения о снижении уровней чувствительности пневмококка к АБП, особенно в последние несколько лет, поступают из многих стран мира.
Устойчивость к пенициллину связана с ферментами, известными как пенициллинсвязывающие белки [2]. Активности фермента бета-лактамазы в пневмококках не обнаружено. Устойчивость в макролидам обусловлена двумя механизмами: метилированием кодированных геном ermB рибосомальных участков, на которые нацелены макролиды, и инактивацией препарата, кодированной геном mefA [4].
Особую обеспокоенность вызывают полирезистентные штаммы пневмококка. Устойчивость к 3 и более АБП разных классов является полирезистентностью. Впервые полирезистентный штамм пневмококка был выделен в 1977 г. в госпитале Йоханнесбурга (ЮАР) из гнойной мокроты двух детей с пневмонией, развившейся после лечения пенициллином и цефалотином. Штамм был устойчив к пенициллину, тетрациклину, эритромицину, клиндамицину, хлорамфениколу и триметоприм-сульфаметоксазолу (ко-тримоксазолу). Хотя полирезистентные штаммы пневмококка достаточно широко распространены среди носителей в Южной Африке, среди клинических штаммов такие находки редки – 1% в 1979–1982 гг. и 2% в 1983–1986 гг. В Пакистане 16,4% штаммов пневмококка, выделенных из крови детей, были одновременно устойчивы к хлорамфениколу, тетрациклину и триметоприм-сульфаметоксазолу. Пневмококки, вызвавшие бактериемию и менингит, устойчивые к пенициллину, тетрациклину, эритромицину, клиндамицину и триметоприм-сульфаметоксазолу, были обнаружены в Италии, Франции и Бельгии [2].
Особым образом распределяются серотипы пневмококка среди антибиотикорезистентных штаммов. Впервые высокий уровень устойчивых к пенициллину штаммов был отмечен среди серотипов пневмококка 6А и 19А, выделенных у госпитализированных детей в Южной Африке в 1988 г. Спустя 6 лет в том же госпитале выделены штаммы с резистентностью к серотипам 6А, 6В, 19А. В Нью-Йорке устойчивые к пенициллину штаммы имели серотип 19А, в Денвере (штат Колорадо, США) – серотип 6В. Полирезистентность при отсутствии устойчивости к пенициллину была отмечена в Южной Африке у штаммов пневмококка серотипов 6В, 19F и 14. В Испании высокоустойчивые к пенициллину штаммы имели серогруппу 23, однако в Барселоне обнаружены такие штаммы серогрупп 6 и 15, а также нетипируемые штаммы. Полирезистентными, включая устойчивость к пенициллину, преимущественно являются штаммы серогрупп 23, 6, серотипа 14. Во Франции в 1970–1986 гг. основными серогруппами и серотипами, ассоциированными с полирезистентностью, являлись серогруппы 19, 6, 23, 14. В Англии во время госпитальной вспышки пневмококковой инфекции в Ньюкасле в 1987 г. был выделен полирезистентный пневмококк серогруппы 23. Похожая вспышка в Бристоле в том же году также была связана с этим пневмококком. Полирезистентный штамм пневмококка серотипа 3 вызвал молниеносную летальную инфекцию у 17-летнего школьника в Южной Африке. В Пакистане штаммы, устойчивые к хлорамфениколу, тетрациклину и триметоприм-сульфаметоксазолу, принадлежали к серотипу 31 [2]. Исследователи отмечают, что продолжительность госпитализации и бесконтрольное использование АБП являются факторами риска ПИ, вызванной устойчивыми штаммами.
Вакцинация пациентов групп риска на территориях с наибольшей распространенностью устойчивых штаммов пневмококка может сократить число случаев ПИ. Немецкие ученые отмечают, что до вакцинации 7-валентной конъюгированной пневмококковой вакциной большая часть штаммов, одновременно резистентных к пенициллину и макролидам, относилась к серотипам 6В, 9V, 14, 19F и 23F. В поствакцинальный период их распространенность резко снизилась. Однако актуальным среди устойчивых к пенициллину штаммов стал серотип 19А. После введения 13-валентной конъюгированной пневмококковой вакцины устойчивыми к пенициллину стали штаммы серотипов 15А, 23В. Этот факт отражает легкость, с которой в популяции пневмококка перераспределяется устойчивость штаммов к пенициллину. Вакцинация детей 13-валентной конъюгированной пневмококковой вакциной оказала сильный эффект на популяцию пневмококка в Германии как среди вакцинированных детей, так и среди невакцинированных детей и взрослых. Распространение серотипов, включенных в вакцину, резко сократились, и значение приобрели невакциноассоциированные серотипы [5].
В Российской Федерации заболеваемость пневмококковым менингитом (ПМ) не теряет своей актуальности. По данным Референс-центра по мониторингу за бактериальными менингитами ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора (далее – Референс-центр), показатель заболеваемости ПМ в 2017 г. на основании лабораторно подтвержденных случаев составил 0,25 на 100 тыс. населения (369 случаев). Повышение заболеваемости по сравнению с прошлым годом наблюдалось во всех федеральных округах РФ, кроме Центрального. Показатель заболеваемости детей до 5 лет в 2017 г. был самым высоким и составил 0,63 на 100 тыс. детей (60 случаев), превысив общероссийский показатель в 2,5 раза. Заболеваемость ПМ выросла в 2 возрастных группах: 10–14 лет и 45 лет – 64 года. Наибольшее число заболеваний ПМ (101 случай) зарегистрировано среди лиц пенсионного возраста, а также неработающих в возрасте 19–59 лет (91 случай).
Показатель летальности от ПМ в 2017 г. составил 22% (82 случаев из 369). Самые высокие показатели летальности были среди взрослых: в возрастной группе 45 лет – 64 года – 29%, в группе лиц 65 лет и старше – 51%. Показатель летальности от ПМ в группе детей до 5 лет составил 17%, детей до 1 года – 32% [6].
В соответствии с Приказом Минздрава России от 21.03.2014 № 125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям» иммунизация против ПИ проводится в рамках национального календаря профилактических прививок. По данным формы № 6 федерального государственного статистического наблюдения «Сведения о контингентах детей и взрослых, привитых против инфекционных заболеваний», охват детей прививками против ПИ в декретированные сроки (на 12 мес.) за 2017 г. в целом по РФ увеличился с 75,1 до 87,7%, но не достиг целевого показателя (95%). В ряде субъектов страны этот показатель остается ниже 80%1. На сегодняшний день отсутствуют данные о влиянии начатой вакцинопрофилактики на серотиповой пейзаж инвазивных российских штаммов пневмококка, устойчивых к АБП. Целью настоящего исследования явилось определение чувствительности к АБП Streptococcus pneumoniae, выделенных от больных ПМ в Москве.
Материалы и методы
Исследование проведено на базе Референс-центра. Изучено 99 штаммов Streptococcus pneumoniae (S. pneumoniae), выделенных из крови или спинномозговой жидкости детей и взрослых с диагнозом «гнойный бактериальный менингит пневмококковой этиологии», госпитализированных в лечебно-профилактические учреждениях Москвы за период 2006–2017 гг. Для выявления динамики чувствительности S. pneumoniae к АБП условно выделены 2 периода наблюдения: 1-й –2006–2013 гг. (53 штамма), 2-й – 2014–2017 гг. (46 штаммов).
Штаммы хранились в музейной коллекции Референс-центра при температуре -70 оС. Все штаммы идентифицированы как род Streptococcuss, вид pneumoniae, серотипированы согласно нормативно-методическим документам в стационарах и реидентифицированы в Референс-центре с использованием стандартных методик. Принадлежность штаммов к S. pneumoniae устанавливали с помощью набора SLIDEX pneumo-Kit (bioMеrieux, Франция), дисков с желчью (ФБУН «НИИ эпидемиологии и микробиологии им. Пастера», Санкт-Петербруг), дисков с оптохином OPTO-F (bioMеrieux, Франция), а также методом ПЦР с использованием тест-системы «АмплиСенс® N. meningitidis/H. influenzae/S. pneumoniae-FL».
Серотиповую характеристику штаммов S. pneumoniae определяли в реакции латекс-агглютинации с применением набора ImmuLex™ Pneumotest Kit (Statens Serum Institut, Дания).
Исследование чувствительности S. pneumoniae к АБП с определением минимальных ингибирующих концентраций (МИК) бензилпенициллина, цефтриаксона, эритромицина, клиндамицина, левофлоксацина, триметоприм-сульфаметоксазола осуществляли методом E-тестов, используя Etest® (bioMеrieux, Франция). Тест выполняли по методике, изложенной в руководстве «Лабораторные методы для диагностики менингита, вызванного Neisseria meningitidis, Streptococcus pneumoniae и Haemophilus influenzae»2. Чувствительность S. pneumoniae к широкой панели АБП – пенициллину, цефотаксиму, эритромицину, клиндамицину, тетрациклину, левофлоксацину, хлорамфениколу, ванкомицину, триметоприм-сульфаметоксазолу – изучали с помощью системы ATB STREP 5 (bioMеrieux, Франция).
 Из замороженного состояния штаммы высевали на чашки с шоколадным агаром (готовая питательная среда «Шоколадный агар с факторами роста», ООО «Биомедиа», Россия) при 37 оС в условиях 5% СО2. Через 24 ч просматривали качество роста и осуществляли повторный пересев на аналогичные чашки, инкубировали в тех же условиях. Постановку метода Е-тестов проводили на чашках со средой, приготовленной на основе агара Мюллера–Хинтона (Laboratorios Conda S.A., Испания) с добавлением 5% бараньей дефибринированной крови (ЗАО «ЭКОлаб», Электрогорск), а также на готовых чашках с кровяным агаром с 5% лошадиной кровью («БиоВитрум», Санкт-Петербург) (для полоски с триметоприм-сульфаметоксазолом). Среду разливали в чашки Петри диаметром 150 мм глубиной агара 4 мм (в случае постановки теста с полоской триметоприм-сульфаметоксазола – 100 мм). Изолированные колонии с шоколадного агара переносили в 1 мл бульона Мюллера–Хинтона до мутности 0,5 по стандарту МакФарланда. Приготовленную микробную взвесь засевали тампоном на чашки Петри. Чашки оставляли при комнатной температуре на 5–10 мин до полного высыхания агаровой поверхности. Стерильным пинцетом наносили на каждую чашку 6 разных полосок Etest® (и 1 с триметоприм-сульфаметоксазолом – на чашку с агаровой поверхностью, содержащую лошадиную кровь), предварительно согретых при комнатной температуре в течение 10 мин. Чашки инкубировали 24 ч при 37 оС в условиях 5% СО2, затем проводили учет результатов. Последнюю концентрацию, при которой наблюдали задержку роста, считали МИК АБП. Результаты интерпретировали согласно руководству «Лабораторные методы для диагностики менингита, вызванного Neisseria meningitidis, Streptococcus pneumoniae и Haemophilus influenzae» (ВОЗ, 2011), по стандартам EUCAST 2011, version 1.3 (табл. 1).
Из замороженного состояния штаммы высевали на чашки с шоколадным агаром (готовая питательная среда «Шоколадный агар с факторами роста», ООО «Биомедиа», Россия) при 37 оС в условиях 5% СО2. Через 24 ч просматривали качество роста и осуществляли повторный пересев на аналогичные чашки, инкубировали в тех же условиях. Постановку метода Е-тестов проводили на чашках со средой, приготовленной на основе агара Мюллера–Хинтона (Laboratorios Conda S.A., Испания) с добавлением 5% бараньей дефибринированной крови (ЗАО «ЭКОлаб», Электрогорск), а также на готовых чашках с кровяным агаром с 5% лошадиной кровью («БиоВитрум», Санкт-Петербург) (для полоски с триметоприм-сульфаметоксазолом). Среду разливали в чашки Петри диаметром 150 мм глубиной агара 4 мм (в случае постановки теста с полоской триметоприм-сульфаметоксазола – 100 мм). Изолированные колонии с шоколадного агара переносили в 1 мл бульона Мюллера–Хинтона до мутности 0,5 по стандарту МакФарланда. Приготовленную микробную взвесь засевали тампоном на чашки Петри. Чашки оставляли при комнатной температуре на 5–10 мин до полного высыхания агаровой поверхности. Стерильным пинцетом наносили на каждую чашку 6 разных полосок Etest® (и 1 с триметоприм-сульфаметоксазолом – на чашку с агаровой поверхностью, содержащую лошадиную кровь), предварительно согретых при комнатной температуре в течение 10 мин. Чашки инкубировали 24 ч при 37 оС в условиях 5% СО2, затем проводили учет результатов. Последнюю концентрацию, при которой наблюдали задержку роста, считали МИК АБП. Результаты интерпретировали согласно руководству «Лабораторные методы для диагностики менингита, вызванного Neisseria meningitidis, Streptococcus pneumoniae и Haemophilus influenzae» (ВОЗ, 2011), по стандартам EUCAST 2011, version 1.3 (табл. 1).
Контроль качества питательной среды и полосок Etest® проводили с использованием контрольного штамма Streptococcus pneumoniae ATCC 49619. МИК АБП, протестированных с этим штаммом, соответствовали референтным значениям. Контроль качества и концентрации бульона Мюллера–Хинтона с внесенной в него культурой проводили в разведении 1:100, культивируя 24 ч при 37 оС в условиях 5% СО2. Количество выросших колоний составило около 300, что соответствовало положительному контролю.
Результаты и обсуждение
Идентификация и биохимическая активность
Интенсивность агглютинации большинства исследованных штаммов (93) расценивалась как 4+ (все клетки агглютинируют и клеточная суспензия ясная по категориям рекомендаций ВОЗ), однако интенсивность агглютинации 6 штаммов определена как 2+ (агглютинировало 50% клеток, клеточная суспензия остается немного мутной). Интенсивность реакции агглютинации может варьировать в зависимости от густоты клеточной суспензии и антисыворотки [7].
Штаммы S. pneumoniae чувствительны к химическому оптохину (гидрохлорид этилгидрокупреина). В начале XX века его использовали для лечения ПИ. Оптохин-резистентные штаммы были отмечены уже в 1912 г. во время эксперимента по лечению оптохином экспериментально зараженных ПИ мышей. Впервые развитие устойчивости пневмококка к оптохину во время лечения пациентов отмечено в 1917 г. Последующее использование препарата было приостановлено из-за серьезных побочных эффектов (4,5% больных долевой пневмонией, принимавших его, потеряли зрение). На сегодняшний день чувствительность к оптохину позволяет предполагать идентификацию альфа-гемолитических стрептококков как S. pneumoniae, хотя некоторые пневмококковые штаммы являются устойчивыми к оптохину [2]. Среди исследованных нами штаммов 1 оказался устойчивым к оптохину, 98 – чувствительны.
Пневмококки лизируются в присутствии желчных кислот, в отличии от других стрептококков. В рамках настоящего исследования 69% штаммов дали положительную реакцию при проведении желчного теста. Отрицательный результат получен при тестировании 32 штаммов. Согласно руководству по лабораторной диагностике «Менингококковая инфекция и гнойные бактериальные менингиты» [7], диски не стандартизованы по содержанию желчных кислот, поэтому к результатам теста следует относиться с настороженностью.
Чувствительность штаммов Streptococcus pneumoniae к антибактериальным препаратам
В рамках настоящего исследования доля устойчивых к бензилпенициллину штаммов пневмококка составила 5,1%, при этом в 1-й периоде исследования (2006–2013 гг.) она была немного выше, чем во 2-м (2014–2017 гг.) – 5,7 и 4,3% соответственно. Минимальные концентрации препарата, подавляющие рост 50 и 90% штаммов (МПК50 и МПК90), были ниже во 2-м периоде (см. рисунок). В 1-м периоде среди 3 устойчивых к бензилпенициллину штаммов 1 относился к серотипу 6В, 1 – к серотипу 8, еще 1 отказался нетипируемым, при этом 1 штамм был выделен от ребенка 9 лет, 1 – от взрослого, в одном случае возраст больного неизвестен. МПК препарата, определившая 3 штамма устойчивыми, составила 0,125, 0,25 и 0,5 мкг/мл. Во 2-м периоде отмечено 2 устойчивых к бензилпенициллину штамма серотипов 14 и 11А. Оба выделены от взрослых пациентов, МПК составила 2,5 и 1,0 мкг/ мл (табл. 2).
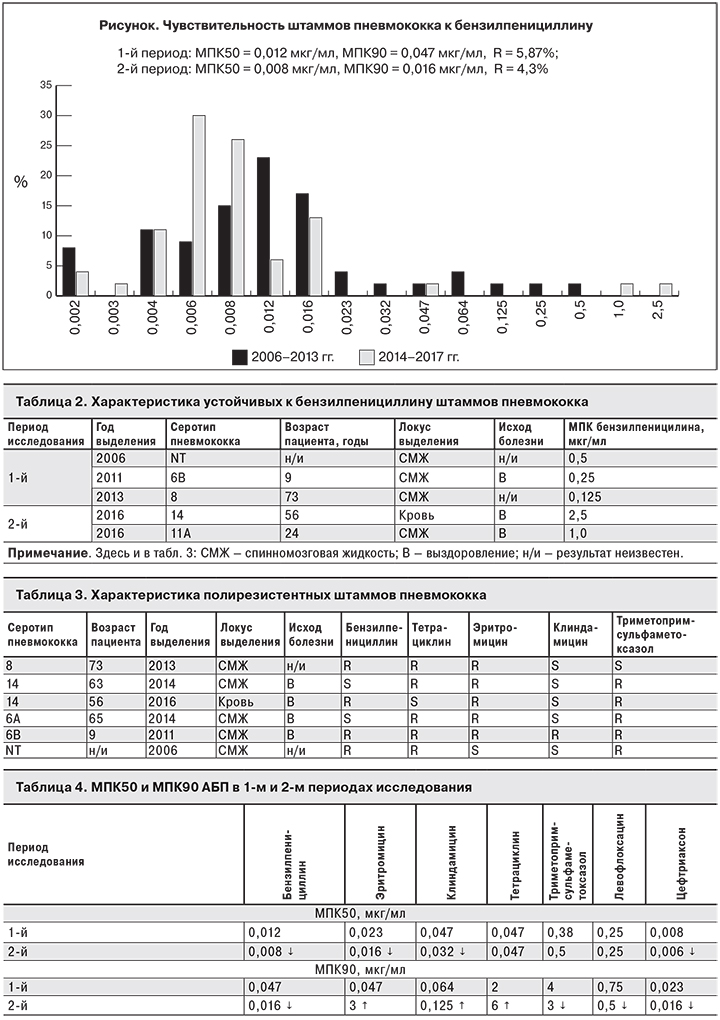
Устойчивые к эритромицину штаммы составили 11,1%. Во 2-м периоде доля устойчивых штаммов была больше, чем в 1-м (17,4 и 5,7% соответственно), МПК90 – ниже в 1-м периоде.
Доля устойчивых к тетрациклину штаммов составила 12,1%. В 1-м периоде исследования их доля была больше, чем во 2-м (13,2 и 10,9% соответственно), а МПК90 тетрациклина в 1-м периоде была ниже.
Устойчивые к клиндамицину штаммы составили 4%. Во 2-м периоде их доля была больше, чем в 1-м (6,5 и 1,9% соответственно). МПК90 была ниже в 1-м периоде.
Доля устойчивых к триметоприм-сульфаметоксазолу штаммов составила 18%: в 1-м периоде исследования – 20,8%, во 2-м – 15,2%. МПК90 оказалась ниже во 2-м периоде.
Все штаммы были чувствительны к левофлоксацину и цефтриаксону, при этом МПК50 и МПК90 были ниже во 2-м периоде исследования. Не было отмечено устойчивых к цефотаксиму, ванкомицину и хлорамфениколу штаммов (по результатам постановки теста с использованием системы ATB STREP 5).
Среди исследованных штаммов 6 (6,1%) оказались полирезистентными, 4 из них имели вакциноассоциированные серотипы 14, 6А и 6В (табл. 3).
Суммируя вышесказанное, можно отметить повышение потенциала чувствительности пневмококка к бензилпенициллину, триметоприм-сульметоксазолу, левофлоксацину, цефтриаксону. В отношении же макролидов (эритромицин, клиндамицин) и тетрациклина отмечено повышение потенциала устойчивости штаммов (табл. 4).
В крупномасштабном исследовании немецких специалистов, изучивших более 22 000 инвазивных штаммов пневмококка за период 1992–2013 г., отмечено снижение чувствительности пневмококка к бензилпенициллину и повышение – к макролидам, что особенно характерно для штаммов, выделенных от детей. При этом если в случае устойчивости к бензилпенициллину имела место замена вакцинных серотипов на невакциннные, то в случае устойчивости к макролидам такой замены не происходило. По-видимому, перераспределение генов, кодирующих устойчивость к макролидам, не так проста, как перераспределение низкоаффинных белков, связывающих пенициллин, ответственных за устойчивость к пенициллинам. В Германии в результате снижения серотипов, включенных в вакцину, произошел сдвиг популяции резистентных пневмококков с одних серотипов на другие не только у вакцинированных детей, но и у невакцинированных детей и взрослых как результат популяционного иммунитета [5]. Снижение покрытия серотипов, входящих в вакцину, как у детей, так и у взрослых отмечено исследователями в других странах Европы [8], а также в Кувейте [9], Израиле [10], на Тайване [11].
В рамках нашего исследования в превакцинальный период из 53 штаммов 6 были выделены от детей, из них 2 штамма были устойчивы к АБП: 1 – серотипа 6В, полирезистентен (устойчив к бензилпенициллину, тетрациклину, эритромицину и клиндамицину и триметоприм-сульфаметоксазолу), 1 – серотипа 19F, устойчив к триметоприм-сульфаметоксазолу. В поствакцинальном периоде из 46 штаммов 3 были выделены от детей, из них 1 принадлежал серотипу 23В, был устойчив к триметоприм-сульфаметоксазолу. В превакцинальном периоде среди штаммов, выделенных от взрослых, устойчивыми к АБП были 10 с серотипами 6B (2 штамма), 19F (2 штамма), 15 (2 штамма) и по 1 с серотипами 3, 23F, 8, 20. В поствакцинальном периоде устойчивыми к АБП были 11 штаммов с серотипами 19F (3 штамма), 14 (3 штамма), и по 1 с серотипами 6А, 23F, 7F, 11А, 25AF. Следовательно, в 1-м периоде устойчивых штаммов, выделенных от детей и покрываемых 13-валентной вакциной, было 2 (серотипы 6B и 19F), во 2-м периоде – ни одного. У взрослых пациентов покрываемых вакциной устойчивых штаммов пневмококка в 1-м периоде было 6 (серотипы 6B, 19F, 23F, 3), а во 2-м – 9 (серотипы 6A, 19F, 23F, 7F, 14) (табл. 5).
Заключение
Несмотря на введение в 2014 г. вакцинопрофилактики против ПИ в РФ, заболеваемость ПМ в нашей стране имеет тенденцию к росту, а летальность характеризуется высокими показателями, достигая 51% среди лиц в возрасте 65 лет и старше. Охват детей прививками против ПИ в целом по РФ растет, но в 2017 г. не достиг целевого показателя. В ряде субъектов страны этот показатель остается ниже 80%.
Уровень резистентности к бензилпенициллину среди инвазивных пневмококковых штаммов составил 5,1%, к эритромицину – 11,1%. Доля полирезистентных штаммов определена на уровне 6,1%. Отмечено повышение потенциала чувствительности пневмококка к бензилпенициллину, триметоприм-сульметоксазолу, левофлоксацину, цефтриаксону. Повышение потенциала устойчивости штаммов выявлено в отношении макролидов и тетрациклина. Все штаммы были чувствительны к левофлоксацину, цефтриаксону, цефотаксиму, ванкомицину и хлорамфениколу.
В серотиповом пейзаже устойчивых штаммов как в превакцинальный период, так и в период после введения вакцинопрофилактики, преобладали серотипы, включенные в 13-валентную конъюгированную пневмококковую вакцину: 6B, 19F, 3, 23F, 18С и 19F, 14, 6А, 23F, 7F.
Перспективой является продолжение мониторинга за лекарственной чувствительностью пневмококка к АБП на фоне проведения вакцинопрофилактики против ПИ. Принимая во внимание тенденцию повышения заболеваемости ПМ, высокие показатели летальности, а также развитие механизмов устойчивости к АБП у штаммов пневмококка, необходимо увеличить охват прививками детей до целевого показателя и расширить программы иммунизации против ПИ.



