С начала широкомасштабного применения антиретровирусной терапии (АРТ) в России в 2006 г. и до настоящего времени растет число пациентов, принимающих антиретровирусные препараты (АРВП) для лечения, до- и постконтактной профилактики ВИЧ-инфекции и профилактики передачи ВИЧ от матери ребенку. Так, охват терапией лиц, живущих с ВИЧ, увеличился в 13 раз (с 4,1% в 2006 г. до 54,8% – в 2020 г.) [1].
Увеличение числа ВИЧ-инфицированных пациентов, принимающих АРВП, позволило не только повысить качество и продолжительность их жизни, но и значительно снизить опасность пациента как источника инфекции [2–5], что сократило количество новых случаев заражения ВИЧ-инфекцией и смертность вследствие СПИДа [6].
Однако АРТ не всегда эффективно подавляет репликацию вируса. Вирусная супрессия у пациентов, принимавших АРВП, в 2011–2018 гг. в России была достигнута в 78% случаев, в 2019 г. – в 76% [7]. Таким образом, не менее 20% ВИЧ-инфицированных пациентов сталкиваются с вирусологической неэффективностью терапии.
Согласно исследованиям [8], в 70–80% случаев причиной вирусологической неэффективности терапии является лекарственная устойчивость (ЛУ) ВИЧ-1, то есть способность вируса реплицироваться в присутствии АРВП.
ЛУ формируется у пациентов с опытом АРТ из-за возникновения мутаций резистентности в результате селективного давления препаратов (приобретенная ЛУ), и у пациентов без опыта терапии в результате передачи им ЛУ вариантов вируса, уже содержащих мутации резистентности (первичная или передаваемая ЛУ).
Анализ ЛУ ВИЧ-1 проводится для клинических и эпидемиологических целей. В первом случае его проводят пациентам для подбора оптимального режима АРТ или корректирования схемы при установлении ее вирусологической неэффективности. Во втором случае анализ проводят уже не на индивидуальном, а на национальном уровне, осуществляя надзор за приобретенной ЛУ у пациентов с неуспехом терапии; ЛУ – у пациентов перед началом АРТ первой линии и у детей младше 18 мес.; в ряде случаев – за передаваемой ЛУ у недавно инфицированных пациентов без опыта терапии [9–11].
В развитых странах тест на ЛУ ВИЧ-1 проводят всем пациентам с вирусологическим неуспехом терапии (ВН > 1000 копий/мл) и перед назначением АРТ первой линии, а также рекомендуют его проведение для пациентов с ВН > 50 копий/мл. Кроме того, тест проводится для надзора за ЛУ-вариантами вируса среди ранее описанных когорт пациентов [8]. Согласно результатам тестирования, в последние годы в развитых странах наблюдается тенденция к увеличению передаваемой ЛУ и снижению приобретенной, что связано с повышением эффективности АРВП, бóльшим количеством доступных схем АРТ, минимизацией ННИОТ-содержащих схем с низким генетическим барьером к развитию резистентности, а также со снижением нежелательных явлений при приеме препаратов, что позволяет повысить приверженность пациентов лечению [12–13].
В России исследования на ЛУ ВИЧ-1 в текущей клинической практике проводятся редко, несмотря на то что число случаев вирусологической неэффективности терапии не снижается. Согласно стандарту первичной медико-санитарной помощи, тест на ЛУ может проводиться для 10% пациентов во время лечения ежегодно. В действительности, согласно анализу закупок тест-систем для проведения исследования на ЛУ ВИЧ-1 в России за 2018–2019 гг., тесты проводили лишь в 5 регионах из 20 исследуемых, и охват тестированием составил 1,3% от числа всех пациентов, принимающих АРТ [14].
Таким образом, в большинстве случаев смена схемы у пациентов, столкнувшихся с вирусологическим неуспехом АРТ, происходит эмпирическим путем. Это связано с трудоемкостью и высокой стоимостью теста на ЛУ ВИЧ-1. Однако отсутствие информации о профиле ЛУ ВИЧ-1 у пациентов с вирусологическим неуспехом терапии, вероятно, повлечет дополнительные расходы на последующие схемы АРТ, которые могут оказаться более значительными, чем стоимость проведения теста на ЛУ. Изменение схем терапии без знания профиля ЛУ может привести к развитию перекрестной резистентности, что еще больше ограничит выбор эффективных АРВП. А на фоне применения неэффективной АРТ, включающей препараты, к которым вирус имеет резистентность, кроме низкого клинического эффекта формируются множественно устойчивые варианты вируса, что также существенно ограничит выбор эффективных схем в будущем.
Помимо недостаточного охвата пациентов тестированием на ЛУ ВИЧ-1 существует также проблема закупок и поставок АРВП в России, что является причиной изменения даже эффективных схем терапии и также предпосылкой к повышению приобретенной ЛУ.
Хотя в России охват тестированием на ЛУ ВИЧ крайне низок, в ряде регионов осуществляется исследование приобретенной ЛУ. Следует отметить работы, проведенные в 23 регионах России (160 пациентов) [15], Сибирском федеральном округе (470 пациентов) [16], в Иркутской (258 пациентов) [17] и Архангельской (76 пациентов) областях [18]. В большинстве остальных работ выборки пациентов не превышали 50 чел. Таким образом, исследования проводились неравномерно в пространстве и времени, а объем выборок недостаточен, что не позволяет экстраполировать полученные данные на страну в целом. Кроме того, ЛУ к все более широко применяемым препаратам класса ИИ оценивали лишь в одном исследовании [17].
Знание профиля ЛУ важно не только для каждого отдельного пациента, но и для популяции ВИЧ- инфицированных в целом. Так, в ходе модельных исследований было показано, что отсутствие мер по выявлению и предотвращению распространения ЛУ вариантов вируса может привести к росту смертности пациентов с ВИЧ-1, заболеваемости ВИЧ-инфекцией и увеличению общих затрат на АРТ, что в конечном счете будет препятствовать усилиям по достижению эпидемического контроля над ВИЧ-инфекцией [19].
В России надзорные исследования по ЛУ ВИЧ-1 на национальном уровне пока не проводятся.
Таким образом, ЛУ ВИЧ-1, являясь основной причиной вирусологической неэффективности АРТ, представляет существенную угрозу для успешной терапии, а значит и для предотвращения распространения ВИЧ-инфекции.
Своевременное выявление ЛУ-вариантов вируса, знание профиля ЛУ ВИЧ-1 на уровне регионов и страны в целом могут способствовать повышению эффективности применения и уменьшению стоимости схем АРТ и минимизировать риск возникновения и дальнейшего распространения ЛУ вариантов вируса.
Цель исследования – оценка распространенности и структуры ЛУ ВИЧ-1 среди пациентов с вирусологической неэффективностью АРТ в России в период с 2013 по 2021 г.
Материалы и методы
В исследовании были использованы образцы плазмы крови от 831 ВИЧ-инфицированного пациента с установленным фактом вирусологической неэффективности применяемой АРТ (вирусная нагрузка > 1 000 копий/ мл) на момент взятия крови для проведения теста на ЛУ ВИЧ-1 в 2013–2021 гг.
Эпидемиологические, демографические и клинические данные, включая опыт применения АРВП для терапии и/ или профилактики ВИЧ-инфекции, были получены из медицинских карт пациентов.
Экстракцию РНК ВИЧ-1 из плазмы крови и секвенирование амплифицированных фрагментов гена pol, кодирующих протеазу, часть обратной транскриптазы (2253-3368 н.п. относительно HXB-2, номер GenBank K03455) и интегразы ВИЧ-1 (4230–5093 н.п.) осуществляли с использованием тест-системы «АмплиСенс® HIV-Resist-Seq» (Центральный НИИ эпидемиологии Роспотребнадзора). Секвенирование очищенных фрагментов проводили с помощью генетического анализатора Applied Biosystems 3500 Genetic Analyzer (Life Technologies, США). Обработку данных секвенирования и получение консенсусной последовательности осуществляли с помощью программного обеспечения «ДЕОНА» (версии 1.2.3, 1.7.0) (ООО РМБит).
Для 831 ВИЧ-инфицированного были получены нуклеотидные последовательности фрагментов гена pol, кодирующих протеазу и часть обратной транскриптазы, для 273 из них дополнительно были получены нуклеотидные последовательности фрагмента гена pol, кодирующего интегразу ВИЧ-1.
Все нуклеотидные последовательности прошли контроль качества, который проводили, используя инструмент WHO BCCfE HIVDR QC (http://pssm.cfenet.ubc.ca/who_qc/).
Для субтипирования ВИЧ-1 были использованы ресурсы HIVdb (v. 9.0) (https://hivdb.stanford.edu/) и REGA HIV-1 Subtyping Tool (v. 3.0) (http://dbpartners.stanford.edu:8080/RegaSubtyping/stanford-hiv/typingtool/).
Для выявления суб-субтипа А6, а также при получении дискордантных результатов нуклеотидные последовательности подвергали дополнительному анализу с помощью ресурса HIV Blast международной базы данных института Лос-Аламос (https://www.hiv.lanl.gov).
Для выявления мутаций резистентности и определения прогностической ЛУ ВИЧ-1 использовали базу данных Стэнфордского университета HIVdb (v. 9.0) (https://hivdb.stanford.edu/), согласно которой каждой мутации и комбинации мутаций присваиваются баллы (drug penalty score), характеризующие вероятность возникновения резистентности вируса к АРВП.
Для оценки чувствительности ВИЧ-1 к АРВП определены 5 уровней ЛУ в зависимости от суммы баллов: чувствительный (0–9 баллов), потенциально низкий (10–14), низкий (15–29), средний (30–59) и высокий (60–100). Потенциально низкий уровень учитывался как чувствительный, согласно рекомендациям ВОЗ по оценке и интерпретации ЛУ ВИЧ-1 [10].
С помощью алгоритма базы данных Стэнфорда была проведена оценка прогностической ЛУ к:
- ингибиторам протеазы (ИП): атазанавиру (ATV), дарунавиру (DRV), фосампренавиру (FPV), индинавиру (IDV), лопинавиру (LPV), нелфинавиру (NFV), ритонавиру (RTV), саквинавиру (SQV), типранавиру (TPV);
- нуклеозидным ингибиторам обратной транскриптазы (НИОТ): абакавиру (ABC), зидовудину (ZDV), ставудину (d4T), диданозину (ddI), эмтрицитабину (FTC), ламивудину (3TC), тенофовиру (TDF);
- ненуклеозидным ингибиторам обратной транскриптазы (ННИОТ): доравирину (DOR), эфавирензу (EFV), этравирину (ETR), невирапину (NVP), рилпивирину (RPV);
- ингибиторам интегразы (ИИ): биктегравиру (BIC), каботегравиру (CAB), долутегравиру (DTG), элвитегравиру (EVG) и ралтегравиру (RAL).
Мутации резистентности и прогностическую ЛУ к отечественному НИОТ фосфазиду (PhАZT) оценивали по ZDV, поскольку препараты являются аналогами.
Мутации резистентности к отечественному ННИОТ элсульфавирину (ESV) оценивали по результатам исследования и согласно инструкции по применению препарата [20].
Достоверность различий частот для несвязанных групп рассчитывали с использованием критерия χ2 Пирсона.
Результаты и обсуждение
Среди 831 ВИЧ-инфицированного с установленной вирусологической неэффективностью продолжительность приема АРВП была известна для 818 (98,4%) пациентов и составила от 1 мес. до 28 лет, Ме – 2,25 года. У 301 пациента на момент исследования не было опыта смены терапии, у 530 число схем варьировало от 2 до 14, Ме – 2.
ВН в образцах составляла от 1 000 до 10 000 000 копий/ мл, Ме – 17 600 копий/мл.
Из 662 (79,7%) пациентов с известным уровнем приверженности терапии, получаемой на момент забора крови для настоящего исследования, высокий уровень (прием более 95% предписанных врачом доз, со слов пациента) был установлен для 186 (28,1%) чел., средний (70–95% доз) – для 245 (37%) и низкий (менее 70% доз) – для 231 (34,9%).
Среди пациентов было 496 (59,7%) мужчин. Средний возраст пациентов на момент забора крови для проведения тестирования на ЛУ ВИЧ-1 составил 36,6 года, Ме – 37 лет.
Год первого положительного результата иммунного блоттинга был известен у 798 (96,1%) пациентов. Результаты были получены в 1992–2021 гг., у 775 (97,1%) – в период с 2000 по 2019 г.
У 676 (81,3%) пациентов был известен предполагаемый путь заражения ВИЧ-инфекцией: у 433 (64,1%) – половой, в том числе у 251 (37,1%) – гетеросексуальный, у 7 (1,0%) – гомосексуальный и у 175 (25,9%) – неуточненный. У 213 (31,5%) пациентов был установлен парентеральный путь заражения ВИЧ-инфекцией при внутривенном введении наркотиков. 29 (4,3%) пациентов сообщили о вертикальном пути передачи ВИЧ-1 и 1 (0,1%) – о пребывании в нозокомиальном очаге.
Выборка включала пациентов из всех федеральных округов: Сибирского (60 чел.; 7,2%), Южного (35; 4,2%), Приволжского (17; 2,0%), Северо-Кавказского (2; 0,2%), Северо-Западного (1; 0,1%), Уральского (1; 0,1%), Дальневосточного (1; 0,1%). Преобладали пациентов из Центрального федерального округа (714; 85,9%).
 В результате субтипирования в большинстве случаев был определен генетический вариант ВИЧ-1, доминирующий в России и странах постсоветского пространства – суб-субтип А6 (728 чел.; 87,6%). Реже обнаруживали субтипы B (59; 7,1%), G (2; 0,2%) и C (1; 0,12%). В 41 (4,9%) образце были определены циркулирующие рекомбинантные формы ВИЧ-1: CRF 02_AG (21; 2,5%), CRF63_02A1 (15; 1,8%), CRF03_AB (2; 0,2%), CRF 14_BG (2; 0,2%) и CRF 01_AE (1; 0,1%).
В результате субтипирования в большинстве случаев был определен генетический вариант ВИЧ-1, доминирующий в России и странах постсоветского пространства – суб-субтип А6 (728 чел.; 87,6%). Реже обнаруживали субтипы B (59; 7,1%), G (2; 0,2%) и C (1; 0,12%). В 41 (4,9%) образце были определены циркулирующие рекомбинантные формы ВИЧ-1: CRF 02_AG (21; 2,5%), CRF63_02A1 (15; 1,8%), CRF03_AB (2; 0,2%), CRF 14_BG (2; 0,2%) и CRF 01_AE (1; 0,1%).
Таким образом, исследуемая выборка включала все основные генетические варианты ВИЧ-1, циркулирующие в России, с некоторым смещением их распределения, характерным для образцов из Центрального федерального округа [21].
В результате анализа фрагмента гена pol, кодирующего протеазу вируса, было установлено, что частота встречаемости мутаций резистентности в этом регионе была самой низкой. Обнаружены лишь 4 позиции, в которых встречались замены более чем у 1% пациентов. Чаще всего были обнаружены замены M46I/L/V (41; 4,9%). Согласно базе данных Стэнфорда, M46I и M46L встречаются примерно у 20 и 10% пациентов, получавших ИП, соответственно и снижают восприимчивость вируса к ATV, FPV, IDV, LPV и NFV. Влияние мутации M46V на чувствительность вируса к ИП изучено недостаточно. Мутации в данной позиции также наиболее часто встречаются к ИП и среди пациентов, ранее не получавших АРВП [22], однако они не являются полиморфными, поскольку встречались у нелеченых пациентов с частотой менее 1%.
У 30 (3,6%) пациентов были выявлены неполиморфные замены I50V/L. Мутация I50V снижает восприимчивость к FPV, LPV, DRV и, наоборот, повышает – к TPV. Замена же I50L оказывает другое влияние на вирус, увеличивая его восприимчивость ко всем ИП, кроме ATV, к которому вызывает устойчивость высокого уровня.
Полный перечень мутаций с частотой встречаемости более 1% представлен в табл. 1.
Нуклеотидные последовательности фрагмента гена pol, кодирующего часть обратной транскриптазы ВИЧ-1, содержали наибольшее количество мутаций резистентности, преимущественно к НИОТ. Самыми часто встречаемыми мутациями являлись M184V/I, они была выявлены у 559 (67,3%) пациентов. Данные мутации возникают под воздействием 3TC, FTC, ABC и ddI и вызывают к первым 2 препаратам ЛУ высокого уровня, ко вторым – низкого. Замены повышают чувствительность к ZDV/PhAZT, d4T и TDF, а также замедляют появление мутаций резистентности к ним, что при обнаружении таких замен в профиле резистентности позволяет рекомендовать сохранение схемы АРТ, включающей 3TC и близкородственный ему FTC [8]. Стоит отметить, что мутация M184V отмечалась как часто передаваемая от пациентов с неуспехом терапии наивным пациентам, что говорит о важности надзора за ней [11].
Следующей по частоте встречаемости была высокополиморфная мутация A62V (292; 35,1%), характерная для вирусов суб-субтипа А6 и самостоятельно не вызывающая ЛУ [23].
У 166 (20%) пациентов была обнаружена мутация K65R, которая возникает при селективном воздействии TDF, ABC, d4T, ddI и ассоциируется со снижением восприимчивости вируса к ним. Данная мутация имеет важное клиническое значение, поскольку при ее наличии в присутствии мутации M184V/I рекомендуется менять схему терапии, включающую ABC, TDF, d4T и 3TC. Кроме того, эта мутация повышает чувствительность вируса к ZDV/PhAZT.
Часто выявляли классические тимидин-аналоговые мутации в позициях 67 (99; 11,9%), 70 (95; 11,4%), 215 (91; 11,0%), 219 (86; 10,3%) (см. табл. 1). Они являются неполиморфными, возникают при воздействии аналогов тимидина ZDV/PhAZT и d4T и ассоциированы с ЛУ разного уровня к ним, а в сочетании друг с другом могут снижать чувствительность вируса еще и к ABC, ddI и TDF.
У 90 (10,8%) пациентов были обнаружены мутации L74V/I, которые возникают при приеме ABC, ddI и реже – при длительной неэффективной терапии у принимающих TDF [8]. Замены в этом положении ассоциированы с резистентностью к ABC, ddI и повышением чувствительности вируса к ZDV/PhAZT и TDF.
Следует отметить, что мутации M184V/I, K65R, T215Y и L74V ассоциированы со значительным снижением фитнеса вируса, что в ряде случаев позволяет сохранять текущую схему терапии и поддерживать терапевтический эффект, несмотря на выявленную прогностическую устойчивость вируса, поскольку его репликация происходит медленно [24].
Среди мутаций к ННИОТ наиболее часто встречались G190A/C/E/Q/S/T (304; 36,6%), возникающие при приеме NVP и EFV и вызывающие ЛУ к ним. Ранее была описана предрасположенность вирусов суб-субтипа А6 к формированию замены G190S, поскольку для ее появления необходима замена лишь 1 нуклеотида в вирусе «дикого» типа [25].
Следующие по распространенности мутации к ННИОТ (210; 25,3%) ассоциированные с ЛУ к ним различного уровня в зависимости от замены, были в положении 101.
У 166 (20%) пациентов были обнаружены мутации K103N/S, имеющие важное клиническое значение. Они возникают под действием NVP и EFV и значительно снижают чувствительность вируса к этим препаратам.
Данные мутации важны и с точки зрения надзора за ЛУ-вариантами вируса, поскольку они часто передаются и способны сохраняться в течение многих лет даже при отсутствии селективного давления препаратов [26–28].
У 163 (19,6%) пациентов были обнаружены мутации Y181C/I/V, возникающие при селективном воздействии NVP, EFV, ETR и RPV. Они снижают чувствительность вируса ко всем ННИОТ, в том числе к ESV.
Мутации в позициях 103, 181, 190 были также наиболее частыми у наивных пациентов [22], не являясь при этом полиморфными.
В участке гена pol, кодирующем интегразу ВИЧ-1, распространенность мутаций резистентности была довольно низкой. Так, у 19 (7%) пациентов выявлены неполиморфные мутации Y143C/G/H/R. Y143C/R возникают под селективным давлением RAL и вызывают ЛУ к нему и к EVG. Y143H – менее распространенная мутация в этой позиции, является переходной от аминокислоты Y вируса «дикого» типа к аминокислоте R устойчивого вируса. Замена Y143G также является редкой, возникает при приеме RAL и снижает восприимчивость вируса к нему. Остальные мутации резистентности к ИИ были выявлены менее чем в 5% случаев.
Структура ЛУ значительно варьирует в зависимости от опыта приема АРВП и приверженности пациентов терапии, однако основные паттерны схожи. Так, мутации ЛУ к ИП обнаруживают не более чем у 10% пациентов с вирусологическим неуспехом схемы, включающей ИП, что согласуется с полученными нами данными. Известно, что на фоне применения НИОТ обычно развивается ЛУ, связанная с появлением мутаций M184V/I. Это же подтвердили и результаты данного исследования, поскольку большинство схем первой линии терапии содержат аналоги цитидина. В профиле ЛУ к ННИОТ наиболее частыми являются мутации K103N, Y181C, G190A/S и V106M, что согласуется с нашими данными. Мутации ЛУ к ИИ появляются в редких случаях [8], что также подтверждено в нашем исследовании.
При оценке прогностической ЛУ у пациентов с вирусологической неэффективностью терапии в 685 (82,4%) случаях была выявлена резистентность хотя бы к одному АРВП: наиболее часто – к НИОТ (617; 74,2%) и ННИОТ (559; 67,3%), реже – к ИИ (33; 12,1%) и ИП (80; 9,6%).
Наиболее часто среди НИОТ ЛУ была обнаружена к ABC (608; 73,2%), FTC (602; 72,4%) и 3TC (602;72, 4%), причем к последним двум – преимущественно высокого уровня; среди ННИОТ – к EFV (527; 63,4%) и NVP (532; 64,0%) в основном также высокого уровня. Данные о высоком уровне ЛУ к EFV поддерживают решение об оптимизации схемы первой линии АРТ и замене его на DTG [29–30].
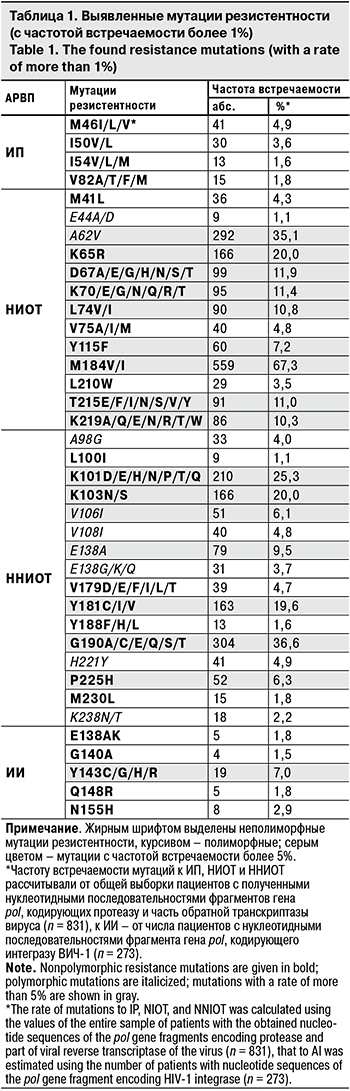
Чувствительность вируса к АРВП у пациентов с вирусологическим неуспехом терапии представлена на рис. 1. Чувствительность к ИП, НИОТ и ННИОТ рассчитывали от общей выборки пациентов с полученными нуклеотидными последовательностями фрагментов гена pol, кодирующих протеазу и часть обратной транскриптазы (n = 831), а к ИИ – от числа пациентов с нуклеотидными последовательностями фрагмента гена pol, кодирующего интегразу ВИЧ-1 (n = 273)
Следует отметить, что у большего числа пациентов с вирусологическим неуспехом АРТ сохранена чувствительность вируса ко всем ИП и ИИ. Кроме того, более чем у 50% таких пациентов чувствительность вируса отмечена к НИОТ [ZDV и PhAZT (701; 84,4%), TDF (559; 67,3%), d4T (521; 62,7%)] и ННИОТ [ETR (486; 58,5%)]. Эти препараты могут являться потенциально эффективными для пациентов, столкнувшихся с вирусологическим неуспехом АРТ. Причиной сохранения восприимчивости вируса является высокий генетический барьер к развитию резистентности, особенно к ИП, бустированных RTV, или к ETR, который имеет самый высокий генетический барьер среди ННИОТ, а также к ИИ в связи с их пока еще редким применением [8].
У 146 (17,6%) из 831 пациентов резистентность не выявлена, при этом не выявлено и достоверного отличия при анализе приверженности пациентов АРТ, что согласуется с результатами других исследований [8].
Мы проанализировали корреляции между возникновением ЛУ и характеристиками пациентов и вирусов.
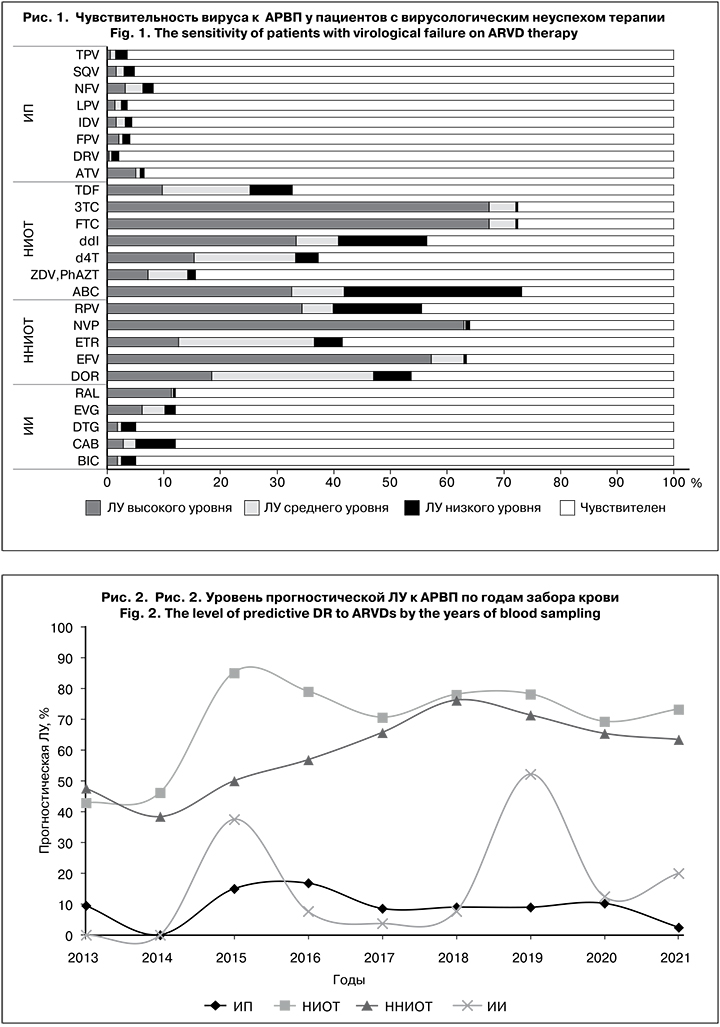
Была проведена оценка динамики изменения распространенности прогностической ЛУ к разным классам АРВП в зависимости от года забора крови (рис. 2). Прослеживалась тенденция к росту ЛУ к НИОТ и ННИОТ, что связано с их широким применением в схемах АРТ, низким генетическим барьером к развитию резистентности и широким профилем перекрестной резистентности препаратов. Прогностическая ЛУ к ИП оставалась на низком уровне весь период наблюдения и не имела тенденции к росту. Интересно, что резистентность к ИИ начали выявлять только с 2015 г., и сразу был отмечен ее пик (37,5%), который повторился в 2019 г. (52,2%).
Нами не было выявлено достоверной корреляции между возникновением ЛУ и приверженностью пациентов АРТ, хотя известно, что умеренная приверженность является предпосылкой к возникновению ЛУ. Возможно, это связано с тем, что приверженность оценивалась субъективно, со слов пациентов.
При изучении корреляции между возникновением ЛУ ВИЧ-1 и длительностью АРТ ЛУ была обнаружена у 76,4% пациентов, принимавших АРВП до 1 года, у 84,7 и 83,1% пациентов с длительностью терапии до 4 лет и 5–10 лет соответственно и у 87,9% пациентов с опытом терапии более 10 лет, однако достоверно различались только 2 первые группы (χ2 = 0,012).
Статистически достоверную оценку уровня ЛУ в федеральных округах провести не удалось из-за недостаточного размера выборки в ряде округов, что указывает на необходимость централизованного сбора данных о резистентности в разных регионах.
Не было выявлено достоверных корреляций между количеством применяемых схем АРТ, полом, возрастом, путем заражения пациента и ЛУ ВИЧ-1.
Далее мы проанализировали выявленные паттерны ЛУ в контексте истории лечения пациентов, оценивая отдельно препараты, которые пациент принимал когда-либо; препараты, которые были в схеме АРТ с вирусологической неэффективностью, или их отсутствие в истории (табл. 2).
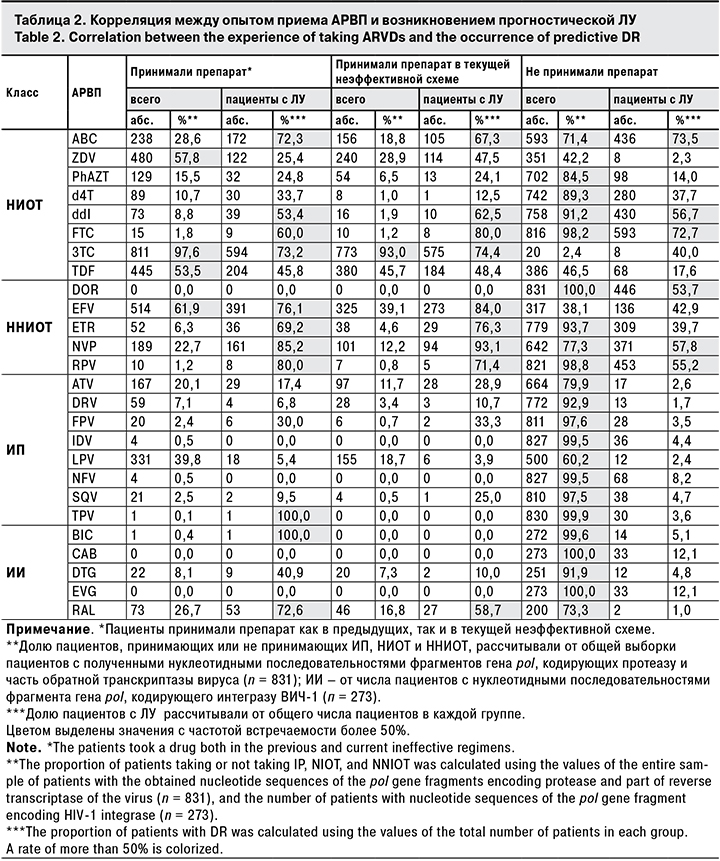
Чаще всего применяли НИОТ: 3TC (811; 98%), ZDV (480; 58%), TDF (445; 54%), ABC (238; 29%); НИОТ: EFV (514; 62%), NVP (189; 23%); ИП: LPV (331; 40%) и ATV (167; 20%); ИИ: RAL (73/273; 27%) и DTG (22/273; 8%)].
При приеме НИОТ отмечен высокий уровень ЛУ. Так, резистентность к 3TC была обнаружена у 73% пациентов, когда-либо принимавших этот препарат, и у 74% пациентов, принимавших его в текущей схеме. Высокие уровни ЛУ выявлены также при приеме ABC (72 и 67% соответственно), ddI (53 и 63%), TDF (46 и 48%) и ZDV (25 и 48%). ЛУ к ZDV, в отличие от других АРВП, отмечали только при его приеме.
Самая высокая частота возникновения ЛУ выявлена при приеме ННИОТ: NVP (85 и 93%), EFV (76 и 84%) и ETR (69 и 76%), самая низкая – при приеме ИП: FPV (30 и 33%), ATV (17 и 29%) и SQV (10 и 25%).
При приеме ИИ RAL резистентность была обнаружена у 73 и 59% у пациентов, ЛУ к DTG возникала реже – у 41 и 10%. В тех случаях, когда уровень ЛУ при приеме препарата когда-либо был выше, чем при его приеме в текущей схеме, можно предположить, что ЛУ-варианты вируса сохраняются в мажорной популяции. Верным может быть также и обратное заключение: в случае, когда уровень ЛУ выше в текущей схеме, можно предположить, что мутации резистентности становятся минорными.
Особый интерес представляли случаи резистентности вируса к АРВП при отсутствии опыта их приема.
Чаще всего в таких случаях ЛУ возникала к НИОТ: ABC (74%), FTC (73%), ddI (57%) и d4T (38%), причем последние 3 препарата редко применяют в схемах АРТ. Высокая частота ЛУ была установлена ко всем ННИОТ: NVP (58%), RPV (55%), DOR (54%), EFV (43%) и ETR (40%). Следует отметить, что RPV применяют в России довольно редко, а DOR не применяют вообще. В отличие от НИОТ и ННИОТ, к ИП и ИИ резистентность вируса в отсутствии их приема возникает редко. Среди ИП следует отметить NFV (8%), среди ИИ – CAB (12%) и EVG (12%), которые в России не применяются.
Важно было проанализировать распространенность ЛУ одновременно к нескольким классам АРВП (мультирезистетность). Для этого мы распределили пациентов на 2 группы: 1-я группа – те, для кого были получены нуклеотидные последовательности фрагментов гена pol, кодирующих только протеазу и часть обратной транскриптазы (п = 558) и 2-я группа – лица, для которых были также получены нуклеотидные последовательности фрагмента гена pol, кодирующего интегразу ВИЧ-1 (п = 273).
ЛУ только к одному классу АВРП была обнаружена у 15,4% пациентов 1-й группы: к ИП – у 0,5%, к НИОТ – у 8,2%, к ННИОТ – у 6,6% и у 19,8% пациентов 2-й группы: к ИП – у 0,7%, к НИОТ – у 9,9%, к ННИОТ – у 8,4% и к ИИ – у 0,7%. В остальных случаях была обнаружена ЛУ к 2 и более классам АРВП (табл. 3).

В обеих группах чаще всего выявляли резистентность одновременно к 2 классам препаратов – НИОТ + ННИОТ (57 и 45,8% соответственно). Это связано с широким применением схемы АРТ, содержащей 2 НИОТ и 1 ННИОТ. Реже всего обнаруживали ЛУ одновременно к ИП и ННИОТ (0,2 и 0,0%). Резистентность сразу к 4 классам АРВП встречалась лишь у 1,1% пациентов 2-й группы.
ЛУ к 3 и 4 классам АРВП одновременно, вероятно, является следствием несвоевременной замены препаратов в схеме из-за недоступности новых препаратов или из-за отсутствия возможности подбора АРВП с учетом генотипа вируса.
Заключение
Настоящее исследование представляет собой анализ самой большой выборки пациентов с вирусологической неэффективностью терапии в России и дополняет имеющиеся данные о паттернах ЛУ среди пациентов с опытом АРТ.
У 82,4% пациентов с неуспехом терапии обнаружено снижение восприимчивости вируса хотя бы к одному АРВП.
Наиболее часто ЛУ была выявлена к препаратам классов НИОТ (74,2%) [ABC (73,2%), FTC (72,4%) и 3TC (72,4%)] и ННИОТ (67,3%) [EFV (63,4%) и NVP (64,0%)], реже – к ИИ (12,1%) [CAB (12,1%), EVG (12,1%), RAL (12,1%)] и ИП (9,6%) [NFV (8,2%), ATV (6,6%)], что не во всех случаях совпадает с наиболее применяемыми препаратами и объясняется перекрестной ЛУ.
Преимущественно была установлена резистентность одновременно к 2 классам препаратов – НИОТ + ННИОТ (57 и 45,8% соответственно).
Полученные результаты указывают на необходимость централизованного проведения генотипирующего теста пациентам с вирусологической неэффективностью АРТ для подбора эффективных схем терапии, а также минимизации возникновения и дальнейшего распространения резистентных вариантов ВИЧ-1 на территории России.



