Страны бывшего Советского Союза, многие из которых входят в состав содружества независимых государств (СНГ), исторически имеют общую историю и тесные социально-экономические связи. К несчастью, это приводит к тому, что масштабные эпидемии инфекционных заболеваний становятся общими для всех этих стран. Так произошло и с эпидемией ВИЧ-инфекции.
В регионе Восточной Европы и Центральной Азии (ВЕЦА) в период с 2010 по 2018 г. наблюдался тревожный рост ежегодных показателей заболеваемости на 29% [1]. В России, наиболее крупной стране региона, на конец 2020 г. было зафиксировано 1 492 998 чел. с подтвержденным диагнозом «ВИЧ-инфекция»1.
В настоящее время в мире описано 10 субтипов ВИЧ-1 [2, 3]. Однако для некоторых из них (например, для субтипа A) описан целый ряд генетических вариантов (A1–A8). Кроме этого, в мире выявлена циркуляция 118 рекомбинантных форм вируса [2].
Поскольку эпидемии ВИЧ-инфекции в странах ВЕЦА связаны между собой, картина генетического разнообразия ВИЧ-1 во всех странах региона имеет схожие черты.
В настоящее время на территории региона ВЕЦА циркулируют несколько генетических форм ВИЧ-1. Доминирующим вариантом является субсубтип A6, чье лавинообразное распространение по территории стран бывшего СССР началось в середине 1990-х гг. после его проникновения в среду потребителей инъекционных наркотиков (ПИН) [4–8]. Вторым наиболее часто встречающимся вариантом является рекомбинантная форма CRF63_02A1, в последние годы активно распространяющаяся в странах Центральной Азии и в Сибирском регионе России [7, 9]. Кроме этого, на постсоветском пространстве циркулируют 2 варианта ВИЧ-1 субтипа B: B Western, характерный для стран Западной Европы, и IDU-B, впервые выявленный в Николаеве (Украина) в начале 2000-х гг. [8, 10–12]. Наконец, отмечается циркуляция более редко встречающихся генетических форм: субтипа C в дальневосточном регионе России [10, 13], CRF03_AB в Калининграде и Беларуси [12, 14], субтипа G – отголоска нозокомиальной вспышки ВИЧ- инфекции – в Элисте (Россия) в 1988–1990 гг. [15, 16], а также BG-рекомбинантов, генетически близких к вирусам, циркулирующим в Испании и Португалии [15], и новых A6/B рекомбинантных форм, выявляемых в Москве [17].
Исторически в странах ВЕЦА не отмечалось достоверной разницы между генетическим разнообразием ВИЧ-1 в разных уязвимых группах. Исключение составляла лишь группа мужчин, практикующих секс с мужчинами (МСМ), где изначально доминировал B Western [11, 12, 17]. Однако исследование 2017 г. показало, что доля вируса субсубтипа A6 среди образцов от МСМ, собранных в 2006–2016 гг., составила 19,4%, что свидетельствует о размытии границ между группами риска в стране [11].
Во всех странах бывшего СССР одним из важнейших факторов распространения эпидемии ВИЧ-инфекции является миграция. Так, с конца 80-х гг. прошлого века и к началу 2000-х из одной только Армении эмигрировали около 1 млн чел., значительная часть которых обосновалась в России и странах СНГ, став постоянными или сезонными мигрантами. При этом, по разным данным, от 70 до 80% случаев ВИЧ-инфекции среди граждан Армении так или иначе было связано с миграцией [18, 19]. Более 90% образцов ВИЧ-1, собранных от граждан Армении в 2009–2010 гг., относилось к варианту A6, и лишь единичные случаи инфекции приходились на IDU- B, CRF02_AG и CRF03_AB [18]. В последние годы распределение вариантов ВИЧ-1 в стране изменилось незначительно. Так, в 2017–2019 гг. на долю субсубтипа A6 приходилось чуть более 87% образцов ВИЧ-1 с неизменной циркуляцией вируса субтипа B и отдельными случаями инфекции рекомбинантными формами вируса [19].
Практически идентичная картина по распространению генетических вариантов ВИЧ-1 характерна для соседствующего с Арменией Азербайджана. Несмотря на то что Азербайджан граничит с Ираном, исследования прежних лет указывают на то, что в Азербайджане доминирует генетический вариант A6 [20, 21]. Отмечаются лишь отдельные случаи инфекции такими вариантами, как IDU-B, CRF03_AB и A1, характерными для стран Восточной Африки [20]. В то же время в Азербайджане не описаны случаи инфекции доминирующим в Иране вариантом CRF35_A1D [2].
Доминирование субсубтипа A6 и циркуляция субтипа B еще в начале 2000-х гг. отмечались и в Беларуси [22].
В Киргизии отмечают инфекции как субсубтипом A6 и CRF63_02A1, так и субэпидемия CRF02_AG – генетического предка CRF63_02A1 [23].
В Узбекистане широко распространен CRF63_02A1, поскольку этот рекомбинант образовался именно в этой стране в 90-х гг. прошлого века. Вторым по распространению является вариант A6 [7, 12].
Хуже всего охарактеризовано генетическое разнообразие ВИЧ-1 в Таджикистане. В соответствии с международными базами данных в этой стране доминируют те же варианты, что и в других странах ВЕЦА: A6, CRF63_02A1 и CRF02_AG [2].
Ранее было проведено исследование, посвященное частоте встречаемости мутаций лекарственной устойчивости ВИЧ-1 среди пациентов из стран ВЕЦА без опыта терапии или прерывавших ее на срок более 3 мес. [24]. Однако в рамках этой работы не проводилось детальной характеристики генетических вариантов, циркулирующих на территории этих стран.
Цель исследования – характеристика генетических вариантов ВИЧ-1, циркулировавших на территории стран ВЕЦА, в период 2010–2019 гг.
Материалы и методы
Был проведен сбор образцов плазмы крови от ВИЧ-инфицированных пациентов из России (RU), Армении (AM), Азербайджана (AZ), Белоруссии (BY), Киргизии (KG), Таджикистана (TJ) и Узбекистана (UZ).
Вместе с образцами были собраны следующие эпидемиологические данные: информация о половой принадлежности пациента и пути передачи ВИЧ- инфекции, а также дата забора образца. По возможности собирали информацию о регионе проживания в стране, дате постановки диагноза и возрасте пациента.
Были получены нуклеотидные последовательности региона pol (позиции 2253–3344 референсного штамма HXB-2, номер GenBank K03455), кодирующего протеазу, и фрагмент обратной транскриптазы ВИЧ-1. Секвенирование проводили с помощью набора реагентов «АмплиСенс HIV-Resist-Seq» (Центральный НИИ эпидемиологии, Россия) и генетического анализатора Applied Biosystems (LifeTechnologies, США).
Полученная выборка была дополнена нуклеотидными последовательностями из международной базы данных ВИЧ-1 института Лос-Аламос (США) [2].
Проведен последовательный анализ, включающий предварительное определение генетического варианта с помощью HIVBlast [2], филогенетического анализа в программе MEGA 6.0 [25] и рекомбинационного анализа в программах RIP 3.0. [2] и jpHMM [26].
Молекулярные кластеры выявляли с помощью программного обеспечения PhyloPart v2.1 с ограничением генетической дистанции образцов (sample distance limit) 5000, порогом (threshold) 0.045 и bootstrap поддержкой кластеров более 90%.
Для оценки статистической достоверности различий качественных показателей использовали точный двусторонний критерий Фишера. Различия считали достоверными при p < 0,01 [27].
Результаты
Поскольку присутствие мутаций лекарственной устойчивости в нуклеотидных последовательностях не только не влияет на оценку их генетической схожести, но даже не искажает результаты кластерного анализа [28], в своем исследовании мы анализировали нуклеотидные последовательности ВИЧ-1 из образцов, полученных от пациентов какс опытом терапии, так и без него.
Были получены нуклеотидные последовательности для 1100 образцов, еще 725 нуклеотидных последовательностей (472 из России и 253 из Узбекистана) было загружено из международной базы данных. Таким образом, был проведен анализ 1825 нуклеотидных последовательностей из исследуемых стран. Поскольку с 2010 г. исследования по эпидемиологическому мониторингу ВИЧ-инфекции в странах ВЕЦА проводились с разной интенсивностью, распределение исследованных нами образцов по дате забора образца сильно различались. Так, все образцы из стран, участвующих в исследовании, кроме образцов из России, были собраны в период 2015–2019 гг. Несмотря на то что сбор образцов из России был более равномерным и российская выборка доминировала в исследуемой коллекции, 1100 (60,27%) образцов было собрано в период 2017–2019 гг. Поскольку страны ВЕЦА находятся в тесной экономической связи, что обуславливает общее эпидемическое пространство, мы выделили 3 временных периода, относительно равномерно распределяющих между собой исследуемую коллекцию образцов: 2010–2014 (n = 271), 2015–2017 (n = 786) и 2018– 2019 гг. (n = 768). Кроме этого, анализ проводили для каждой страны отдельно для понимания влияния уникальных особенностей эпидемии в каждой из них на общую эпидемиологическую картину.
Средний возраст пациентов, у которых была известна дата рождения (1097 или 60,11%), составлял 37 лет (95% ДИ 36,51–37,77). Для 1246 (68,27%) пациентов была известна дата постановки диагноза. Средний временной период от момента постановки диагноза до забора образца для этих пациентов составлял 3,12 года (95% ДИ 2,89–3,34). Результаты анализа остальной эпидемиологической информации приведены в табл. 1, 2.
В исследованной выборке наиболее частым путем инфицирования являются гетеросексуальные контакты – образцы от 823 (45,1%) пациентов. Стоит отметить, что 301 (16,49%) образец получен от пациентов, о которых было известно, что их заражение произошло в результате половых контактов без уточнения половой ориентации. Учитывая, что 90 из них были женщинами, велика вероятность принадлежности их к уязвимой группе гетеросексуалов. Таким образом, вероятная доля гетеросексуальной передачи ВИЧ-1 в исследованной коллекции составила 50,03% (913 образцов).
На долю образцов, включающих пробы от пациентов с гетеросексуальным путем заражения, и женщин, инфицированных в результате незащищенного секса, в 2010–2014 гг. приходилось 49%, а в 2015–2017 и 2018–2019 гг. – 48,7 и 51,7% соответственно. Небольшое снижение доли таких образцов в период 2015–2017 гг. связано с тем, что 15,52% из них в этот период было получено от пациентов, пребывавших в нозокомиальных очагах (против 4,06 и 2,86% в 2010–2014 и 2018–2019 гг. соответственно).
Примечательно то, что доминирующий в конце 1990-х и начале 2000-х гг. путь передачи в результате потребления инъекционных наркотиков [12] в нашем исследовании был отмечен лишь для 386 (21,15%) пациентов. При этом в период 2010–2014 гг. на долю ПИН приходилось достоверно значительно больше случаев ВИЧ-инфекции (38,4%), чем в 2015–2017 (14,9%) и 2018–2019 гг. (21,5%), (p < 0,01) [27]. Процент МСМ незначительно отличался во все временные периоды, делая эту уязвимую группу наименее представленной в эпидемическом процессе на протяжении 2010–2019 гг.
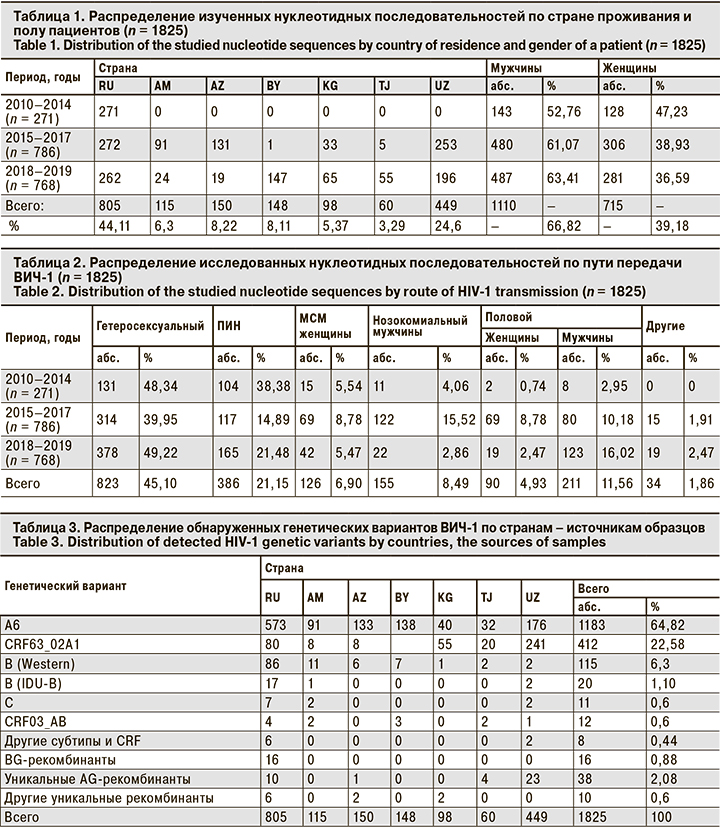
Было установлено, что 1183 (64,82%) образца относились к ВИЧ-1 субсубтипа A6 (табл. 3, 4). Причем образцы этого генетического варианта образовали 2 крупные ветви на дендрограмме, одна из которых оказалась внешней для второй ветви A6 и ветвей, образованных такими генетическими вариантами, как субтипы B, субтип C и CRF03_AB (рис. 1). Вероятно, это связано с тем, что в исследованной коллекции большинство образцов относились к субсубтипу A6, что сделало вирусы данного генетического варианта «внешней» группой.
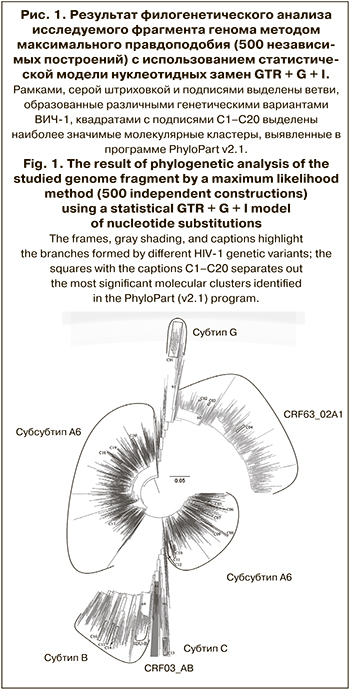
Вторым по численности оказался рекомбинантный вариант CRF63_02A1, обнаруженный в 412 (22,58%) образцов. Чаще всего этот вариант вируса выявляли в Узбекистане (241/449, 53,67%) и в Киргизии (55/98, 56,12%), в меньшей степени – в Таджикистане (20/60, 33,33%) и России (80/805, 9,94%). Это согласуется с ранее опубликованными данными об активном распространении этого рекомбинанта в странах Центральной Азии [7].
Для 58 образцов, образовавших на дендрограмме общую ветвь совместно с вирусами CRF63_02A1 (см. рис. 1), были получены неоднозначные результаты генотипирования в HIVBlast, расценившего их как различные уникальные рекомбинантные формы. Детальный рекомбинационный анализ позволил достоверно определить генетическую принадлежность к CRF63_02A1 для 56 (96,55%) из них.
Всего 135 (7,40%) образцов относились к субтипу B. Дополнительный филогенетический анализ позволил установить, что 20 из них относились к варианту IDU-B. 2 образца этого варианта были получены в Узбекистане, 1 в Армении, 17 в России. Из них 14 образцов были получены в Дальневосточном регионе страны – географическом регионе, где широко циркулирует данный генетический вариант [10, 13]. Остальные 115 образцов относились к субтипу B, типичному для стран Западной Европы (B Western).
В общей сложности 19 образцов с достоверностью 91% образовали общую ветвь с референтами субтипа G, выделенными в разных регионах мира в разные годы. Внутри этой ветви образцы достоверно разделялись: 1 образец относился к субтипу G – следствию внутрибольничной вспышки в г. Элиста 1988–1990 гг. [16] и генетически близкому к субтипу G из Конго и Камеруна; 16 образцов относились к недавно описанным BG-рекомбинантным формам [15] и с достоверностью 97% кластеризовались вместе с G-вариантам из Испании и Португалии. Еще 2 образца, выделенные от женщин из Южно-Сахалинска в 2013 г., относились к субтипу G, генетически близкому к варианту субтипа G, выделенному в США в 2016 г., что не связывает его со вспышкой в Элисте.
Лишь 12 образцов CRF03_AB было выявлено в исследованной группе. Также было обнаружено 2 образца CRF02_AG и по 1 образцу CRF01_AE, CRF06_cpx и CRF11_cpx.
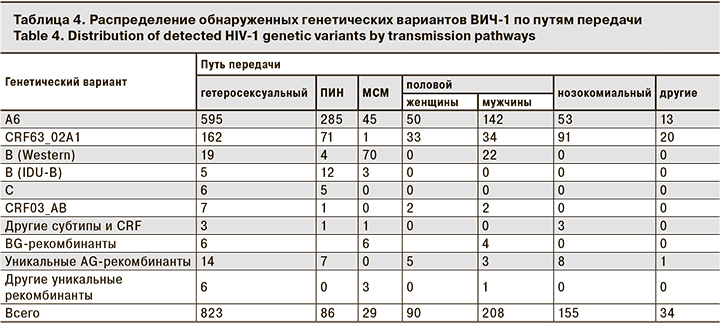
Наконец, нами было выявлено 48 образцов, которые можно отнести к уникальным рекомбинантным формам (unique recombinant forms, URFs). Примечательно, что 38 из них были AG-рекомбинантами, образующими одну ветвь с CRF63_02A1. Это свидетельствует о значительном генетическом разнообразии среди AG-рекомбинантов, первоначально относимых к CRF63_02A1. Наиболее часто эти уникальные AG-рекомбинанты выявляли в Узбекистане (28/38), что вполне естественно, учитывая, что данная страна является наиболее вероятным местом образования CRF63_02A1 [7] и основным источником этого варианта в нашей коллекции.
Анализ точек рекомбинации позволил разделить обнаруженные 48 URFs на 5 основных групп (URF1-URF5), 4 из которых приходились на AG-рекомбинанты (рис. 2).
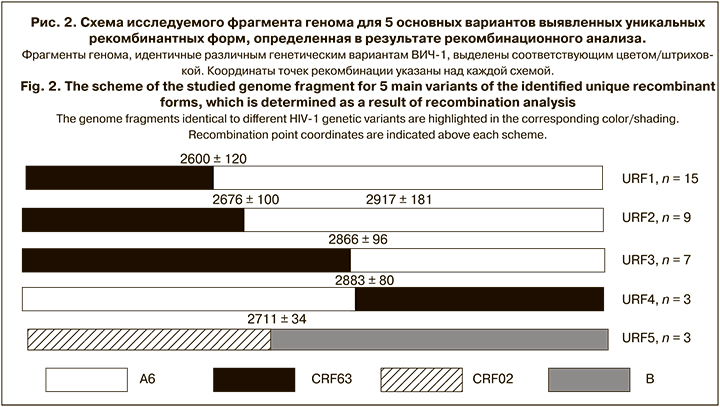
Помимо приведенных рекомбинантов, были определены точки рекомбинации для 11 образцов, среди которых встречались рекомбинанты CRF03/B (n = 2), CRF03/A6 (n = 2), CRF03/G/A6 (n = 2), а также единичные URFs, содержащие фрагменты, идентичные геномам ВИЧ-1 субтипов B, A6, F, CRF02_AG и CRF63_02A1.
Не было выявлено каких-либо значительных закономерностей в распределении генетических вариантов в зависимости от пути инфицирования пациента. Тем не менее стоит отметить, что 70 из 115 (60,89%) образцов варианта B Western было получено от МСМ, а еще 22 (19,13%) – от мужчин, инфицированных в результате неуточненного незащищенного полового контакта, которым вполне мог быть гомосексуальный контакт. Таким образом, на B Western в группе МСМ и мужчин, инфицированных через половой контакт, приходилось 54,26 и 10,58% соответственно. Однако доля субсубтипа A6 в тех же уязвимых группах также оказалась значительной: 34,88 и 68,27% соответственно. Известно, что хотя вариант ВИЧ-1 B Western исторически доминировал в среде МСМ в странах ВЕЦА, в последние годы доля субсубтипа A6 среди этих пациентов неуклонно увеличивается из-за стирания границ между разными уязвимыми группами [11, 12].
Кластерный анализ позволил выявить 140 молекулярных кластеров, к которым относились в общей сложности 369 (20,22%) образцов. Наиболее часто кластеры включали 2 образца (107 кластеров), реже 3 (13 кластеров), 4 (7 кластеров), а 13 содержали 5 образцов и более. Характеристика наиболее значительных кластеров (обозначены на рис. 1 как C01-C20) приведена в табл. 5.
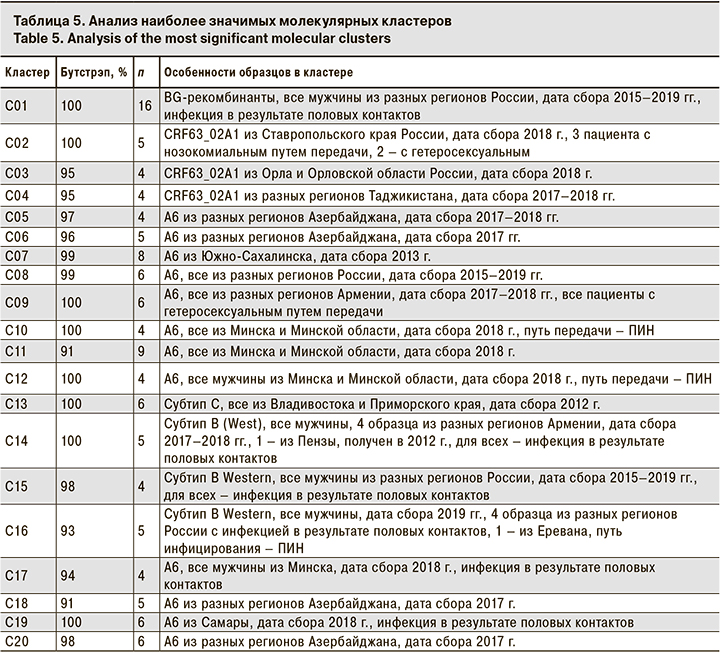
Вполне естественно, что основной характеристикой, связывающей образцы в кластере, была их принадлежность к определенному генетическому варианту и стране сбора образца. Так, самый большой кластер C01 (16 образцов) содержал исключительно образцы BG-рекомбинанта. Кластер C11 был образован 9 образцами субсубтипа A6 из Минска и Минской области, собранными в 2018 г. Наконец, кластер C13 был образован 6 образцами субтипа C, выделенными во Владивостоке и Приморском крае в 2012 г.
Для большинства кластеров отсутствовала зависимость между его формированием и полом пациента или путем инфицирования. Тем не менее для некоторых кластеров такая зависимость была очевидна.
Так, описанный выше кластер C01 включал исключительно образцы BG-рекомбинанта от мужчин, инфицированных половым путем. Учитывая, что вирусы в этих образцах были генетически близки вариантам ВИЧ-1, циркулирующим в среде МСМ в Западной Европе [15], можно предположить вероятный гомосексуальный путь передачи для всех упомянутых пациентов.
Кластеры C14, C15 и C16 были образованы образцами B Western, также полученными только от мужчин. Среди 14 образцов этих кластеров 7 были получены от МСМ, 2 – от пациентов с гетеросексуальным путем инфицирования, 4 – от пациентов с неуточненным половым путем передачи ВИЧ-1 и 1 – от ПИН. Тем не менее можно предположить, что пациенты, образцы от которых образовали кластеры C14–C16, в реальности относятся к МСМ или контактировали с источниками вируса из этой уязвимой группы.
Лишь 9 из 140 (6,43%) кластеров были образованы образцами из разных стран. Тем не менее описанные выше кластеры C14 и С16 включали в себя образцы из Армении и России, что говорит об эпидемиологической связи этих пациентов, несмотря на трансграничные ограничения.
Следует упомянуть, что 15 из 48 обнаруженных уникальных рекомбинантных форм также образовывали кластеры, что служило дополнительным подтверждением рекомбинационного анализа. В частности, кластеры образовывали 2/15 образцов URF1, 4/9 URF2 (2 кластера по 2 образца), 3/7 образцов URF3, 2/3 образцов URF4 и 2/3 образцов URF5.
Обсуждение
Наше исследование подтверждает общий для стран ВЕЦА тренд к постепенному увеличению доли гетеросексуального пути передачи ВИЧ-1 в регионе и сокращению доли ПИН в эпидемии ВИЧ-инфекции.
Отмечаемая в последние годы активная циркуляция рекомбинантных форм вируса, равно как и выявление новых уникальных рекомбинантов, вызывают опасения. Рекомбинация является одним из значимых факторов вирусного разнообразия, позволяющих вирусу уклоняться от действия иммунной системы и вырабатывать лекарственную устойчивость (через рекомбинацию между различными резистентными вариантами). Кроме того, некоторые рекомбинантные формы ВИЧ-1 имеют настолько многообразный мозаичный геном, что это затрудняет их исследование, искажая результаты анализа генетического родства или установления ближайшего общего предка [3]. В своем исследовании мы отмечаем большое количество случаев инфекции CRF63_02A1 в регионе Центральной Азии, что влияет на генетическое разнообразие ВИЧ-1 во всем регионе. При этом 56 образцов CRF63_02A1, давших сомнительный результат генотипирования с помощью HIVBlast, указывают как на общую генетическую гетерогенность этого рекомбинанта, так и на то, что современные приложения для автоматического генотипирования ВИЧ-1 пока несовершенны. А выявленные нами 48 образцов уникальных рекомбинантных форм свидетельствуют о постоянном процессе генетической изменчивости вируса в человеческой популяции.
Несмотря на то что более 20% исследованных нами образцов образовывали молекулярные кластеры, было сформировано небольшое число «смешанных» кластеров (6,43%), включавших в себя образцы из разных стран. Это может быть связано с различиями в плотности выборок образцов в каждой из стран-участниц исследования, так как сбор образцов и их анализ проводились неравномерно. При этом описанный в литературе ранее [11, 29] и частично подтвержденный нами факт стирания границ между странами и уязвимыми группами указывает на интенсификацию распространения инфекции в регионе и влияние на этот процесс трудовой миграции. Это требует дополнительных усилий от правительств и органов здравоохранения всех стран СНГ по предотвращению распространения вируса.
Заключение
Полученные результаты диктуют необходимость дальнейшего исследования генетического разнообразия ВИЧ-1 в регионе ВЕЦА и надзора за генерацией и распространением новых рекомбинантных форм ВИЧ-1.



